МГ ответы. Медицинская генетика 104. Наследственные заболевания человека, определение, классификация, методы лабораторной диагностики. Наследственные болезни
 Скачать 1.51 Mb. Скачать 1.51 Mb.
|
|
Мукополисахаридоз типа IV (снидром Моркио, болезнь Моркио). Частота до 1: 40 000. Дети рождаются без признаков болезни. Первые симптомы появляются в возрасте 1—3 года, и к 7—8 годам клиническая картина уже полностью выражена. Отмечаются резкая задержка роста (рост взрослого больного около 100 см), непропорциональное телосложение (относительно короткое туловище, микроцефалия, короткая шея), грубые черты лица, деформация грудной клетки (куриная, бочкообразная, килеобразная), кифоз или сколиоз грудного и поясничного отделов позвоночника). Питание снижено. Возникают контрактуры в локтевых, плечевых, коленных суставах, отмечается вальгусная деформация нижних конечностей, плоскостопие. Мышечная сила снижена. В случае компрессии спинного мозга помимо мышечной гипотонии отмечается поражение пирамидной системы, возможно развитие параплегии, паралича дыхания. Кожа утолщена, ее тургор и эластичность снижены. Часто выявляются пупочные и паховые грыжи, расхождение прямых мышц живота. Нередко отмечается снижение слуха, дистрофические процессы в роговице. Почти у всех больных, доживших до 20 лет, развивается глухота. Интеллект не снижен. При рентгенологическом исследовании обнаруживаются изменения позвонков: в шейном отделе выявляется гипоплазия или аплазия зубовидного отростка, в грудном — сколиоз, поясничном — кифоз; во всех отделах отмечается платиспондилия — уплощение и расширение тел позвонков), чем объясняется характерное укорочение туловища и необычно короткая шея. Изменяются кости таза: вертлужные впадины плоские и широкие, их крыша скошена, крылья подвздошных костей неправильной формы; контуры всех костей неровные; головки бедренных костей уплощены Характерна увеличивающаяся с возрастом вальгусная деформация нижних конечностей. Пястные кости и фаланги укорочены и утолщены; проксимальные концы пястных костей конусообразные, концевые фаланги гипоплазированы. Кости предплечья укорочены; локтевая кость не достигает луче-запястного сустава, отмечается вывих ее головки в локтевом суставе; эпифизы треугольной формы. Дистальные эпифизы костей голени скошены, стопы деформированы.В большинстве случаев летальный исход наступает до 20 лет вследствие сердечно-легочной недостаточности, развивающейся на фоне интеркуррентных заболеваний. Возможна внезапная смерть в результате смещения атланто-окципитального сочленения и повреждения ствола мозга. 126.Семейная гиперхолестеринемия, клиническая характеристика, методы диагностики, генетический риск. Семейная гиперхолестеринемия - аутосомно-доминантное заболевание, вызванное снижением скорости удаления липопротеинов низкой плотности (ЛНП) из кровотока вследствие мутаций в гене специфического рецептора ЛНП. У больных СГ наблюдается повышение в крови уровня общего холестерина и холестерина, ассоциированного с ЛНП, развитие атеросклеротической болезни и, как следствие, инфаркта миокарда. СГ - одно из наиболее распространенных моногенных заболеваний человека, частота его гетерозиготной формы составляет 1:500. Спектр мутаций гена рецептора ЛНП специфичен для разных этнических групп. Следствием нарушения обмена липопротеинов является резкое увеличение содержания холестерина в крови. уровень холестерина крови при редкой гомозиготной форме СГ (1:1 000 000) может повышаться до 600-1200 мг/дл (15 -30 мМ), при значительно более часто встречающейся гетерозиготной форме СГ (1:500) уровень холестерина повышается до 280-500 мг/дл (7 - 12.5 мМ), при нормальном уровне холестерина 120-180 мг/дл (3-4.5 мМ). Повышение уровня холестерина ЛНП у пациентов является причиной развития атеросклероза в сосудах эластического типа. Чаще всего поражаются коронарные сосуды, во вторую очередь - мозговые сосуды и артерии нижних конечностей. Результатом такого повреждения сосудов являются стенокардия, инфаркты миокарда, ишемические мозговые инсульты, перемежающаяся хромота. Клиника ишемической болезни сердца (ИБС) при гомозиготной форме СГ развивается к 15-20 годам, при гетерозиготной СГ, по крайней мере у мужчин, к 40 годам или ранее. Характерные клинические метки СГ - сухожильные ксантомы, ксантелазмы вокруг глаз, липоидные дуги роговицы при гетерозиготных формах СГ встречаются лишь в 25-30% случаев. Поэтому диагностика СГ основана на определении содержания отдельных классов липидов в плазме крови пациентов, на оценке клинических признаков и семейном анамнезе заболевания. наиболее ранним и вместе с тем чувствительным методом диагностики СГ является определение мутаций в гене рецептора ЛНП, вызывающих это заболевание. Подобная ДНК-диагностика должна проводиться в семьях с отягощенным анамнезом (атеросклероз у членов семьи в возрасте до 60 лет), у пациентов с высоким уровнем холестерина и их детей; она требует определения типа мутации в каждой конкретной Ранняя диагностика СГ, проведенная на основании биохимических или генетических данных, позволяет осуществлять медикаментозное лечение, которое у молодых пациентов более эффективно, чем у пациентов с развернутыми проявлениями. 127. Понятие о предиктивной (предсказательной) медицине и генах предрасположенности Гены предрасположенности — это варианты генов (аллели), совместимые с нормальной жизнью, но в неблагоприятных условиях они приводят к различным заболеваниям (атеросклерозу, заболеваниям сердечно-сосудистой системы, онкологическим заболеваниям разной локализации, артериальным и венозным тромбозам, сахарному диабету, ожирению, остеопорозу, к нарушению течения беременности и возможным аномалиям развития плода). Изучение полиморфизмов (вариантов) генов предрасположенности и составляет основу предиктивной (предсказательной) медицины. Тестируя полиморфизмы генов, выясняя сильные или слабые звенья своего генома, мы можем узнать, какая патология и с какой вероятностью ожидает нас в будущем. 128.Основные механизмы развития фармакогенетических реакций (повышенная чувствительность, толерантность, парадоксальность). Фармакогенетикаизучает индивидуальные различия в ответах на лекарства, обусловленные аллельными вариациями в генах, определяющих метаболизм лекарства, эффективность и токсичность. Индивидуальные вариации в ответе на лекарства осуществляются двумя путями. Во-первых, за счет фармакокинетических процессов(всасывания, транспортировки, метаболизма и выведения лекарства или метаболитов). Во-вторых, за счет фармакодинамикилекарства. Вследствие аллельных вариаций наблюдаются различия в мишенях (рецепторах, энзимах) или метаболических путях. Таким образом, говоря обобщенно, фармакогенетика изучает любые генетически детерминированные вариации в ответе на лекарства в отношении эффективности и токсичности. Врач сталкивается с повышенной чувствительностьюиндивида к лекарству, похожей на передозировку, хотя больному назначена доза, соответствующая его возрасту и полу; с частичнойили полной толерантностью больного к лекарству,даже несмотря на увеличение дозы; спарадоксальными реакциямина лекарство, включающими совсем другие осложнения, чем те, которые могли бы быть обусловлены механизмами действия лекарства. Генетическое разнообразие человека - основа индивидуальных различий биотрансформации ксенобиотиков, к которым и относятся лекарства. Следовательно, теоретической базой фарма-когенетики является функциональная геномика человека,а именно сведения о полиморфизме генов, вовлеченных в биотрансформацию лекарств и в генетический контроль их взаимодействия. Основная задача фармакогенетики - изучение аллельных вариантов генов, определяющих индивидуальные особенности фармако-кинетических и фармакодинамических характеристик организма. Расшифровка генома человека и прогресс фармакологии выдвинули фармакогенетику на одно из первых мест в персонализированной медицине(индивидуализированной лечение). Генетический полиморфизм определяет три главных фенотипа метаболизаторов (лиц, принимающих лекарства): экстенсивные, медленные и быстрые. Экстенсивные метаболизаторы- индивиды с нормальной скоростью метаболизма рассматриваемых лекарственных средств. К этой группе принадлежит большинство населения. Они являются чаще всего гомозиготами по «дикому» аллелю соответствующего фермента. Медленные метаболизаторы(иногда нулевые) характеризуются сниженной скоростью метаболизма рассматриваемого лекарственного средства. С генетической точки зрения они являются гомозиготами (при аутосомно-рецессивном типе наследования) или гетерозиготами (при аутосомно-доминантном типе наследования) по мутантному («медленному») аллелю соответствующего фермента. У таких лиц синтез фермента отсутствует или синтезируется неактивный («дефектный») фермент, в результате чего лекарственное средство накапливается в высоких концентрациях, что и приводит к появлению нежелательных побочных реакций. Отсюда ясно, что для медленных метаболизаторов доза лекарства должна быть меньшей или назначают другое лекарство. Сенсибилизация (лат. sensibilisatio — чувствительный) — одна из причин качественного изменения эффекта (повышения чувствительности) при повторном введении лекарственных средств, в том числе и аллергические реакции. К повышенным реакциям относится идиосинкразия (греч. idios — своеобразный; synkrasis — слияние, смешивание), т. е. повышенная генетически обусловленная реакция организма при введении медикаментов в малых дозах, связанная с недостаточной активностью некоторых ферментов. Быстрые(или сверхактивные) метаболизаторыхарактеризуются повышенной скоростью метаболизма определенных лекарств. В основном это гомозиготы (при аутосомно-рецессивном типе наследования) или гетерозиготы (при аутосомно-доминантном типе наследования) по «быстрому» аллелю соответствующего фермента. Достаточно часто встречаются индивиды с копиями функциональных аллелей, что также приводит к повышенному метаболизму лекарства. Быстрый метаболизм лекарства не позволяет при стандартных дозах достичь его терапевтической концентрации в крови, поэтому доза лекарства для быстрых метаболизаторов должна быть выше, чем для нормальных метаболизаторов. Привыкание к лекарственным средствам (синоним толерантность к лекарственным средствам) — ослабление эффектов лекарственных средств при их повторном применении. Чем выше толерантность употребляющего к веществу, тем большие дозы ему необходимы для получения ожидаемого эффекта. Ферменты, обеспечивающие фармакокинетические функции всасывания, распределения и выведения из организма лекарственных средств, называют «транспортерами лекарств». К ним относятся гликопротеин Р, транспортеры органических анионов и катионов и др. Наибольший интерес с фармакогенетической точки зрения представляет полиморфизм гена MDR1,кодирующий гликопротеин Р(локус 7q21.1). Этот фермент контролирует выброс различных ксенобиотиков из клетки, препятствует всасыванию лекарственных средств из кишечника. Субстратами гликопротеина Р являются сердечные гликозиды, блокаторы медленных кальциевых каналов, статины, макролиды, цитостатики, противовирусные препараты. Наиболее значимой мутацией гена MDR1является С3435Т. Замена цитозина на тимин в 26-м экзоне ведет к серьезному нарушению функции гликопротеина Р, что может быть причиной тяжелой интоксикации в случае применения многих лекарств, патологических реакций на лекарственной средство. 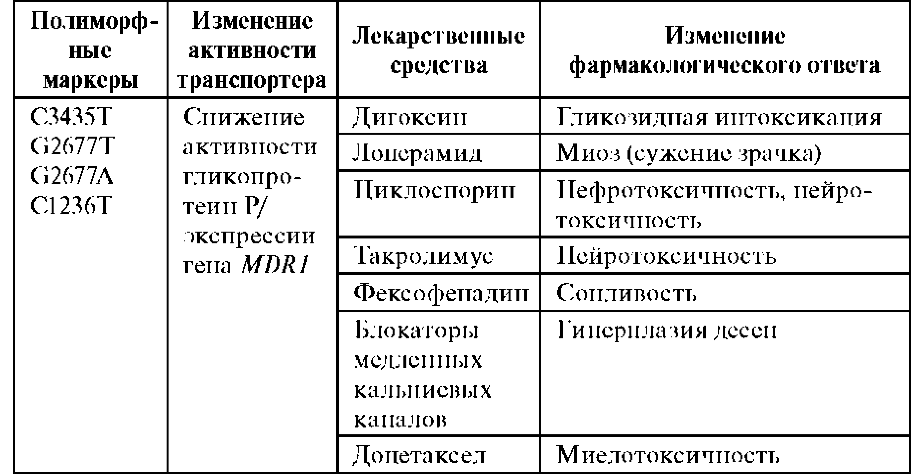 Парадоксальная реакция– ответ на прием лекарственного средства, по направленности противоположный ожидаемому (основному). Парадоксальные реакции проявляются приступами стенокардии при приеме нитратов, антагонистов кальция, β-адреноблокаторов, вплоть до развития инфаркта миокарда и внезапной смерти. 129.Генетика мультифакториальных заболеваний. Особенности расчета генетического риска. В структуре патологии человека, наряду с наследственными заболеваниями, строго детерминированными генетическими причинами (моногенные и хромосомные болезни) и заболеваниями, вызванными только внешне-средовыми факторами (травмы, ожоги), основную долю (более 90 %) составляют заболевания, развивающиеся при взаимодействии генетических и средовых факторов. Эта многочисленная группа широко распространенных в популяции заболеваний называется болезнями с наследственной предрасположенностью или мультифакториальными. Болезни с наследственной предрасположенностью возникают у лиц с определенным генотипом (сочетание «предрасполагающих» аллелей) при провоцирующем действии факторов внешней среды. Наследственная предрасположенность к заболеванию может иметь моногенную или полигенную природу. Генетической основоймоногенныхформ наследственной предрасположенности являются мутации единичных генов, которые, как правило, наследуются по аутосомно-рецессивному (например, недостаточность лактазы) или Х-сцепленному рецессивному типу (например, недостаточность глюкозо-6-фосфатдегидрогеназы). Однако строго соответствующего законам Менделя распределения пораженных потомков в поколениях наблюдаться не будет. Это обусловлено тем, что для проявления данного патологического признака носитель мутации должен обязательно вступить в контакт со специфическим провоцирующим внешним фактором. В отсутствии подобного контакта мутантный ген остается «молчащим» и не проявляется в виде патологического признака. Этиологической основойполигенныхзаболеваний с наследственной предрасположенностью является взаимодействие аллелей нескольких генов с комплексом внешнесредовых факторов. Соотношение влияния генетических и средовых факторов различно не только для данной болезни, но и для каждого конкретного больного. Для родословных семей, отягощенных болезнями с полигенной наследственной предрасположенностью, характерны следующие черты: распределение больных и здоровых индивидов в родословной не подчиняется законам Менделя; семейное накопление, т.е. в отдельных семьях они будут встречаться чаще, чем в целом в популяции и в родословной будет более одного пораженного; риск для здоровых родственников зависит от тяжести течения заболевания у пробанда и его пола - чем тяжелее заболевание у пробанда, тем выше риск заболевания для его родственников; риск для родственников так же выше, если пробанд принадлежит к реже подверженному к данному заболеванию полу; чем больше число пораженных родственников, тем больше риск заболеть для непораженных кровных родственников; для кровных родственников риск определяется степенью родства с пробандом - чем выше степень родства, тем выше риск. Генетический прогноз при мультифакториальных заболеваниях зависит от следующих факторов: чем ниже частота болезни в популяции, тем выше риск для родственников пробанда; чем сильнее степень выраженности болезни у пробанда, тем больше риск развития болезни у его родственников; риск для родственников пробанда зависит от степени родства с пораженным членом семьи; риск для родственников будет выше, если пробанд относится к менее поражаемому полу; При мультифакториальных заболеваниях, т.е. заболеваниях с наследственным предрасположением, основой оценки риска являются эмпирические данные о популяционной и семейной частоте каждого из них. Специфический генетический риск до 5% принято считать низким, до 10% —повышенным в легкой степени, до 20% —средним, выше 20% — высоким. Генетический риск средней степени расценивают как противопоказание к зачатию или показание к прерыванию уже имеющейся беременности. Возможность проведения пренатальной диагностики является определяющей для принятия положительного решения в отношении завершения беременности. 130.Виды и уровни профилактики наследственных и врожденных болезней. Пути проведения профилактических мероприятий. Профилактика- это комплекс мероприятий, направленных на предупреждение возникновения и развития наследственных и врожденных болезней. Различают три ступени профилактики наследственной патологии. Первичная профилактиканаследственных болезней - это комплекс мероприятий, направленных на предупреждение зачатия больного ребенка. Реализуется это планированием деторождения и улучшением среды обитания человека. Планирование деторождениявключает три основные позиции. Оптимальный репродуктивный возраст, который для женщин находится в пределах 21-35 лет (более ранние или поздние беременности увеличивают вероятность рождения ребенка с врожденной патологией). Отказ от деторождения в случаях высокого риска наследственной и врожденной патологии (при отсутствии надежных методов дородовой диагностики, лечения, адаптации и реабилитации больных). Отказ от деторождения в браках с кровными родственниками и между двумя гетерозиготными носителями патологического гена. Улучшение среды обитания человеканаправлено главным образом на предупреждение вновь возникающих мутаций. Осуществляется это жестким контролем содержания мутагенов и тератогенов в среде обитания человека. Вторичная профилактикаосуществляется за счет прерывания беременности в случае высокой вероятности заболевания у плода или установлению диагноза пренатально. Прерывание может происходить только с согласия женщины в установленные сроки. Основанием для элиминации эмбриона или плода является наследственная болезнь. Прерывание беременности - решение явно не самое лучшее, но в настоящее время единственно пригодное при большинстве тяжелых и смертельных генетических дефектов. Третичная профилактиканаследственных болезней направлена на предотвращение развития заболевания у родившегося ребенка или его тяжелых проявлений. Эту форму профилактики можно назвать нормокопированием, т.е. развитие здорового ребенка с патологическим генотипом. Третичная профилактика некоторых форм наследственной патологии может совпадать с лечебными мероприятиями в общемедицинском смысле. Предотвращение развития наследственного заболевания (нормокопирование) включает в себя комплекс лечебных мероприятий, которые можно осуществлять внутриутробно или после рождения. Для некоторых наследственных заболеваний (например - резус-несовместимость, некоторые ацидурии, галактоземия) возможно внутриутробное лечение. Наиболее широко предотвращение развития заболевания используется в настоящее время для коррекции (лечения) после рождения больного. Типичным примером третичной профилактики могут быть фенилкетонурия, гипотиреоз. Можно еще назвать целиакию - заболевание, которое развивается в начале прикорма ребенка манной кашей. У таких детей имеется непереносимость злакового белка глютена. Исключение таких белков из пищи полностью гарантирует ребенка от тяжелейшей патологии желудочно-кишечного тракта. Профилактика осуществляется в нескольких организационных формах: медико-генетическое консультирование; периконцепционная профилактика; пренатальная и преимплантационная диагностика; преклиническая диагностика; диагностика гетерозиготных состояний; диспансеризация семей с наследственной патологией; проверка на мутагенность и гигиеническая регламентация факторов среды; пропаганда медико-генетических знаний среди медицинского персонала и населения. В настоящее время в практическом здравоохранении в России программы профилактики врожденной и наследственной патологии реализуются в медико-генетическом консультировании, пренатальной диагностике, неонатальном скрининге на наследственные болезни обмена.Остальные формы еще не введены |
