Методические указания для самостоятельной работы и выполнения лабораторнопрактических работ по фармацевтической химии
 Скачать 7.05 Mb. Скачать 7.05 Mb.
|
|
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования БЕЛГОРОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Фармацевтический факультет Кафедра фармацевтической химии и фармакогнозии МЕТОДИЧЕСКИЕ УКАЗАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ И ВЫПОЛНЕНИЯ ЛАБОРАТОРНО-ПРАКТИЧЕСКИХ РАБОТ ПО ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ Для студентов 3 - 5 курсов специальности «Фармация» Белгород - 2009 TЕMA 1: ТЕХНИКА БЕЗОПАСНОСТИ РАБОТА С НОРМАТИВНОЙ ДОКУМЕНТАЦИЕЙ, УЧЕБНИКАМИ, ПРАКТИКУМАМИ, УЧЕБНЫМИ ПОСОБИЯМИ КАФЕДРЫ, СПРАВОЧНИКАМИ. ПОРЯДОК ОФОРМЛЕНИЯ РАБОТ. ОБЩИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ НЕОРГАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ: ИСПЫТАНИЕ НА ПОДЛИННОСТЬ. Вопросы для самоконтроля 1. Основные правила техники безопасности при работе в химической лаборатории. 2. Основные приемы оказания первой медицинской помощи при химических, термических ожогах, поражениях электротоком, порезах, ингаляционных воздействиях токсикантов. 3. Фармацевтическая химия как наука, фармацевтическая терминология: лекарственное средство, лекарственная форма, лекарственный препарат. 4. Структура Государственной фармакопеи X и XI изданий, их значение для оценки качества лекарственных средств. 5. Нормативная документация (НД), фармакопейные статьи предприятий (ФСП), регламентирующие качество лекарственных средств. 6. Опишите пробы и реакции идентификации катионов калия, натрия, аммония, магния, кальция, железа, цинка, свинца, висмута, ртути, серебра, меди (реактивы, условия, эффекты реакций). Напишите соответствующие уравнения химических реакций. 7. Опишите реакции идентификации анионов: хлоридов, бромидов, иодидов, сульфатов, фосфатов, нитритов, нитратов, боратов, карбонатов и гидрокарбонатов (реактивы, условия, эффекты реакций). Напишите соответствующие уравнения химических реакций. БЛОК ИНФОРМАЦИИ Среди лекарственных веществ встречаются соединения, водные растворы которых являются электролитами (кислоты, основания, соли). Основными свойствами электролитов (в отличие от неэлектролитов) является их способность вступать в реакции двойного обмена с другими электролитами. Такие реакции протекают быстро, и части молекул, которыми обмениваются при этих реакциях электролиты, реагируют независимо одна от другой. В реакцию как бы вступают части молекул, которые образуют продукт реакции с определённой частью молекулы реагента. Например, при прибавлении к раствору бариевой соли (хлорида, нитрата, ацетата) раствора любой сернокислой соли образуется один и тот же продукт – сульфат бария:Ba(NO3)2 + Na2SO4 BaSO4 + 2NaNO3 BaCl2 + Na2SO4 BaSO4 + 2NaCl Ba(CH3COO)2 + Na2SO4 BaSO4 + 2CH3COONa Эти реакции объясняются тем, что молекулы химических соединений, растворы которых способны проводить электрический ток, во время растворения вещества распадаются на ионы (электролитическая диссоциация). Большая часть кислот, оснований и солей являются ионогенными, и реакции электролитов представляют реакции ионогенного типа. Анализ минеральных веществ основывается на реакциях отдельных ионов. В результате этих реакций возможны следующие случаи:
Са2+ + С2О4 СаС2О4
Fe3+ + 3(SCN)- Fe(SCN)3
SO32- + 2H+ H2O + SO2
Ag+ + 2(CN)- [Ag(CN)2]- КАЧЕСТВЕННЫЕ РЕАКЦИИ ОБНАРУЖЕНИЯ КАТИОНОВ. КАЛИЙ 1. Окрашивание пламени. Соли щелочных и щелочноземельных металлов окрашивают пламя горелки. Это объясняется их восстановлением в пламени горелки до нейтральных атомов, малым потенциалом ионизации s1 – электрона и его способностью легко возбуждаться и переходить на возбуждённые уровни. При обратном переходе электрон испускает квант света. При внесении солей, содержащих ионы калия в приветное пламя горелки, происходит окрашивание пламени в фиолетовый цвет. 2. К 2 мл раствора KCl прибавляют 1 мл раствора винной кислоты и 1 мл раствора натрия ацетата. При охлаждении и потирании стеклянной палочкой о стенки пробирки выпадает белый кристаллический осадок.  Осадок растворим в кислотах (образование винной кислоты) и в щелочах (образование средних солей). Образование осадка может быть ускорено добавлением спирта или уксусной кислоты. НАТРИЙ Окрашивание пламени. Бесцветное пламя горелки окрашивается солями натрия в желтый цвет. АММОНИЙ 1. Разложение при нагревании. К 3 каплям раствора аммония хлорида прибавляют 4 капли раствора натрия гидроксида и осторожно нагревают. Выделяется аммиак, обнаруживаемый по запаху или по посинению красной лакмусовой бумажки. NH4+ + NaOH NH3+ Na+ + H2O 2. К 3 каплям раствора хлорида аммония прибавляют 2 - 3 капли реактива Несслера - появляется осадок красно-бурого цвета или желто-бурое окрашивание. 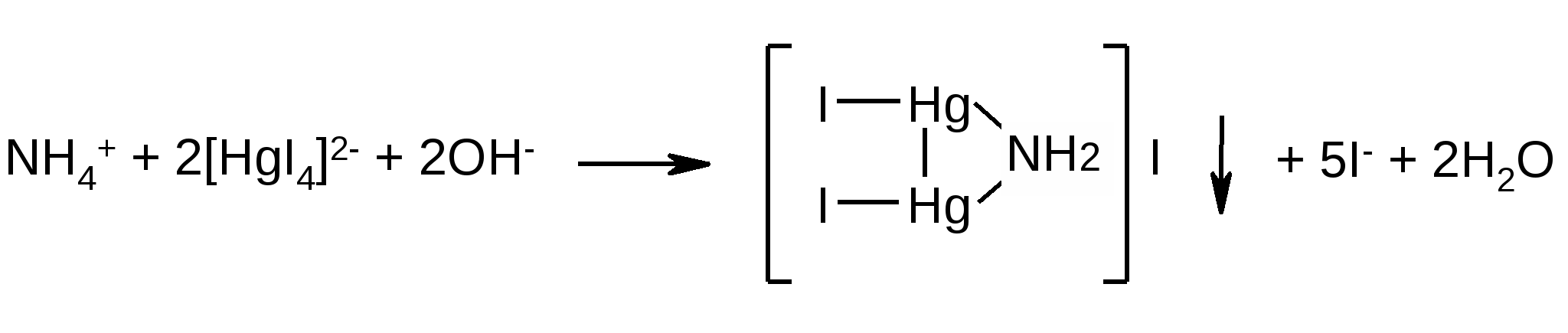 МАГНИЙ 1. К 1 мл раствора соли магния прибавляют 1 мл раствора аммиака и хлорида аммония и по каплям раствор натрия гидрофосфата. Выпадает белый кристаллический осадок. Mg2+ + PO43– + NH4+ NH4MgPO4 белый Реакцию проводят в присутствии аммония хлорида во избежание выпадения в щелочной среде осадка Mg(OH)2. Присутствие NH4Cl препятствует выпадению такого осадка вследствие связывания OH- - иона аммоний-ионами. При большом избытке NH4Cl осаждение магний-аммоний фосфата не наступает, потому что образуются комплексные ионы трихлормагния и тетрахлормагния. 2. К 1 мл раствора соли магния прибавляют по каплям раствор 8-оксихинолина - появляется зеленовато-желтый осадок оксихинолята магния. КАЛЬЦИЙ 1. К раствору препарата прибавляют 1 мл раствора аммония оксалата. Образуется белый осадок.  Осадок нерастворим в уксусной кислоте (отличие от оксалатов бария и стронция) и растворе аммиака, растворим в растворах сильных кислот (образование щавелевой кислоты). Реакцию лучше проводить в слабокислой среде (рН = 6,0 – 6,5). ЦИНК 1. К 2 мл раствора соли цинка прибавляют 0,5 мл раствора натрия сульфида образуется осадок белого цвета, нерастворимый в уксусной кислоте и растворимый в разведённой хлороводородной кислоте: Zn2+ + S2– ZnS белый ZnS + 2HCl ZnCl2 + Н2S 2. К 2 мл раствора соли цинка прибавляют 0,5 мл кислого раствора калия ферроцианида - образуется белый студенистый осадок, нерастворимый в разведённой соляной кислоте: Zn2+ + K4[Fe(CN)6] K2Zn[Fe(CN)6] + 2K+ белый СВИНЕЦ 1. К 1 мл раствора соли свинца прибавляют -4-5 капель раствора калия иодида, выпадает желтый осадок, растворимый в избытке реактива с образованием бесцветного комплекса. PbI2 растворим в горячей воде и в уксусной кислоте. При охлаждении раствора выпадает осадок в виде золотых чешуек. 2. К 3 каплям раствора соли свинца прибавляют несколько капель раствора натрия сульфида, образуется черный осадок. СЕРЕБРО 1. К раствору серебра нитрата прибавляют раствор аммиака (до растворения образующегося осадка), 2 - 3 капли формалина и нагревают. На стенках пробирки образуется налет металлического серебра (реакция «серебряного зеркала»). 2. Ионы серебра образуют осадки с хлоридами, бромидами, иодидами. Образующиеся галогениды различают по растворимости в растворе аммиака. К 1 мл раствора соли серебра прибавляют 2 - 3 капли раствора натрия хлорида или разведенной кислоты хлороводородной - образуется белый творожистый осадок, растворимый в растворе аммиака, с образованием бесцветного комплексного соединения хлорида диамминсеребра: AgCl + 2NH3 [Ag(NH3)2]Cl Хлорид диамминсеребра взаимодействует с азотной кислотой выделяя осадок AgCl. Осадок бромида серебра светло-жёлтого цвета малорастворим в аммиаке: Ag+ + Br– AgBr светло-желтый Жёлтый осадок йодида серебра нерастворим в растворе аммиака: Ag+ + I– AgI желтый МЕДЬ. 1. Раствор аммиака сначала осаждает из растворов солей меди (II) осадок основных солей меди голубовато-зелёного цвета, который растворим в избытке реактива с образованием тетраамминмедь (II) – иона синего цвета. К 1 мл раствора сульфата меди прибавляют по каплям раствор аммиака - выпадает синий осадок, который растворяется в избытке реактива с образованием раствора темно-синего цвета. 2CuSO4 + 2NH3 + 2H2O Cu(OH)2SO4 + (NH4)2SO4 Cu(OH)2SO4 + (NH4)2SO4 + 6NH3 2[Cu(NH3)4]2+ + 2SO42- + 2H2O 2. К нескольким каплям раствора меди сульфата прибавляют раствор ферроцианида калия до образования красно-бурого осадка. ЖЕЛЕЗО (II) 1. К 1 мл раствора железа (П) сульфата прибавляют 1 мл 2М кислоты хлороводородной и 1 мл раствора калия феррицианида; выпадает осадок синего цвета. Fe2+ + K3[Fe(CN)6] KFe[Fe(CN)6] + 2K+ синий Соединение КFe3+[Fe2+(CN)6] носит тривиальное название турнбулевой сини и по данным рентгеноструктурных исследований идентично берлинской лазури КFe3+[Fe2+(CN)6]. Реакция проводится в кислой среде. ЖЕЛЕЗО (III) 1. К 1 мл раствора хлорида железа (III) прибавляют 2-3 капли 2М кислоты хлороводородной и 2-3 капли раствора калия ферроцианида - образуется темно-синий осадок. Fe3+ + K4[Fe(CN)6] KFe[Fe(CN)6] + 3K+ синий 2. К 1 мл раствора анализируемого вещества прибавляют 1 мл разведенной кислоты хлороводородной и 4-5 капель раствора аммония тиоцианата - появляется винно-красное окрашивание. Fe3+ + 3SCN– Fe(SCN)3 КАЧЕСТВЕННЫЕ РЕАКЦИИ ОБНАРУЖЕНИЯ АНИОНОВ. ХЛОРИДЫ, БРОМИДЫ, ИОДИДЫ. 1. К 2 мл раствора испытуемого вещества прибавляют 0,5 мл разведенной кислоты азотной и 0,5 мл раствора серебра нитрата выпадают творожистые осадки белого (AgCl), слегка желтоватого (AgBr), и жёлтого (Agl) цветов. Все осадки нерастворимы в разведенной азотной кислоте и имеют различную растворимость в растворе аммиака (проверить растворимость!). 2. Окисление до элементарного галогена (для бромидов и йодидов). Бромиды идентифицируют по реакции выделения брома в результате окислительно-восстановительной реакции между бромидом и хлорамином в кислой среде. Выделяющийся в результате реакции молекулярный бром извлекают хлороформом. Хлороформный слой окрашивается при этом в желто-бурый цвет. Йодиды являются выраженными восстановителями. Поэтому слабые окислители выделяют молекулярный йод из йодидов. Йод окрашивает крахмал в синий цвет; раствор йода в хлороформе окрашен в фиолетовый цвет. Сильные окислители переводят йодиды в бесцветные гипойодиты (IO−) или йодаты (IO3−), поэтому выбор окислителя и его концентрация имеет большое значение. ГФ рекомендует использовать для окисления йодидов растворы железа (III) хлорида или натрия нитрита. В качестве окислителя ГФ предлагает также применять кислоту серную концентрированную, при действии которой на йодиды при нагревании выделяются фиолетовые пары йода. К 1 мл раствора испытуемого вещества прибавляют 1 мл разведенной кислоты хлороводородной, 0,5 мл раствора хлорамина Б и 1 мл хлороформа. Взбалтывают. Выделившийся бром окрашивает хлороформ в желто-бурый, а иод - в фиолетовый цвет.  2KBr + Cl2 → Br2 + 2KCl СУЛЬФАТЫ 1. К 1 мл раствора анализируемого вещества прибавляют 0,5 мл раствора бария хлорида: появляется белый кристаллический осадок, нерастворимый в растворах минеральных кислот. ФОСФАТЫ 1. К 1 мл раствора анализируемого вещества прибавляют несколько капель раствора серебра нитрата - образуется желтый осадок, растворимый в разведенной азотной кислоте и растворе аммиака. 3Ag+ + PO43– Ag3PO4 2. К 1 мл раствора соли фосфата прибавляют 1 мл раствора аммония хлорида. 1 ил раствора аммиака, 0,5 мл раствора магния сульфата - образуется белый кристаллический осадок. БОРАТЫ Несколько кристалликов борной кислоты смешивают с 1-2 мл этанола, прибавляют 1 каплю концентрированной серной кислоты и поджигают - пламя имеет окрашенные в зеленый цвет края.  КАРБОНАТЫ И ГИДРОКАРБОНАТЫ 1. К 0.2 г препарата прибавляют 0,5 мл разведенной минеральной кислоты (хлороводородной или серной) - выделяются пузырьки углекислого газа. CO32– + 2HCl CO2 + H2O + 2Cl– HCO3– + HCl CO2 + H2O + Cl– 2. К 2 мл раствора анализируемого вещества прибавляют 5 капель насыщенного раствора сульфата магния: карбонаты образуют белый осадок при комнатной температуре, гидрокарбонаты - при кипячении. ОБРАЗЕЦ ОФОРМЛЕНИЯ ПРОТОКОЛА ЗАНЯТИЯ ПО ОБЩИМ МЕТОДАМ ОПРЕДЕЛЕНИЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ НЕОРГАНИЧЕСКОГО ПРОИСХОЖДЕНИЯ. РЕАКЦИИ НА ПОДЛИННОСТЬ. ДАТА................................................................................................................ ТЕМА ЗАНЯТИЯ............................................................................................
ТЕМА 2. ОБЩИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ. ОПРЕДЕЛЕНИЕ РАСТВОРИМОСТИ, ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ И КИПЕНИЯ, КИСЛОТНОСТИ, ЛЕТУЧИХ ВЕЩЕСТВ, ВОДЫ, ЗОЛЫ. ИСПОЛЬЗОВАНИЕ ФИЗИКО-ХИМИЧЕСКИХ КОНСТАНТ В ОЦЕНКЕ ДОБРОКАЧЕСТВЕННОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ. Вопросы для самоконтроля 1. Назовите источники и причины недоброкачественности лекарственных средств. 2. Приведите основные типы реакций, приводящих к изменению лекарственных веществ под воздействием факторов окружающей среды. 3. Опишите природу и характер примесей. Специфические и неспецифические (общие) примеси. Допустимые и недопустимые примеси. 4. Дайте определение показателей «описание» и «растворимость» согласно ГФ XI, их значение для оценки качества лекарственных средств. Условные термины растворимости. 5. Дайте определение понятиям: температура плавления и затвердевания, температура кипения. Опишите способы их определения. 6. Опишите определение кислотности, летучих веществ, золы и воды в лекарственных средствах. Напишите уравнение химической реакции титрования воды по методу К.Фишера. 7. Опишите возможность использования физико-химических констант в оценке доброкачественности лекарственных средств. Дайте определения понятиям: Rf, Rs, удельный и молярный показатели поглощения, показатель преломления, удельное вращение. Напишите формулы для их расчета.
Для выполнения определения растворимости подбирают лекарственный препарат из указанных в таблице 1. Для каждого из испытаний рассчитывают массу лекарственного вещества, необходимую, для того, чтобы на установление растворимости в воде расходовалось не более 100 мл растворителя, в органических растворителях - не более 10-30 рассчитанную массу предварительно растертого в порошок препарата взвешивают на ручных весах (с точностью до 0.01 г) и вносят измеренный объем растворителя, соответствующий его минимальному объему (таблица 2). Затем добавляют растворитель до максимального его объема и непрерывно встряхивают в течение 10 минут при температуре +20° С. Препарат считается полностью растворившимся тогда, когда невооруженным взглядом в проходящем свете не будут обнаруживаться частицы вещества. При испытании растворимости медленно растворимых веществ (процесс растворения длится более 10 минут) допускается нагревание на водяной бане до 30° С. Результат наблюдают после охлаждения раствора до 20° С и энергичного встряхивания в течение 1-2 минут. Полученные сведения о растворимости оформляют в виде таблицы 3, пользуясь сокращенными обозначениями условных терминов. Делают заключение о соответствии растворимости испытуемых лекарственных веществ требованием соответствующих статей ГФ. Растворимость некоторых лекарственных средств в терминах в соответствии с требованиями ГФ Х представлены в таблице 4. Таблица 1 Растворимость некоторых лекарственных препаратов (в мл на 1,0 г препарата)
* - испытание проводится ** - определение проводится с малорастворимым веществом Таблица 2 Соответствие условных терминов растворимости объемам растворителей (мл), необходимых для растворения 1,0 г препарата.
Таблица 3 Сведения о растворимости испытуемых лекарственных веществ
Таблица 4 Растворимость некоторых лекарственных средств в терминах в соответствии с требованиями ГФ Х.
2. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ Температура плавления некоторых лекарственных средств и условия её определения представлены в таблице 5. Таблица 5 Температура плавления некоторых лекарственных препаратов
Методика определения. При определении температуры плавления по методам 1 и 1а вещества предварительно высушивают в вакуум-эксикаторе над серной кислотой в течение 24 часов или в сушильном шкафу при 100-105° С в течение 24 часов. Высушенное вещество помещают в капилляр, имеющий диаметр от 0,9 до 1 мм и толщину стенки от 0,1 до 0,15 мм, запаянный с одного конца. Его заполняют так, чтобы после уплотнения вещество имело высоту слоя около 3 мм. Слой уплотняют капиллярной палочкой или «многократным пропусканием в вертикально поставленную стеклянную рубку высотой не менее 50 см. Нагревание проводят сначала быстро, за десять градусов до ожидаемого начала плавления капиллярную трубку с веществом вносят в прибор. Для этого быстро вынимают термометр, прикрепляют к нему капиллярную трубку с помощью резинового колечка или тонкой проволоки снова вносят в прибор. Запаянный конец капилляра должен находиться на уровне середины ртутного шарика термометра. Продолжают нагревание скоростью: метод 1 для веществ с температурой плавления < 100° С - от 0,5 до 1° в минуту. для веществ с температурой плавления от 100° до 150° С - от 1 до 1,5° в минуту. метод 1а (для веществ, неустойчивых при нагревании) - от 2,5 до 3,5 °С в минуту. Для каждого испытуемого лекарственного препарата необходимо провести не менее двух параллельных определений. Расхождения между результатами не должны отличаться более чем на один градус. Результаты определений оформляют в виде таблицы 6. Таблица 6 Результаты определения температуры плавления лекарственного
3. ОПРЕДЕЛЕНИЕ КИСЛОТНОСТИ ИЛИ ЩЕЛОЧНОСТИ РАСТВОРОВ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ Для выполнения испытаний пользуются данными, приведенными в таблице 7. Если в указанных условиях первоначальная или конечная окраска испытуемого раствора не соответствует указанной в ГФ, препарат не отвечает ее требованиям. Таблица 7 Условия определения кислотности или щелочности растворов
Результаты испытания оформляют в виде таблицы 8. Таблица 8 Результаты определения кислотности или щелочности лекарственных препаратов.
4. ОПРЕДЕЛЕНИЕ рН РАСТВОРА ЛЕКАРСТВЕННОГО ПРЕПАРАТА КОЛОРИМЕТРИЧЕСКИМ МЕТОДОМ (с применением универсальной индикаторной реактивной бумаги). Объекты исследования: раствор кислоты никотиновой 1% для инъекций (рН 5,0-7,0); раствор кальция хлорида 10% для инъекций (рН 5,5-7,0): раствор кальция глюконата 10% для инъекций (рН 6.0-7.5); раствор димедрола 1% для инъекций (рН 5,0-6,5); раствор эуфиллина 2,4% или 12% для инъекций (рН 9,0-9,7); раствор глюкозы 5%, 10%. 25% и 40% для инъекций (рН 3,0-4,0); раствор натрия хлорида 0,9% для инъекций (рН 5,0-7,0); раствор натрия цитрата для инъекций (рН 7,8-8,3). Окраску индикаторной бумаги после нанесения на нее испытуемого раствора сравнивают со шкалой и определяют приблизительное значение рН (таблица 9). Таблица 9 Интервалы изменения окраски универсальной индикаторной реактивной бумаги
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
