зайко. Н. Н. Зайко Патологическая физиология Введение Предмет и задачи патологической физиологии Патологическая физиология есть наука, изучающая жизнедеятельность больного организма. Программа
 Скачать 7.32 Mb. Скачать 7.32 Mb.
|
|
Глава 22. Патологическая физиология печени Общая характеристика патологических процессов в печени Печень выполняет в организме целый ряд функций, среди которых важнейшие – участие в пищеварении, обмене веществ, гемодинамике. Велика также защитная (барьерная) роль этого органа. Все эти функции печени, направленные на сохранение гомеостаза, нарушаются при ее патологии, которая проявляется как в виде самостоятельных заболеваний печени (например, вирусный гепатит), так и печеночных синдромов (желтуха, холестаз, холемия, портальная гипертензия и др.), определяющих клинику данной нозологической формы болезни печени или же сопутствующих заболеваний других органов и систем (например, желтуха при гемолитической болезни новорожденных). В связи с этим различают первичные и вторичные поражения печени. В основе различных заболеваний печени чаще всего лежат такие патологические процессы, как воспаление, нарушения периферического кровообращения, обмена веществ, опухоли. Воспалительные поражения печени называются гепатитами, первичное изменение обмена веществ гепатоцитов с развитием дистрофии – гепатозами и обменными заболеваниями печени (например, жировой гепатоз или жировая дистрофия печени; гликогеноз), а диффузное разрастание соединительной ткани на фоне дистрофии, некроза паренхимы и перестройки структуры органа -циррозом печени. Этиология. По этиологии все поражения печени подразделяются на приобретенные и наследственные. К этиологическим факторам, вызывающим болезни печени и синдромы, относятся следующие: 1. инфекционные – вирусы и бактерии (вирусы вирусного гепатита, инфекционного мононуклеоза, возбудитель туберкулеза, сифилиса и др.), простейшие (лямблии, амебы), грибы (актиномицеты), гельминты (эхинококк, аскариды); 2. токсические вещества – экзогенного (алкоголь; лекарственные препараты – ПАСК-натрий, сульфаниламиды, биомицин, тетрациклин, цитостатики; промышленные яды – четыреххлористый углерод, хлороформ, мышьяк, фосфорорганические инсектициды; растительные яды – афлатоксин, мускарин, алкалоиды гелиотропа) и эндогенного происхождения (продукты распада тканей при ожоге, некрозе; токсикоз беременности); 3. физические факторы – ионизирующая радиация (лучевой гепатит), механическая травма; 4. алиментарные факторы – белковое, витаминное голодание, жирная пища; 5. аллергические реакции – при введении вакцин, сывороток, пищевых и лекарственных аллергенов; 6. нарушение кровообращения в печени местного (ишемия, венозная гиперемия, тромбоз, эмболия) и общего характера (при сердечно-сосудистой недостаточности); 7. эндокринные и обменные нарушения в организме (сахарный диабет, гипертиреоз, ожирение); 8. опухоли – первичные (гепатокарцинома) и метастатические (при раке желудка, легких, молочной железы, лейкозные инфильтраты); 9. генетические дефекты обмена (наследственные ферментопатии), врожденные пороки анатомического положения и структуры печени вследствие нарушения внутриутробного развития. Патогенез. В патогенезе поражений печени различной этиологии следует отметить две разновидности патологических реакций: 1. прямое повреждение печени этиологическим фактором (вирусы, химические вещества, нарушение кровотока), проявляющееся дистрофическими изменениями в ней вплоть до некроза; 2. аутоиммунное повреждение печени вследствие появления аутоантигенов (патологически измененные компоненты гепатоцитов, образовавшиеся при прямом поражении печени) и развития аутоаллергических реакций гуморального и клеточного типа. Последние углубляют повреждение печени в результате микроциркуляторных нарушений (под влиянием БАВ, активированных при реакции антиген – антитело) и иммунного цитолиза при участии Т-киллеров. Следует отметить определенную взаимосвязь патологических процессов в печени: как правило, воспалительные (гепатиты) и обменно-дистрофические (гепатозы) поражения печени завершаются развитием цирроза. Для патологии печени характерна высокая частота сочетанных нарушений печени и органов пищеварительной системы, селезенки, почек, что обусловлено анатомическими и функциональными связями между этими органами. Так, секретируемая и экскретируемая печенью желчь участвует в переваривании и всасывании компонентов пищи в кишечнике, обеспечивает моторику кишок. В печени происходит промежуточный обмен продуктов гидролиза пищи, многие из которых депонируются в ней. Все это позволяет рассматривать печень и органы желудочно-кишечного тракта как единую гепатоэнтеральную систему, в которой заболевание одной из частей влечет за собой поражение другой. Общность крово- и лимфообращения, иннервации и ряда функций (кроветворение и кроворазрушение, барьерная функция, иммунопоэз, метаболизм, депонирование крови) связывает печень с селезенкой и приводит к частому совместному поражению этих органов (гепатолиенальный синдром). Функциональная общность печени и почек как экскреторных органов обусловливает компенсаторное включение одного из них при поражении другого. Возможность их сочетанного поражения связана и с тем, что печень участвует в обмене ряда гормонов и БАВ, регулирующих фильтрационную и реабсорбционную функцию почек (гепаторенальный синдром). Общей закономерностью для заболеваний и синдромов поражения печени является развитие печеночной недостаточности, которая характеризуется частичным или полным нарушением основных функций печени (см. ниже). Однако для патологии печени характерны не только патологические структурные и функциональные нарушения, но и компенсаторные реакции, направленные на ограничение и полную ликвидацию патологических изменений в органе. К таким компенсаторным реакциям относятся усиление метаболических процессов в печени (энергетических, дезинтоксикационных и др.), фагоцитоза, увеличение экскреции токсических веществ, перераспределение крови, развитие анастомозов. Кроме того, печень обладает выраженной способностью к регенерации, что проявляется как при резекции, так и диффузном поражении печеночной ткани (регенерационная гипертрофия печени). При этом происходит пролиферация гепатоцитов с полным или частичным восстановлением структуры печени. Печень активно включается в адаптивные реакции при заболеваниях других органов и систем. В то же время функциональная недостаточность печени при ее поражении может усугубить течение патологического процесса в других органах, изменить гормональную регуляцию, повлиять на эффективность лекарственной терапии. Печеночная недостаточность Печеночная недостаточность – состояние, при котором функциональная деятельность печени не обеспечивает гомеостаз. Классификация. Печеночная недостаточность может бытьабсолютной, если снижение функции печени обусловлено ее поражением, и относительной, когда она вызвана несоответствием функциональной активности печени повышенным потребностям организма в ее функции. В зависимости от основных патогенетических механизмов возникновения выделяют следующие разновидности печеночной недостаточности: 1. печеночно-клеточную (при дистрофических и некротических поражениях гепатоцитов); 2. экскреторную или холестатическую1 (в результате нарушения желчеобразовательной и желчевыделительной функции печени); 3. сосудистую (при нарушении кровообращения в печени). Однако, как правило, отмечается сочетание нескольких механизмов при развитии функциональной неполноценности печени. Так, холестаз сопровождается печеночно-клеточной и сосудистой формой печеночной недостаточности. По степени выключения функций печеночная недостаточность бывает тотальной (нарушены все функции печени) и парциальной (частичной). В дальнейшем будут рассмотрены проявления печеночной недостаточности в зависимости от нарушения основных функций печени. Экспериментальное моделирование. Печеночно- клеточная недостаточность моделируется хирургическим удалением печени (полным или частичным), токсическим повреждением печени гепатотропными ядами. Полное удаление печени производят в несколько этапов: 1. накладывают обратную фистулу Экка – Павлова (анастомоз между воротной и нижней полой венами и перевязка последней выше соустья – рис. 22.1,а,б) для того, чтобы переполнение печени кровью от всей нижней половины туловища привело к развитию мощных коллатералей, отводящих кровь, минуя печень, в верхнюю полую вену (через v. thoracicae internae); 2. через 4 – 6 нед перевязывают воротную вену выше анастомоза; 3. удаляют печень. 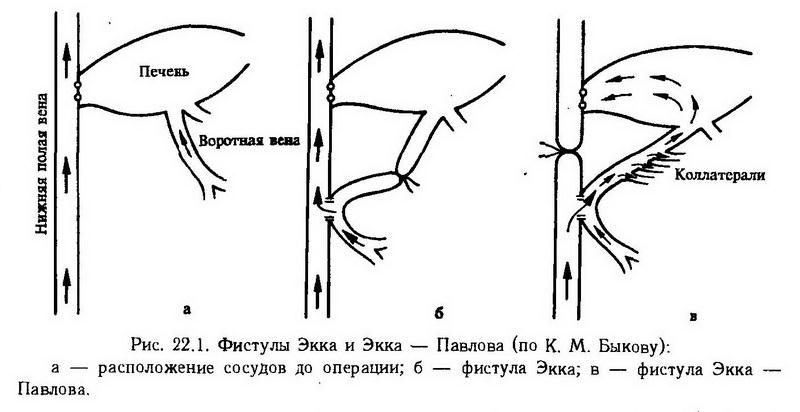 Через 3 – 8 ч после операции собаки погибают от гипогликемической комы. Введение глюкозы удлиняет им продолжительность жизни до 40 ч; смерть наступает при симптомах недостаточности кровообращения и дыхания. На основании обнаруженных при этом изменений биохимического состава крови было установлено участие печени в обмене веществ, свертывании крови и дезинтоксикационных процессах. Частичное удаление печени позволяет изучить особенности регенерации этого органа. Экстирпация даже 75 % массы печени не вызывает функциональной недостаточности ее, и в течение 4 – 8 нед она полностью восстанавливает свою массу за счет гиперплазии оставшихся частей. Токсическое повреждение печени достигается введением гепатотропных ядов (четыреххлористый углерод, хлороформ, фосфор, тринитротолуол), вызывающих центрилобулярный некроз печени. Экскреторная (холестатическая) форм а печеночной недостаточности моделируется перевязкой желчевыводящих протоков. Так, подпеченочная (механическая) желтуха, сопровождающаяся холестазом, воспроизводится путем перевязки общего желчного протока. Сосудистая форма печеночной недостаточности моделируется при нарушении печеночного кровообращения путем наложения фистулы Экка и Экка- Павлова (см. рис. 22.1, в), перевязки печеночной артерии, воротной и печеночной вен, одномоментной деваскуляризации печени. Прямая фистула Экка заключается в наложении соустья между воротной и нижней полой венами и перевязке воротной вены выше анастомоза (см. рис. 22.1, б). В результате этого прекращается поступление крови из сосудов пищевого канала в печень, кровоток в ней уменьшается в 2 раза, нарушаются метаболическая (особенно белковый обмен), обезвреживающая (в том числе образование мочевины из аммиака) и другие функции печени. Развитие печеночной комы у оперированных собак ускоряется при кормлении их мясом ("мясное отравление" по И. П. Павлову). Перевязка печеночной артерии может привести собак к гибели, так как вследствие ишемии печень вторично инфицируется анаэробной микрофлорой кишок и развивается массивный некроз ее. Введение антибиотиков предотвращает возникновение некроза. Через 10 дней после перевязки артериальные коллатерали становятся настолько мощными, что кровообращение в печени восстанавливается, приток кислорода становится достаточным, чтобы воспрепятствовать развитию инфекции. Перевязка воротной вены или печеночных вен, одномоментная деваскуляризация печени (перевязка всех афферентных сосудов) у собак вызывает резкое нарушение кровообращения, быстро приводящее животных к гибели. Для экспериментального моделирования портальной гипертензии – синдрома, сопровождающего сосудистую форму печеночной недостаточности, производят частичное сужение печеночных вен или же нижней полой вены выше впадения в нее печеночных вен, а также сужение воротной вены. Следствием этих сосудистых нарушений является повышение давления в системе воротной вены, развитие портокавальных анастомозов, асцита, гипоксического повреждения гепатоцитов и цирроза печени. В условиях хронического эксперимента для изучения функциональной недостаточности печени (метаболической, барьерной и др.) используется метод ангиостомии[Лондон Е. С, 1919]. При этом к стенкам воротной и печеночной вен подшиваются металлические канюли, свободный конец которых выводится наружу через переднюю стенку живота, и в хроническом опыте производится забор крови, притекающей к печени и оттекающей от нее. Кроме того, применяется метод перфузии изолированной печени и ряд клинических методов исследования: пункционная биопсия печени, радиоизотопное сканирование, биохимические и иммунологические методы. Нарушение метаболической функции печени Нарушение углеводного обмена при поражении печени заключается в приобретенных и наследственных изменениях: 1. распада и синтеза гликогена; 2. окисления глюкозы; 3. гликонеогенеза; 4. превращения галактозы и фруктозы в глюкозу; 5. образования глюкуроновой кислоты. Основным механизмом возникновения этих нарушений является понижение активности ферментов, катализирующих различные звенья углеводного обмена в результате уменьшения их синтеза при белковом голодании, дефиците энергии при гипоксии, повреждении митохондрий гепатоцитов, наследственных энзимопатиях, нарушении нейрогуморальной регуляции углеводного обмена. Нарушение углеводного обмена проявляется в развитиигепатогенной гипогликемии, наследственных заболеваниях – гликогенозов, галактоземии,фруктозурии (см. раздел XIV – "Типические нарушения обмена веществ"). Гипогликемия при поражении печени обусловлена уменьшением содержания гликогена в печени, снижением гликогенолиза (например, при гликогенозах Гирке и Герса) и гликонеогенеза (при болезни Аддисона, когда падает секреция гликокортикоидов). Снижение в патологически измененной печени содержания гликогена приводит к ослаблению ее обезвреживающей функции, в которой гликоген участвует, превращаясь в глюкуроновую кислоту. Нарушение жирового обмена при заболеваниях печени проявляется: 1. изменением расщепления и всасывания жиров пищи в кишечнике (в связи с дефицитом желчных кислот при патологии желчеобразования и желчевыделения); 2. нарушением синтеза и окисления триглицеридов, фосфолипидов, липопротеидов, холестерина; 3. увеличением образования кетоновых тел (см. раздел XIV – "Нарушения жирового обмена"). Расстройство жирового обмена в печени приводит к развитию жирового гепатоза (синонимы: жировая дистрофия, жировая инфильтрация печени), при котором в гепатоцитах накапливается жир и происходит диффузное или очаговое ожирение печени. Причинами возникновения жирового гепатоза являются алиментарные факторы (голодание, особенно белковое, недостаток в пище липотропных веществ – холина, метионина, избыток углеводов и жиров), токсические вещества (алкоголь, гепатотропные яды – инсектициды, тетрациклин в больших дозах), эндокринные и метаболические нарушения (сахарный диабет, ожирение), гипоксия (сердечная, дыхательная недостаточность). В патогенезе жировой дистрофии печени можно выделить следующие основные механизмы возникновения: 1. увеличение поступления жира в печень; 2. уменьшение синтеза фосфолипидов и повышение образования триглицеридов из жирных кислот; 3. снижение окисления жирных кислот и липолиза; 4. нарушение выхода жира из печени как следствие пониженного образования липопротеидов очень низкой плотности (ЛПОНП) (основной транспортной формы удаления триглицеридов из этого органа) или дефицита липокаина в поджелудочной железе. Патологические процессы в печени (гепатит, цирроз) нередко сопровождаются уменьшением образования эстерифицированного холестерина или снижением общего его количества в крови, нарушением синтеза и окисления холестерина, его превращения в желчные кислоты и выведения с желчью. Наблюдаемая при механической желтухе гиперхолестеринемия возникает не только в результате поступления холестерина в кровь в составе желчи, но и за счет синтеза его из желчных кислот. Длительная алиментарная гиперхолестеринемия связана с нарушением способности печени извлекать из крови холестерин и откладывать его в звездчатых эндотелиоцитах. Одним из наиболее тяжелых последствий повышенного кетоза в печени является развитие кетонемической комыпри сахарном диабете (см. раздел XIV – "Сахарный диабет"). Нарушение белкового обмена при патологии печени проявляется в изменении: 1. синтеза белков (в том числе белков плазмы крови); 2. расщепления белков – до аминокислот, пуриновых и пиримидиновых оснований; 3. дезаминирования, трансаминирования и декарбоксилирования аминокислот; 4. образования мочевины, мочевой кислоты, аммиака, глютамина (транспортной формы аммиака в крови), креатина – продуктов конечных этапов белкового обмена. Можно выделить следующие механизмы нарушения белкового обмена в печени: 1. повреждение при патологических процессах (гепатит, цирроз, опухоль, ишемия, гепатоз) печеночных клеток как структурного субстрата анаболизма и катаболизма белка; 2. нарушение генетической регуляции синтеза белка при повреждении структурных генов, рибосом цитоплазмы и гранулярного эндоплазматического ретикулума гепатоцитов, дефиците РНК, в результате чего изменяется количество продуцируемых белков, образуются аномальные по своей структуре белки (например, при амилоидозе печени, наследственной афибриногенемии); 3. дефицит аминокислот (при белковом голодании, нарушении переваривания и всасывания белков в кишечнике); 4. дефицит энергии (при гипо- и авитаминозах, особенно пиридоксина, рибофлавина и др., гипоксии); 5. нарушение нейрогуморальной регуляции белкового обмена (например, при инсулиновой недостаточности, изменении секреции соматотропина аденогипофизом). Следствием нарушения белкового обмена в печени является: 1. гипопротеинемия – уменьшение образования сывороточных альбуминов, ?- и ?-глобулинов (в норме в гепатоцитах синтезируется весь альбумин, 75 – 90 % ?-глобулинов и 50 % ?-глобулинов), что обусловливает снижение онкотического давления крови (гипоонкия)и развитие отека (" печеночный" отек); 2. геморрагический синдром при уменьшении в печени синтеза протромбина, фибриногена, проконвертина, проакцелерина и нарушении свертывания крови; 3. гипер-?-глобулинемия – повышенный синтез ?-глобулина в купферовских клетках печени (в норме в звездчатых эндотелиоцитах, относящихся к макрофагальной системе, образуется очень мало ?-глобулинов) и плазматических клетках (при плазматической инфильтрации печени), что наблюдается при аллергическом процессе в печени; 4. диспротеинемия – при синтезе в печени качественно измененных ?-глобулинов (парапротеинов – макроглобулинов, криоглобулинов); 5. повышение уровня свободных аминокислот в крови и моче (аминоацидемия, аминоацидурия), изменение качественного аминокислотного состава сыворотки крови при диффузных и особенно некротических поражениях печени, когда нарушается окислительное дезаминирование и трансаминирование аминокислот в печени; 6. увеличение остаточного азота в крови (азота мочевины, аминокислот) и аммиака при нарушении синтеза мочевины (показатель тяжелой печеночной недостаточности (как правило, при поражении 80 % и больше паренхимы печени); 7. повышение содержания в крови некоторых ферментов (?-глутамил-транспептидазы, аминотрансфераз и других), что связано с разрушением гепатоцитов при гепатите, циррозе, опухоли. |
