Навигация по странице:33. Какое из утверждений относительно пероксида водорода неверно35. На каком свойстве пероксид водорода основано использование его 3% раствора в медицинеЭлементы фтор, хлор, бром, йод и астат составляют группу галогенов. Какое из утверждений, относящееся к галогенам, не верное9. Что общего в лабораторных методах получения хлора, брома и йода13. Какой из перечисленных элементов может иметь в соединениях как отрицательную, так и положительную степень окисления22. Какой газ выделяется при взаимодействии бертолетовой соли с концентрированной соляной кислотой24. Какую массу оксида кремния (IV) можно растворить 500 мл раствора плавиковой кислоты с концентрацией фтороводорода 1,0 моль/л25. Какая реакция является качественной на обнаружение любого галогенид-иона, кроме фторид-иона6. Какие валентности проявляют: а) кислород, б) сера в своих соединениях
|
Общая характеристика неорганических соединений, их классификация и номенклатура
32. Какие два вещества вступили в реакцию если в результате образуется одно вещество гидроксид железа (III)?
[1] Fe и Н2О2;
[2] Fe2О3 и Н2О;
[3] Fe(ОН)2 и Н2О2;
[4] Fe и Н2О.
33. Какое из утверждений относительно пероксида водорода неверно?
[1] плотность Н2О2 меньше плотности Н2О;
[2] температура кипения Н2О2 выше соответствующей температуры Н2О;
[3] пероксид водорода каталитически разлагается при комнатной температуре;
[4] пероксид водорода смешивается с водой в любых отношениях.
34. 30% - ный раствор пероксида водорода в воде имеет техническое название…
[1] нашатырный спирт;
[2] пергидроль;
[3] формалин;
[4] олеум.
35. На каком свойстве пероксид водорода основано использование его 3% раствора в медицине?
[1] быстро образовывать полимерную пленку на коже ;
[2] быстро разлагаться при температуре -370С с образованием в первый момент атомарного водорода;
[3] на его способности понижать температуру организма;
[4] легко разлагаться под действием света 2Н2О2→ 2Н2О + О2↑.
36. При взаимодействии хлорида золота (III) с пероксидом водорода в щелочной среде образовалась 5,863 г золота. Какой газ при этом выделился и каков его объем при н.у.?
[1] 1,0 л О2;
[2] 2,0 л Сl2;
[3] 11,2 л Н2;
[4] 22,4 НСl.
37. Состав масляных красок входят свинцовые белила(белый пигмент PbCO3). Которые могут реагировать с сероводородом, содержащимся в загрязненной атмосфере. В результате образуется сульфид свинца черного цвета и живописное полотно чернеет. Для реставрации почерневших картин широко используется пероксид водорода, отбеливающий картину в результате реакции…
[1] PbS + 3Н2О2 = Pb(OH)2 + SO2↑+ 2Н2О2;
[2] PbS + 3Н2О2 = PbO¯ + SO2↑+ 3Н2О2;
[3] PbS + 4Н2О2 = PbSO4¯ + 4H2O;
[4] PbS + 3Н2О2 = PbSO3¯ + 3Н2О.
ГАЛОГЕНЫ
Элементы фтор, хлор, бром, йод и астат составляют группу галогенов. Какое из утверждений, относящееся к галогенам, не верное?
[1] все галогены обладают внешней электронной конфигурации ns2np5;
[2] для всех галогенов характерна степень окисления -1;
[3] астат радиоактивен, получен искусственно и в природе не встречается;
[4] йод – наиболее электроотрицательный элемент периодической системы.
2. Физические свойства галогенов существенно различаются. При обычных условиях а) фтор; б) хлор; в) бром; г) йод представляют собой…
[1] а) бурый газ; б) легкокипящую бесцветную жидкость; в) тяжелую жидкость зеленоватого цвета; г) ярко красные кристаллы;
[2] а) бледно желтый газ; б) легко сжимаемый газ желто-зеленого цвета; в) красно-коричневую густую жидкость с тяжелыми коричневыми парами; г) блестящие серовато-черные кристаллы;
[3] а) желтый газ; б) зеленоватый газ; в) бурый газ; г) фиолетовые кристаллы;
[4] а) бесцветный ядовитый газ; б) тяжелую жидкость коричневого цвета; в) бурые кристаллы; г)фиолетовые кристаллы.
3. Газ имеет плотность 3,485 г/л при давлении 1,2 атм. и температуре 250С. установите формулу газа.
[1] F2;
[2] НBr;
[3] HI;
[4] Cl2.
Все галогены, особенно фтор и хлор…
[1] окрашены в красивый бирюзовый цвет;
[2] легко горят на воздухе;
[3] токсичны;
[4] хорошие проводники электричества.
При нагревании йода до определенной температуре при атмосферном давлении он, не плавясь, превращается в пары. Как называется явление перехода твердого вещества непосредственно в газовое состояние?
[1] конденсация;
[2] сублимация;
[3] диссоциация;
[4] ассоциация.
6.Природный хлор представляет собой смесь изотопов 35Сl и 37Cl. На основании относительной атомной массы природного хлора, равной 35,5, рассчитайте изотопный состав хлора.
[1] 75% 35Сl; 25% 37Cl;
[2] 24,4% 35Сl; 75,8% 37Cl;
[3] 50% 35Сl; 50% 37Cl;
[4] приведенных данных недостаточно для решения задачи.
7. Одно из утверждений относительно распространенности галогенов в природе неверное:
[1] галогены не встречаются в природе в свободном виде;
[2] в морской воде все галогены существуют в виде ионов НаlО4-;
[3] в морской воде галогены существуют в виде галогенид-ионов; йод, кроме того, существует в форме ионов IO3-;
[4] фтор встречается в земной коре главным образом в виде плевого шпата СаF2.
8. Все галогены проявляют высокую…
[1] окислительную активность, которая уменьшается при переходе от фтора к йоду;
[2] восстановительную активность;
[3] реакционную активность, которая максимальна для йода и минимальная для фтора;
[4] каталитическую активность в реакциях с участием органических веществ..
9. Что общего в лабораторных методах получения хлора, брома и йода?
[1] каждый из галогенов может быть получен только электролизом расплавов их солей;
[2] каждый из галогенов может быть получен электролизом расплавов их солей;
[3] окисление галогенид-ионов до свободных галогенов производится с помощью более сильного химического окислителя;
[4] нет ничего общего.
10. Ввиду высокой реакционной активности фтора его получают исключительно…
[1] окислением фторид-ионов свободным хлором ;
[2] электролизом растворов фторидов;
[3] электролизом расплавов фторидов;
[4] электролизом кислородосодержащих солей фтора.
11. При электролизе раствора хлорида калия получают одновременно
[1] Н2,РCl и KH;
[2] H2, Cl2 и O2;
[3] K, HCl и Cl2;
[4] Cl2, H2 и KOH.
12. Бромная вода широко используется в органической химии; она легко реагирует с…
[1] алканами, этанолом, глюкозой;
[2] метиловым спиртом, метаном, уксусной кислотой;
[3] этиленом, фенолом, анилином;
[4] этаном, фенолформальдегидной смолой, изопреновым каучуком.
13. Какой из перечисленных элементов может иметь в соединениях как отрицательную, так и положительную степень окисления?
[1] бром;
[2] гелий;
[3] марганец;
[4] фтор.
14. Из перечисленных веществ самый сильный окислитель – это…
[1] водород;
[2] фтороводородная кислота;
[3] фтор;
[4] карбид.
В результате взаимодействия брома с указанными на схеме веществами
(а)

(Fe)

(     а) (Na2S2O3) (Br2) (KOH) (б) а) (Na2S2O3) (Br2) (KOH) (б)
водный
раствор
( НСООН) НСООН)
(в)
протекает следующие реакции:
[1] а) Fe + Br2 = FeBr2; б)Br2 + KOH = KBr + HOBr;
в) Br2 + HCOOH = HCOOBr + HBr;
г) Na2S2O3 + 2Br2 = Na2SO3 + SBr4;
[2] а) 2Fe + 3Br2 = 2FeBr3; б) Br2 + 2KOH = KBr + +KBrO + H2O;
в) Br2 + HCOOH = CO + HBr + HBrO;
г) Na2S2O3 + Br2 = Na2SO3 + ; 2SBr
[3] а) Fe + Br2 = FeBr2; б) Br2 + KOH = KOBr + HBr;
в) 2Br2 + HCOOH = CBr4 + Н2О2;
г) тиосульфат натрия не взаимодействует с бромом;
[4] Fe + 3Br2 = 2FeBr3; б) 3Br2 + 6KOH = 5KBr + KBrO3 + 3H2O;
в) Br2 + HCOOH = CO2↑ + 2HBr;
г)Na2S2O3 + 4Br2 + 5H2O = 2 NaBr + 2H2SO4 + +6HBr.
Растворы: а) хлороводорода,
б) фтороводорода в воде называют…
[1] а) хлорной кислотой; б) фураном;
[2] а) хлористой кислотой; б) фторной кислотой;
[3] а) соляной кислотой; б) плавиковой кислотой;
[4] а) олеумом; б) криолитом.
17.В ряду кислот HF – HCl – HBr – HI сила кислот…
[1] возрастает, так как увеличивается радиус атома галогена;
[2] убывает, так как уменьшается химическая активность галогена;
[3] изменяется скачкообразно;
[4] практически не изменяется.
18. Формула самой слабой кислоты -- это…
[1] HClO4;
[2] HBrO;
[3] HClO;
[4] HF.
19. Формула самой сильной кислоты – это …
[1] HClO4;
[2] HClO2;
[3] HNO3;
[4] H2SO4.
20. Оксид хлора (I) является ангидридом…
[1] хлорной кислоты;
[2] хлористой кислоты;
[3] хлорноватистой кислоты;
[4] хлорноватой кислоты.
21. Соли всех галогеноводородных кислот (галогениды) представляют собой…
[1] твердые кристаллические вещества;
[2] летучие жидкости;
[3] газообразные вещества;
[4] фториды—жидкости, хлориды и бромиды – твердые вещества, иодиды – газы .
22. Какой газ выделяется при взаимодействии бертолетовой соли с концентрированной соляной кислотой?
[1]Н2;
[2] Сl2O;
[3] O2;
[4] Сl2.
23. При прокаливании хлората калия в присутствии катализе тора (МnO2) образуются...
[1] хлорид калия и кислород;
[2] гипохлорит калия и хлор;
[3] хлорид и перхлорат калия;
[4] перхлорат калия и озон.
24. Какую массу оксида кремния (IV) можно растворить 500 мл раствора плавиковой кислоты с концентрацией фтороводорода 1,0 моль/л?
[l] 7,5 г SiО2;
[2] 15 г SiО2;
[3] 30 г SiО2;
[4] оксид кремния не реагирует с плавиковой кислотой.
25. Какая реакция является качественной на обнаружение любого галогенид-иона, кроме фторид-иона?
[1] Ва2+ + 2НаI
= BaHaI2;
[2] HaI- + O3 + Н2O = НаI2 + O2↑ + 2OН-;
[3] 4Н+ + 4НаI- + МnO2 = МnНаI2 + НаI2 +2Н2O;
[4] Ag+ + Hal- = AgHaI.
26. Структурная (графическая) формула хлорной извести —...
[1]
 O ---- Cl O ---- Cl
 Ca --------- Ca(OCl)2 Ca --------- Ca(OCl)2
O ---- Cl
[2]
 O ---- H O ---- H
 Ca --------- Ca(OH) Ca --------- Ca(OH)
O ---- H
[3]
 O ---- Cl O ---- Cl
 Ca --------- CaOCl2 Ca --------- CaOCl2
Cl
[4]
 Cl Cl
 Ca --------- CaCl2 Ca --------- CaCl2
Cl
  27. При пропускании хлора через раствор сильной кислоты А образуется простое вещество В и раствор приобретает темную окраску. При дальнейшем пропускании хлора в полученный раствор вещество В превращается в кислоту С, и раствор обесцвечивается. Веществами А, В и С могут, быть... 27. При пропускании хлора через раствор сильной кислоты А образуется простое вещество В и раствор приобретает темную окраску. При дальнейшем пропускании хлора в полученный раствор вещество В превращается в кислоту С, и раствор обесцвечивается. Веществами А, В и С могут, быть...
[1] А — HI, В — I2, С — НIO3;
[2] А — НВr, В — Вr2, С — НВrО;
[3] А — HF, В — F2, С — HFO;
[4] А — H2S, В — S, С — H2SO4.
28. Какие два вещества вступили в реакцию, если в результате образовались СаВr2 и НВr?
[1] оксид кальция и бромная кислота;
[2] гидроксид кальция и бромистая кислота;
[3] гидрид кальция и бром;
[4] водород и хлорная известь.
29. К подкисленному раствору, содержащему 0,543 г некоторой соли, в состав которой входят литий, хлор и кислород, добавили раствор иодида натрия до прекращения выделения йода. Масса образовавшегося йода равна 4,57 г. Установите формулу соли.
[l] LiClO;
[2] LiClO2;
[3] LiClO3;
[4] LiClO4.
30. Приведите одно из уравнений реакций, лежащее в основе черно-белой фотографии.
[1] AgNO3 + KI - AgI + KNO3;
[2] 2Н2O2 �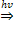 � 2Н2O + O2↑; � 2Н2O + O2↑;
[3] С6Н6 + 3С12 �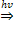 � С6Н6С16; � С6Н6С16;
[4] 2AgBr �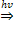 � 2Ag+ Br2. � 2Ag+ Br2.
31. О химических свойствах радиоактивного астата известно очень немногое. Напишите уравнение возможной реакции между астатидом калия и концентрированной серной кислотой.
[1] KAt + H2S04 = KHS04 + HAt↑;
[2] 2KAt + 2H2S04 = K2S04 + At2 + S02↑ + H20;
[3] 2KAt + 2H2S04 = K2S04 + AtS04 + 2H2↑;
[4] астатид калия не может реагировать с серной кислотой, поскольку это — радиоактивное соединение.
32. Галогенопроизводные многих органических соединений широко используются в промышленности и в быту, например: а) тефлон, б) хлороформ. Напишите формулы этих веществ.
[1] a) CFCl3; б) СН3Сl;
[2] а) (-СН2-СС1=СН-СН2-)n; б) СН2С12;
[3] а) С6Н6С16; б) (-СС12-СС12-)n;
[4] a) (-CF2-CF2-)n; б) СНС13.
33. Фреоны — это...
[1] анестезирующие препараты на основе хлороформа;
[2] техническое название хлорфторуглеродов, используемых в качестве хладоагентов;
[3] вещества, образующиеся в результате прокаливания гипохлорита бария;
[4] галогенированные углеводороды, широко используемые в качестве пестицидов
ХАЛЬКОГЕНЫ
1. К халькогенам относят элементы...
[1] главной подгруппы шестой группы Периодической системы;
[2] побочной подгруппы шестой группы;
[3] главной подгруппы седьмой группы;
[4] благородных газов.
2. Назовите элемент, на долю которого приходится около половины всей массы земной коры и около 90% массы Мирового океана:
[1] кремний;
[2] водород;
[3] железо;
[4] кислород.
3. Физические свойства простых веществ, образуемы кислородом и серой, существенно различаются. Так, при обычных условиях: а) кислород, б) сера существуют в виде...
[1] а) газа с голубым оттенком; б) бурого газа (называемого иногда «лисьим хвостом»);
[2] а) бесцветного газа с характерным запахом «послегрозовой свежести»; б) густой жидкости красно-коричневого цвета;
[3] а) газа без цвета и запаха; б) твердого вещества желтого цвета;
[4] а) газа с зеленоватым оттенком; б) газа с запахом тухлых яиц.
4. Кислород и сера — ...
[1] хорошие проводники электричества;
[2] имеют аллотропные модификации;
[3] хорошо растворимы в воде;
[4] типичные восстановители.
5. Сера имеет три аллотропные модификации, называемые...
[1] карбин, сера кубическая, озон;
[2] карбен, сера кристаллическая, кремнезем;
[3] сера кристаллическая, сера гидратная, сера гомо- генная;
[4] сера аморфная, сера ромбическая, сера моноклинная.
6. Какие валентности проявляют: а) кислород, б) сера в своих соединениях?
[1] а) I, II и IV; б) I, II, IV и V;
[2] а) II и III ; б) II и VII;
[3] а) II и III; б) II, IV и VI;
[4] а) II, IV и VI; б) только IV.
7. Объемная доля кислорода в воздухе составляет...
[1]21%;
[2] 78%;
[3] 50%;
[4] воздух практически полностью состоит из кислорода.
8. Какое из перечисленных веществ позволяет выделить максимальное количество кислорода при прокаливании равных количеств каждого из них: KMnO4, KNO3, KClO3, HgO?
[1]КСlO3;
[2] КМnO4;
[3] KNO3;
[4] при прокаливании равных количеств перечисленных в условии веществ выделяются равные количества кислорода.
|
|
|
 Скачать 367.5 Kb.
Скачать 367.5 Kb.