Сборник всех лекций. Общая характеристика обмена веществ и энергии. Биоэнергетика
 Скачать 3.68 Mb. Скачать 3.68 Mb.
|
|
Транскрипция Транскрипция - первая стадия реализации генетической информации в клетке. В ходе процесса образуются молекулы м-РНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адапторные и каталитические функции. Транскрипция у эукариотов происходит в ядре. В основе механизма транскрипции лежит тот же структурный принцип комплементарного спаривания оснований в молекуле РНК (G ≡ C, A=U и Т=А). ДНК служит только матрицей и в ходе транскрипции не изменяется. Рибонуклеозидтрифосфаты (ЦТФ, ГТФ, АТФ, УТФ) - субстраты и источники энергии, необходимые для протекания полимеразной реакции, образования 3',5'-фосфодиэфирной связи между рибонуклеозидмонофосфатами. Синтез молекул РНК начинается в определённых последовательностях (сайтах) ДНК, которые называют промоторы, и завершается в терминирующих участках (сайты терминации). Участок ДНК, ограниченный промотором и сайтом терминации, представляет собой единицу транскрипции - транскриптон. У эукариотов в состав транскриптона, как правило, входит один ген. В каждом транскриптоне присутствует неинформативная зона; она содержит специфические последовательности нуклеотидов, с которыми взаимодействуют регуляторные транскрипционные факторы. 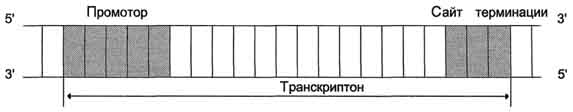 Строение транскриптона Транскрипционые факторы - белки, взаимодействующие с определёнными регуляторными сайтами и ускоряющие или замедляющие процесс транскрипции. Соотношение информативной и неинформативной частей в транскриптонах эукариотов составляет в среднем 1:9 (у прокариотов 9:1). Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК. Разделение ДНК на множество транскриптонов позволяет осуществлять с разной активностью индивидуальное считывание (транскрипцию) разных генов. В каждом транскриптоне транскрибируется только одна из двух цепей ДНК, которая называется матричной, вторая, комплементарная ей цепь, называется кодирующей. Синтез цепи РНК идёт от 5'- к З'-концу, при этом матричная цепь ДНК всегда антипараллельна синтезируемой нуклеиновой кислоте. Транскрипция не связана с фазами клеточного цикла; она может ускоряться и замедляться в зависимости от потребности клетки или организма в определённом белке. Биосинтез РНК осуществляется ДНК-зависимыми РНК-полимеразами. Стадии транскрипции В процессе транскрипции различают 3 стадии: инициацию, элонгацию и терминацию. Инициация Активация промотора происходит с помощью белка - ТАТА-фактора, называемого так потому, что он взаимодействует со специфической последовательностью нуклеотидов промотора. Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т.е. образуется транскрипционная вилка. Элонгация Факторы элонгации повышают активность РНК-полимеразы и облегчают расхождение цепей ДНК. Синтез молекулы РНК идёт от 5'- к З'-концу комплементарно матричной цепи ДНК. 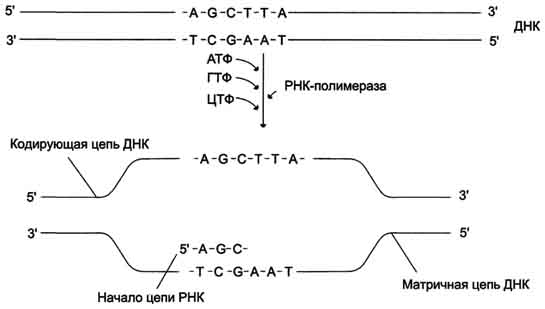 Транскрипция РНК на матричный цепи ДНК По мере продвижения РНК-полимеразы по матрице в направлении от 3'- к 5'-концу впереди неё происходит расхождение, а позади - восстановление двойной спирали ДНК. Терминация Раскручивание двойной спирали ДНК в области сайта терминации делает его доступным для фактора терминации. Завершается синтез РНК в строго определенных участках матрицы - терминаторах (сайты терминации). В результате транскрипции получается РНК, еще не готовая к выполнению функций и содержащая лишние последовательности. Процессингом называют совокупность ферментативных процессов, в результате которых синтезируемая в процессе транскрипции РНК превращается в функционально полноценную молекулу. После процессинга и-РНК в виде нуклеопротеинового комплекса покидает ядро через поры в ядерной мембране и поступает в цитоплазму для трансляции. Все рибосомные и транспортные РНК также синтезируются на матрице ДНК. Биосинтез белков (трансляция) Перевод информации, заключённой в полинуклеотидной последовательности мРНК, в аминокислотную последовательность белка требует определённого способа кодирования или шифрования, т.е. существования определённого закона, по которому чередование четырёх нуклеотидов в м-РНК задаёт специфическую последовательность аминокислот в белке. Генетический код и его свойства Необходимость кодирования структуры белков в линейной последовательности нуклеотидов мРНК и ДНК продиктована тем, что в ходе трансляции: нет соответствия между числом мономеров в матрице мРНК и продукте - синтезируемом белке; отсутствует структурное сходство между мономерами РНК и белка. Это исключает комплементарное взаимодействие между матрицей и продуктом - принцип, по которому осуществляется построение новых молекул ДНК и РНК в ходе репликации и транскрипции. Отсюда становится ясным, что должен существовать "код", позволяющий выяснить, какая последовательность нуклеотидов м-РНК обеспечивает включение в белок аминокислот в заданной последовательности. Этот "код" получил название генетического, биологического, нуклеотидного, или аминокислотного кода. Он позволяет шифровать аминокислоты, входящие в состав белков, с помощью определённой последовательности нуклеотидов в ДНК и м-РНК. Свойства генетического кода Триплетность. Одним из основных вопросов при выяснении свойств кода был вопрос о числе нуклеотидов, которое должно определять включение в белок одной аминокислоты. Сразу было понятно, что это число не может быть равным 1 или 2, так как в этом случае количество кодирующих элементов будет недостаточным для шифрования 20 аминокислот в белках. Число кодирующих последовательностей из четырёх нуклеотидов по три равно 43 = 64, что более чем в 3 раза превышает минимальное количество, которое необходимо для кодирования 20 аминокислот. В дальнейшем было установлено, что кодирующими элементами в шифровании аминокислотной последовательности действительно являются тройки нуклеотидов, или триплеты, которые получили название "кодоны". Смысл кодонов Смысл кодонов стал понятен в 60-х г. XX столетия, когда, используя бесклеточную систему синтеза белков (табл. 4-3) и синтетические полирибонуклеотиды с заданной последовательностью нуклеотидов в качестве матрицы, М. Ниренберг и Г. Маттеи синтезировали полипептиды определённого строения. Так, на матрице поли-У, состоящей только из остатков УМФ, был получен полифенилаланин, а на матрице поли-Ц - полипролин. Из этого следовало, что триплет -UUU кодирует Фен, а триплет -ССС - Про. В последующих экспериментах использовали смешанные синтетические полирибонуклеотиды с известным составом. В результате этой работы удалось установить, что из 64 кодонов включение аминокислот в синтезирующуюся полипептидную цепь шифрует 61 триплет, а 3 остальных - UAA, UAG, UGA не кодируют включение в белок аминокислот и первоначально были названы бессмысленными, или нонсенс-кодонами. Однако в дальнейшем было показано, что эти триплеты сигнализируют о завершении трансляции, и поэтому их стали называть терминирующими, или стоп-кодонами. Кодоны мРНК и триплеты нуклеотидов в кодирующей нити ДНК с направлением от 5' к 3'-концу имеют одинаковую последовательность азотистых оснований, за исключением того, что в ДНК вместо урацила (U), характерного для мРНК, стоит тимин (Т). Специфичность Каждому кодону соответствует только одна определённая аминокислота. В этом смысле генетический код строго однозначен. Вырожденность В мРНК и ДНК имеет смысл 61 триплет, каждый из которых кодирует включение в белок одной из 20 аминокислот. Из этого следует, что в информационных молекулах включение в белок одной и той же аминокислоты определяют несколько кодонов. Это свойство биологического кода получило название вырожденности. У человека одним кодоном зашифрованы только 2 аминокислоты - Мет и Три, тогда как Лей, Сер - шестью кодонами, а Ала, Вал, Гли, Про, Тре - четырьмя кодонами. Избыточность кодирующих последовательностей - ценнейшее свойство кода, так как она повышает устойчивость информационного потока к неблагоприятным воздействиям внешней и внутренней среды. При определении природы аминокислоты, которая должна быть включена в белок, третий нуклеотид в кодоне не имеет столь важного значения, как первые два. Для многих аминокислот замена нуклеотида в третьей позиции кодона не сказывается на его смысле. Линейность записи информации В ходе трансляции кодоны мРНК "читаются" с фиксированной стартовой точки последовательно и не перекрываются. В записи информации отсутствуют сигналы, указывающие на конец одного кодона и начало следующего. Кодон AUG является инициирующим и прочитывается как в начале, так и в других участках мРНК как Мет. Следующие за ним триплеты читаются последовательно без каких-либо пропусков вплоть до стоп-кодона, на котором синтез полипептидной цепи завершается. Универсальность До недавнего времени считалось, что код абсолютно универсален, т.е. смысл кодовых слов одинаков для всех изученных организмов: вирусов, бактерий, растений, земноводных, млекопитающих, включая человека. Однако позднее стало известно одно исключение, оказалось, что митохондриальная мРНК содержит 4 триплета, имеющих другое значение, чем в мРНК ядерного происхождения. Генетический код
Примечания: U - урацил; С - цитозин; А - аденин; G - гуанин; * - терминирующий кодон. Узнавание кодона осуществляет не сама аминокислота, а молекула т-РНК, которая содержит последовательность нуклеотидов, комплементарную кодону - антикодон. т-РНК служит адаптором, обеспечивающим соответствие между кодоном и кодируемой им аминокислотой. Наличие адаптора отличает трансляцию от транскрипции и репликации. Адапторная теория синтеза белка была сформулирована Ф.Криком в 1958 г. Для синтеза полипептидной цепи необходимо большое количество компонентов, совместное и согласованное взаимодействие которых приводит к образованию белка. Основные компоненты белоксинтезирующей системы
Аминокислоты Все 20 аминокислот, входящих в структуру белков организма человека, должны присутствовать в достаточном количестве. Это требование прежде всего относится к незаменимым (т.е. не синтезирующимся в организме) аминокислотам, так как недостаточное снабжение клетки хотя бы одной незаменимой аминокислотой приводит к снижению, а иногда и полной остановке синтеза белка на кодоне, требующем включения этой аминокислоты в белок. м-РНК. Содержит информацию о структуре синтезируемого белка и используется в качестве матрицы. т-РНК. У человека около 50 различных тРНК обеспечивают включение аминокислот в белок. Т-РНК называют "адапторные молекулы", так как к акцепторному концу этих молекул может быть присоединена определённая аминокислота, а с помощью антикодона они узнают специфический кодон на м-РНК. В процессе синтеза белка на рибосоме связывание антикодонов т-РНК с кодонами м-РНК происходит по принципу комплементарности и антипараллельности. Однако оказалось, что число т-РНК для каждой аминокислоты не совпадает с числом кодирующих её кодонов в мРНК, и, следовательно, некоторые тРНК способны связываться больше чем с одним кодоном. Исследование этого вопроса позволило установить следующее: первые два основания кодона и последние два основания антикодона образуют обычные прочные пары (и вносят наибольший вклад в специфичность декодирования; связывание третьего основания кодона с первым основанием антикодона происходит слабее, чем с первыми двумя, и это позволяет некоторым т-РНК прочитывать больше чем один кодон. Гипотеза, объясняющая характер кодон-антикодонового взаимодействия, получила название "гипотезы качания" (т.е. третье основание большинства кодонов имеет определённую степень свободы при образовании пары с соответствующим антикодоном и как бы "качается"). Аминоацил-тРНК синтетазы (аминоацил-тРНК лигазы) В цитозоле клеток 20 различных аминокислот присоединяются α-карбоксильной группой к 3'-гидроксильному акцепторному концу соответствующих т-РНК с образованием сложноэфирной связи. Эти реакции катализирует семейство ферментов, носящее название аминоацил-тРНК синтетаз (аа-т-РНК-синтетаз). Каждый член этого семейства узнаёт только одну определённую аминокислоту и те т-РНК, которые способны связываться с этой аминокислотой. Из этого следует, что в группу тРНК- синтетаз входит 20 различных ферментов. Суммарную реакцию, катализируемую аминоацил-тРНК синтетазами в присутствии ионов Mg2+, можно представить следующим образом: Аминокислота +тРНК + АТФ -" аминоацил - тРНК + АМФ + PPi. Для каждой аминокислоты существует свой фермент - своя аминоацил т-РНК синтетаза: для глутамата - глутамил-тРНК синтетаза, гистидина - гистидил-тРНК синтетаза и т.д. Энергия, заключённая в макроэргической сложноэфирной связи аминоацил-тРНК, впоследствии используется на образование пептидной связи в ходе синтеза белка. Пирофосфат, выделяющийся в ходе этой реакции, гидролитически расщепляется с образованием двух молекул ортофосфата и выделением энергии, что делает реакцию активации аминокислот необратимой. Чрезвычайно высокая специфичность аа-тРНК синтетаз в связывании аминокислоты с соответствующими тРНК лежит в основе точности трансляции генетической информации. Участие в синтезе белка зависит только от структуры тРНК, а точнее, от комплементарного взаимодействия антикодона аминоацил-тРНК с кодоном мРНК. Рибосомы Рибосомы представляют собой рибонуклео-протеиновые образования - своеобразные "фабрики", на которых идёт сборка аминокислот в белки. Белковые факторы В каждой стадии белкового синтеза на рибосоме: инициации, элонгации и терминации участвует разный набор внерибосомных белковых факторов. Эти белки связываются с рибосомой или её субъединицами на определённых стадиях процесса и стабилизируют или облегчают функционирование белоксинтезирующей машины. АТФ и ГТФ как источники энергии На включение одной аминокислоты в растущую полипептидную цепь клетка затрачивает макроэргические связи АТФ и ГТФ. Синтез полипептидной цепи на рибосоме В ходе синтеза белка прочтение информации м-РНК идёт в направлении от 5'- к З'-концу, обеспечивая синтез пептида от N- к С-концу. События на рибосоме включают этапы: инициации, элонгации и терминации. Инициация трансляции представляет собой событие, в ходе которого происходит образование инициирующего комплекса. В клетках эукариот первой инициирующей аминокислотой, соединённой с тРНК, является метионин. 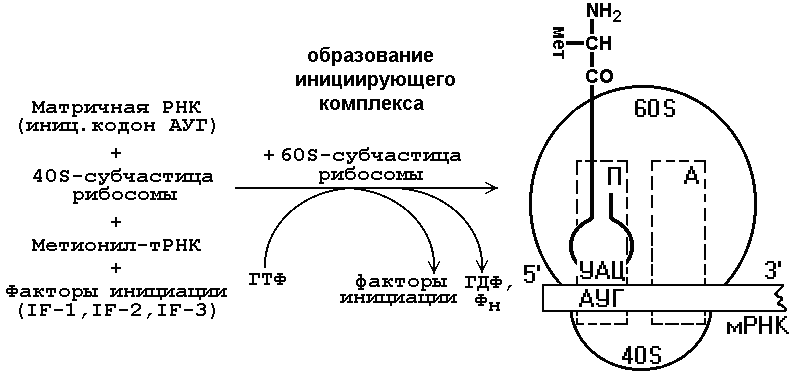 Далее начинается самый продолжительный этап белкового синтеза - элонгация, в ходе которого рибосома с помощью аа-тРНК последовательно "читает" м-РНК в виде триплетов нуклеотидов, следующих за инициирующим кодоном в направлении от 5' к 3'-концу, наращивая полипептидную цепочку за счёт последовательного присоединения аминокислот: 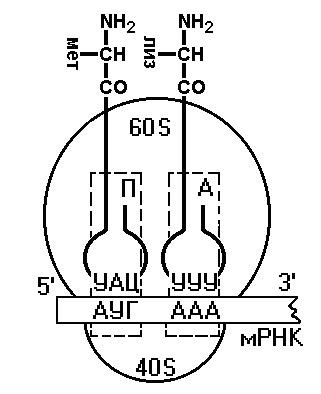 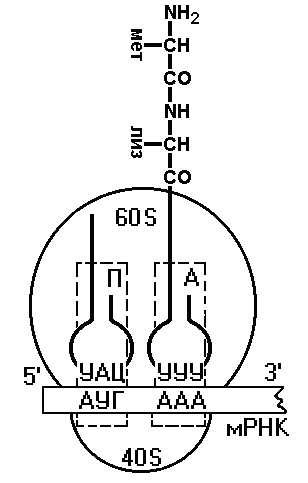 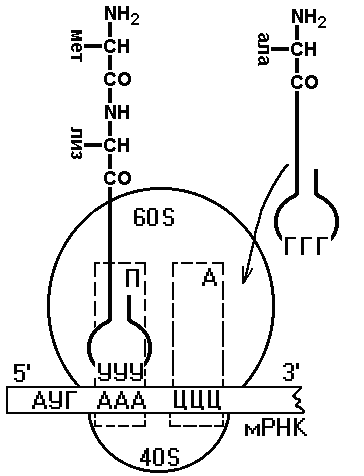 1: присоединение к инициирующему комплексу аминоацил-т-РНК, соответствующей кодону.2: транспептидация – образование пептидной связи между остатками аминокислот. перемещение рибосомы относительно м-РНК на 1 триплет. Терминация трансляции наступает в том случае, когда поступает один из стоп-кодонов: UAG, UAA или UGA. Для стоп-кодонов нет соответствующих т-РНК. Таким образом, матричная природа процесса трансляции проявляется в том, что последовательность поступления аминоацил-тРНК в рибосому для синтеза белка строго детерминирована м-РНК, т.е. порядок расположения кодонов вдоль цепи мРНК однозначно задаёт структуру синтезируемого белка. Рибосома сканирует цепь мРНК в виде триплетов и последовательно отбирает из окружающей среды "нужные" аа-тРНК, освобождая в ходе элонгации деацилированные т-РНК. Как правило, много рибосом одновременно участвует в синтезе белка на одной и той же мРНК, образуя комплекс, который называют полирибосомой, или полисомой. Чем длиннее полипептидная цепочка синтезируемого белка, тем больше рибосом может одновременно осуществлять синтез этого белка, значительно увеличивая таким образом эффективность использования матрицы. Посттрансляционные модификации полипептидной цепи Полипептидные цепи могут подвергаться структурным модификациям, либо будучи ещё связанными с рибосомами, либо после завершения синтеза. Эти конформационные и структурные изменения полипептидных цепей получили название посттрансляционных изменений. Они включают удаление части полипептидной цепи, ковалентное присоединение одного или нескольких низкомолекулярных лигандов, приобретение белком нативной конформации. Происходят фоддинг полипептидных цепей и формирование уникальной третичной или четвертичной структуры белков. Причём для поддержания нативной конформации молекул огромное значение имеет правильное формирование дисульфидных связей. Частичный протеолиз. Многие белки, секретируемые из клеток, первоначально синтезируются в виде молекул-предшественников, функционально неактивных. Удаление части полипептидной цепи специфическими эндопротеазами приводит к образованию активных молекул. Наглядным примером последовательного двухстадийного протеолиза служит образование активных форм пептидных гормонов (например, инсулина или глюкагона) из препрогормонов. Ковалентные модификации. Структурные белки и ферменты могут активироваться или инактивироваться в результате присоединения различных химических групп: фосфатных, ацильных, метальных, олигосахаридных и некоторых других. Например, фосфорилирование, гликозилирование белков (присоединение углеводного фрагмента). Многочисленным модификациям подвергаются боковые радикалы некоторых аминокислот. Механизмы генетической изменчивости. Наследственные болезни Регуляция экспрессии генов Организмы адаптируются к меняющимся условиям окружающей среды путём изменения экспрессии (скорости транскрипции) генов. Этот процесс включает взаимодействие специфических белков с участками ДНК в непосредственной близости от стартового участка транскрипции. При этом может происходить включение или выключение транскрипции. В регуляции реализуются и некоторые другие более сложные механизмы. Изменение количества генов.Геном эукариотов обнаруживает высокую пластичность, играющую важную роль в регуляции активности некоторых генов и увеличивающую разнообразие клеточных ответов. У млекопитающих реализуются следующие варианты изменений в структуре генов: Амплификация (или увеличение числа) генов используется организмом в том случае, когда возникает необходимость увеличить синтез определённого генного продукта. Утрата генетического материала - довольно редкий способ регуляции. Утрата генетического материала происходит в процессе созревания лимфоцитов и образования плазматических клеток разных клонов, синтезирующих секретируемые формы иммуноглобулинов. Перестройка генов. У высших организмов, так же как и у прокариотов, отмечают процесс обмена, перемещения генов между хромосомами или внутри хромосомы, объединение генов с образованием изменённой хромосомы, которая после таких структурных изменений способна к репликации и транскрипции. Этот процесс получил название "генетическая рекомбинация". Точная работа всех матричных биосинтезов - репликации, транскрипции и трансляции - обеспечивает копирование генома и воспроизведение фенотипических характеристик организма в поколениях, т.е. наследственности. Однако биологическая эволюция и естественный отбор возможны только при наличии генетической изменчивости. Установлено, что геном постоянно претерпевает разнообразные изменения. Несмотря на эффективность механизмов коррекции и репарации ДНК, часть повреждений или ошибок в ДНК остаётся. Изменения в последовательности пуриновых или пиримидиновых оснований в гене, не исправленные ферментами репарации, получили название "мутации". Одни из них остаются в соматических клетках, в которых они возникли, а другие обнаруживаются в половых клетках, передаются по наследству и могут проявляться в фенотипе потомства как наследственная болезнь. Существенный вклад в генетическую изменчивость вносят перестройки хромосом в процессе мейоза. Как уже указывалось ранее, слияние яйцеклетки со сперматозоидом у эукариотов сопровождается генетическими рекомбинациями, в ходе которых происходит обмен участками ДНК между гомологичными хромосомами. Это приводит к появлению потомства с новой комбинацией генов. Ген или части генов могут перемещаться из одного места хромосомы в другие. Эти подвижные элементы или фрагменты ДНК получили название транспозонов и ретротранспозонов. Транспозоны - участки ДНК, удаляемые из одного локуса хромосомы и встраиваемые в другой локус той же или другой хромосомы. Ретротранспозоны не покидают исходного положения в молекуле ДНК, но могут копироваться, и копии встраиваются, подобно транспозо-нам, в новый участок. Включаясь в гены или участки около генов, они могут вызывать мутации и изменять их экспрессию. Геном эукариотов подвергается изменениям и при заражении ДНК- или РНК-содержащими вирусами, которые внедряют свой генетический материал в ДНК клеток хозяина. Мутагенез Изменения в геноме могут быть разнообразны и затрагивать различные по протяжённости участки ДНК от хромосом и генов до отдельных нуклеотидов. Наиболее драматичны геномные и хромосомные мутации, часто наблюдаемые на уровне соматических клеток. Если они имеют место в половых клетках, то для организма это имеет чаще всего летальные последствия. Частота мутаций в половых клетках высока. Существуют данные, указывающие на то, что в 20% случаев при беременности у эмбрионов наблюдают нарушения структуры хромосом. В 90% случаев это приводит к ненормальному развитию плода и элиминированию зародышей в результате спонтанных абортов. Выкидыши, происходящие в течение первых нескольких недель беременности, связаны с серьёзными нарушениями хромосом. В 50% случаев отмечается трисомия по аутосомам, т.е. вместо пары хромосом наблюдаются три. Пример такой патологии - болезнь Дауна, при которой хромосома 21 присутствует в 3 экземплярах. Некоторые генные мутации закрепляются в популяции, становятся наследственными и определяют эволюционные процессы. С мутациями такого типа связано появление различных наследственных патологий, сопровождающихся прекращением синтеза белка, кодируемого повреждённым геном, либо синтезом изменённого белка. Генные, или точечные, мутации бывают в основном 3 видов: замены, при которых одно азотистое основание в ДНК замещается на другое; вставки, обеспечивающие внедрение в молекулу ДНК одного или нескольких дополнительных нуклеотидов; делеции (или выпадения) одного или нескольких нуклеотидов, при которых происходит укорочение молекулы ДНК. Мутации по типу заменывозникают в результате замены одного азотистого основания на другое, что вызывает изменение в одном из кодонов мутантного гена. Если кодирующий триплет, в котором находится изменённый нуклеотид, из-за вырожденности кода вызывает включение в белок той же аминокислоты, что исходный кодон (или кодон "дикого" типа), то такую мутацию называют "молчащей", и белковый продукт остаётся тем же. Когда замена одного основания приводит к замене аминокислоты в мутантом белке, то такую мутацию называют "миссенс-мутация". В ряде случаев, несмотря на произошедшую замену, белок сохраняет биологическую активность. Это, как правило, связано с тем, что изменённая аминокислота находится в участке белка, не имеющем функционального значения, и к тому же она по структуре и свойствам напоминает исходную аминокислоту. Такая мутация тоже будет "молчащей", а замена - эквивалентной. Иногда аминокислота, оказавшаяся заменённой, располагается в области, важной для проявления функциональной активности белка, и её замещение приводит к образованию функционально неактивного продукта. Так, точечная мутация в кодоне серина (Сер - важнейший структурный компонент активного центра сериновых протеаз: трипсина, химотрипсина и некоторых других ферментов) приводит к полной потере активности. Если подобный фермент участвует в реакциях главных метаболических путей, то такая "неэквивалентная" замена может стать летальной. В ряде случаев мутантный белок, несмотря на входящую в него изменённую аминокислоту, сохраняет способность вьшолнять свою функцию, но может быть не столь эффективным, как белок "дикого" типа. В результате мутации у фермента может оказаться более высоким значение Кm или более низким значение Vmax, а иногда то и другое одновременно. Такие частично функционирующие белки называют мутантными белками с неполностью подавленной функцией. Изредка в результате мутации белковый продукт гена оказывается лучше приспособленным к выполнению своей функции. Такие мутации дают потомству преимущества в борьбе за существование, а серия соответствующих мутаций может привести к появлению нового вида. Наибольшим повреждающим действием обладают мутации, приводящие к образованию одного из терминирующих кодонов (нонсенс-мутация). В процессе синтеза белка работа рибосомы будет остановлена на мутантном триплете мРНК: UAA, UAG или UGA. Проявление нонсенс-мутаций зависит от их внутригенной локализации. Чем ближе мутация к 5'-концу гена, т.е. к началу транскрипции, тем короче её белковый продукт, а следовательно, тем меньше он способен к осуществлению биологической функции. Мутации по типу вставки или делеции нуклеотидов Более многочисленны и опасны для клеток мутации по типу вставки или делеции (утраты) нуклеотидов. Нарушения в прочтении информации начинаются с участка, в котором произошла мутация, так как именно в этом месте происходит сдвиг "рамки считывания" информации. Белковый продукт за точкой мутации будет иметь случайную последовательность аминокислот. Мутации со сдвигом рамки считывания часто приводят к появлению внутреннего терминирующего кодона, вызывающего преждевременное прекращение синтеза полипептидной цепи и образование укороченного продукта, лишённого биологической активности. Основные виды генных мутаций
Частота мутаций Считается, что средняя частота возникновения мутаций в структурных локусах (областях локализации гена в хромосоме или в молекуле ДНК) человека колеблется в пределах от 10-5 до 10-6 на одну гамету за каждое поколение. Однако эта величина может значительно варьировать для разных генов (от 10-4 для генов с высокой скоростью мутаций до 10-11 для наиболее устойчивых участков генома). Столь существенные колебания в частоте возникновения мутаций обусловлены характером мутационного повреждения, механизмом возникновения мутации, протяжённостью кодирующей области мутантного гена, функциями белка, закодированного в этом гене. Геном за одно поколение может получить от 7 до 15 мутаций, т.е. это значит, что каждая гамета содержит такое количество изменений в ДНК по сравнению с родительской ДНК. А поскольку у каждого индивидуума клетки диплоидны и получаются при слиянии 2 гамет, то мутаций тоже в 2 раза больше. Каким же образом человечество справляется с такой мутационной нагрузкой? Следует помнить, что кодирующие части генов, изменения в которых наиболее опасны, занимают не более 10% генома. Ситуация облегчается ещё и тем, что далеко не каждая мутация в кодирующей области имеет фенотипическое проявление. Многие попадают в 3'-положение кодонов и, таким образом, являются "молчащими", так как благодаря вырожденности генетического кода они не приводят к аминокислотным заменам, другие оказываются в доменах, несущественных для функционирования белков. Потомству передаются мутации, происходящие в гаметах, а их процент совсем невелик. Наследственные болезни Наследственные болезни - следствие мутаций, произошедших в гаметах или зиготе. Такие мутации могут быть первичными, если возникли в гаметах или в процессе формирования зиготы, или вторичными, если мутантный ген возник раньше и был передан последующему поколению по наследству. Первичные мутации, как правило, не сопровождаются возникновением болезни, так как происходят обычно в одной из хромосом, и индивидуум, получивший такую мутацию, становится гетерозиготным носителем повреждения в гене. Мутантный ген в гетерозиготном состоянии часто не проявляется как болезнь и существенно не снижает жизнеспособность организма. Это способствует его распространению в популяции. При вторичных мутациях, если каждый из родителей является носителем мутантного гена, будучи гетерозиготой, возможно рождение детей-гомозигот по дефектному аллелю. В таком случае развивается наследственная болезнь, часто сопровождаемая очень тяжёлым течением. Согласно данным Всемирной организации здравоохранения, около 2,4% всех новорождённых на земном шаре страдают теми или иными наследственными нарушениями. Около 40% ранней младенческой смертности и инвалидности с детства обусловлены наследственной патологией. К настоящему времени на хромосомах человека выявлено около 800 генов, мутации в которых приводят к развитию различных наследственных болезней. Хорошо изученными наследственными заболеваниями, связанными с нарушением синтеза α- или β-цепей гемоглобина, являются талассемии. Наряду с болезнями, наследственная природа которых ярко выражена, существует множество болезней, характеризующихся семейной предрасположенностью. Это такие широко распространённые заболевания, как сахарный диабет, подагра, атеросклероз, шизофрения и ряд других. В отличие от моногенных болезней, эти заболевания относят к мультифакторным. Поэтому исследования, направленные на выявление белков, аллельные формы которых ответственны за предрасположенность к заболеванию, являются задачами настоящего и будущего времени. Использование ДНК-технологий в медицине Достижения в области молекулярной биологии способны сильно изменить практическую медицину. Они не только углубили наши знания об экспрессии генов и причинах многих болезней, но способствовали разработке новых подходов к их диагностике и лечению. Было установлено, что полиморфизм генов широко распространён в популяции людей, показана взаимосвязь между изменениями в структуре ДНК и многими болезнями. Идентификация генов, нарушение работы которых приводит к развитию наследственных заболеваний, создала предпосылки для подробного анализа генетических и биохимических основ патогенеза этих заболеваний и разработки наиболее эффективных методов лечения. Методами молекулярной медицины были созданы вакцины для предотвращения гепатитов, инсулин человека - для лечения сахарного диабета, фактор VIII - для восстановления нормального свёртывания крови и лечения гемофилии и многие другие препараты. С помощью генной терапии оказалось возможным вводить в организм больного полноценно работающие гены и таким образом восстанавливать метаболические нарушения, вызванные мутантными генами.В стадии клинических испытаний находятся методы гено-коррекции таких наследственных болезней, как семейная гиперхолестеринемия, гемофилия В, муковисцидоз и некоторые другие. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
