|
|
Сборник всех лекций. Общая характеристика обмена веществ и энергии. Биоэнергетика
ОБМЕН ЛИПИДОВ
План:
Переваривание липидов пищи, транспорт липидов
Окисление жирных кислот, глицерола
Биосинтез липидов
Нарушения липидного обмена
В среднем организм человека получает около 80-150 г жиров растительного и животного происхождения в сутки.
Жиры пищи не перевариваются слюной, в желудке отмечается частичное разрушение липопротеидных комплексов мембран. У человека и млекопитающих расщепление жиров происходит преимущественно в верхних отделах тонкого кишечника.
В двенадцатиперстную кишку поступает желчь и панкреатический сок, необходимые для эмульгирования и переваривания жиров. Происходит нейтрализация желудочного сока бикарбонатами панкреатического скока. В соке поджелудочной железы содержатся липазы, имеющие оптимум рН - 8 (в присутствии желчи он смещается с 8 до 6).
Желчь содержит желчные кислоты: холевую (её производные: дезоксихолевая, литохолевая и хенодезоксихолевая) и коньюгированные кислоты - гликохолевую (конъюгат с аминокислотой глицином) и таурохолевую (конъюгат с аминокислотой таурином).

Холевая кислота
Желчные кислоты образуются в печени из холестерола при участии цитохрома Р450, О2, НАДФН, витамина С.
Желчные кислоты, их соли способствуют эмульгированию жиров, резко снижают поверхностное натяжение
на поверхности раздела фаз жир/вода, капли жира дробятся, а жёлчные кислоты образуют гидратную оболочку и стабилизируют жировую эмульсию. В результате эмульгирования резко увеличивается площадь соприкосновения образовавшихся мельчайших капелек жира с водным раствором липазы, и фермент лучше действует.
Под действием липаз от триглицеридов отщепляются жирные кислоты сначала в α-положении (1и 3), так как α-эфирные связи чувствительны к действию липаз. Под действием изомераз происходит переход β-моноглицерида в α-моноглицерид с дальнейшим отщеплением ацильной группы.
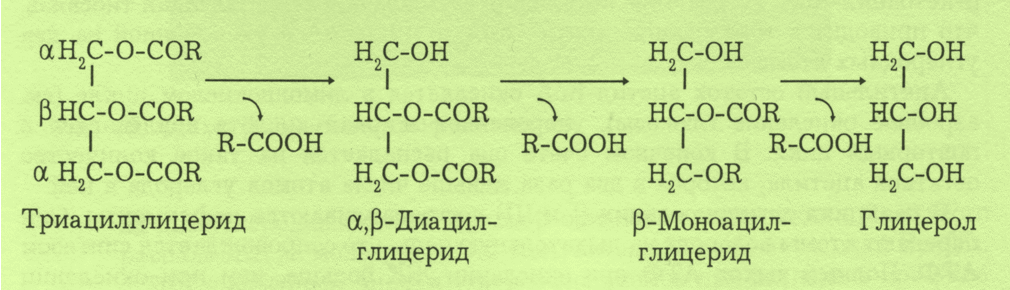
Схема гидролиза триацилглицерида
Расщепление фосфолипидов идет под действием фосфолипаз и лизофосфолипаз. Стериды расщепляются под действием холестераз поджелудочной железы с образованием холестерола и жирных кислот. В результате гидролиза липидов образуются анионы жирных кислот, моно, ди и триацилглицерины, эмульгированные мылами, глицерин, холин, этаноламин, холестерол. Всасываются все продукты расщепления и в небольшой степени (3-10%) нерасщепленные жиры.
Глицерин и жирные кислоты с количеством углеродных атомов до 10 всасываются и поступают в печень через портальную систему кровообращения. Жирные кислоты, имеющие более 10 атомов углерода в цепи и моноацилглицерины образуют мицеллы с желчными кислотами и мылами и могут проходить через водный слой слизистой кишечника. Жирные кислоты образуют растворимые комплексы с гликохолевой и таурохолевой кислотой - холеиновые кислоты, которые легко всасываются в эпителии кишечника.
Из стенки кишечника желчные кислоты всасываются в кровь, поступают в печень и опять возвращаются в желчь. Часть желчных кислот (0,2-0,5 г) в сутки выводится с калом.
Лучше перевариваются и всасываются липиды, находящиеся в жидком состоянии при температуре тела; липиды с более высокой температурой плавления плохо перевариваются и всасываются.
Среди стероидов холестерин легко проходит через стенку кишечника. Он попадает в пищеварительный тракт человека преимущественно с яичным желтком, мясом, печенью, мозгом (ежедневно 0,1–0,3 г), всасывается в кишечнике в виде комплексов с желчными кислотами.
Большая часть продуктов переваривания в клетках кишечника вновь превращается в триацилглицериды. Ресинтезированные триацилглицериды, фосфолипиды, холестерин и его эфиры в стенках эпителия кишечника соединяются с небольшим количеством белка и образуют хиломикроны (100-500 нм). Они проникают в лимфатическую систему кишечника, из нее через грудной лимфатический проток в кровяное русло.
Хиломикроны транспортируют экзогенные липиды в печень и жировую ткань. Они легко диффундируют из крови в межклеточные пространства печени. Гидролиз триацилглицеринов может происходить внутри клеток печени и на их поверхности. В клетки жировой ткани хиломикроны проникать не могут и гидролиз идет на поверхности эндотелия капилляров жировой ткани под действием липопротеинлипазы.
Часть образовавшихся жирных кислот проникает в клетки и запасается в виде липидов, другая часть связывается с альбуминами сыворотки крови и разносится в органы и ткани. Резервные липиды на 99% являются триацилглицеридами. Они непрерывно мобилизуются и одновременно такое же количество липидов запасается.
Метаболизм резервных липидов начинается с гидролиза с участием липопротеинлипазы крови или жировой ткани. Жирные кислоты связываются с альбумином крови и переносятся в печень, где происходят их главные превращения.
Глицерин может включаться в гликолиз с предварительным образованием глицерин-3-фосфата или в глюконеогенез.
Окисление жирных кислот в клетках происходит в митохондриях при участии мультиферментного комплекса путем β-окисления.
Вначале происходит активация жирной кислоты ацил-КоА-синтетазой. АТФ стимулирует образование тиоэфирной связи между карбоксилом жирной кислоты и сульфгидрильной группой кофермента А под действием ацил-КоА-синтетазы (тиокиназы жирных кислот):
R-СООН + АТФ + Н-S-КоА R-СО
S-КоА + АМФ + Н4Р2О7
Ацил-КоА
Жирные кислоты активируются на наружной митохондриальной мембране, а окисляются в митохондриальном матриксе. Ацил-КоА переносится карнитином, образуя с ним сложный эфир:

После прохождения через мембрану идет обратная реакция (карнитин-ацил-КоА-трансфераза).
Насыщенный Ацил-КоА распадается в результате повторяющейся последовательности из четырех реакций:
1. Окисление с участием флавинадениндинуклеотида.
2. Гидратация.
3. Окисление с участием НАД.
4. Тиолиз с участием кофермента А.
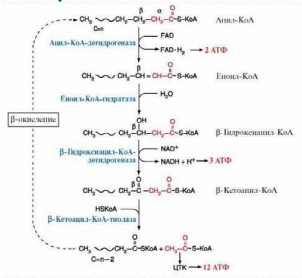
При этом цепь укорачивается на два углеродных атома и происходит генерирование ФАДН2, НАДН и ацетил-КоА. Первые три реакции расщепления жирных кислот сходны с последними реакциями цикла ТКК. Укороченный ацил-КоА подвергается следующему циклу окисления.
В каждом цикле реакций образуется по одной молекуле ФАДН2, НАДН и ацетил-КоА:
Сn-ацил-КоА + ФАД + НАД+ + Н2О + КоА-S-Н Сn-2-ацил-КоА + ФАДН2 + НАДН + + Ац-КоА + Н+
При окислении жирных кислот выделяется большое количество энергии:
Пальмитоил-КоА + 7 ФАД + 7 НАД+ + 7 НS-КоА + 7Н2О--
--- 8 Ац-КоА + 7 ФАДН2 + 7 НАДН + 7 Н+
Пальмитиновая кислота окисляется за 7 циклов. В дыхательной цепи НАДН образует 3АТФ, ФАДН2 - 2АТФ, Ац-КоА - 12 АТФ. Итого образуется: 7х3 + 7х2 + 8х12 = 131 АТФ. На активацию молекулы пальмитиновой кислоты была затрачена 1АТФ. В результате окисления пальмитиновой кислоты образуется 130 молекул АТФ.
Если жирная кислота содержит в молекуле 2n атомов С, то при окислении образуется n молекул ацетил-КоА, (n–1) ФАДН2 и (n–1) НАДН2. В результате в дыхательной цепи образуется 2·(n–1) + 3·(n–1) = 5(n–1) АТФ
При окислении 1 молекулы ацетил-КоА в цикле Кребса и дыхательной цепи образуется 12 молекул АТФ, а при окислении n молекул – 12n АТФ. Необходимо учесть, что 1 молекула АТФ идет на активирование кислоты.
Таким образом, энергетический баланс: 5(n–1)+12n–1 = (17n – 6) АТФ, где n – половина числа атомов углерода в жирной кислоте.
К.п.д. процесса β-окисления около 45%, что близко к гликолизу, ЦТК, окислительному фосфорилированию.
Жирные кислоты, имеющие нечетное число атомов углерода на последнем этапе дают пропионил-КоА. Активированный трехуглеродный фрагмент пропионил-КоА включается в ЦТК после его превращения в сукцинил-КоА.
Окисление ненасыщенных кислот происходит, как и насыщенных, но требуется еще фермент трансеноил-КоА-изомераза, который осуществляет переход двойной связи в положение 2,3 и изменение конфигурации. Для окисления полиненасыщенных кислот требуется еще один дополнительный фермент - 3-гидроксибутирил-КоА-эпимераза, который переводит D-изомер в L-изомер, легко окисляемый специальной дегидрогеназой. Наличие изомеразы и эпимеразы обеспечивает возможность полного окисления всех ненасыщенных жирных кислот, содержащихся в липидах.
Ацетил-КоА, образовавшийся при окислении жирных кислот включается в цикл ТКК в условиях, когда расщепление жиров и углеводов сбалансировано. Включение Ац-КоА в цикл зависит от доступности оксалоацетата для образования цитрата. Если расщепление жиров преобладает, то Ац-КоА распадается по другому пути. В случае голодания или сахарного диабета оксалоацетат расходуется на образование глюкозы и не может конденсироваться с Ац-КоА. В этих условиях образуются кетоновые тела: ацетоацетат, 3-гидроксибутират и ацетон.
2Ац-КоА + Н2О ® СН3-СО-СН2-СОО- + 2 НS-КоА + Н+
СН3-СО-СН2-СООН ® СН3-СО-СН3 + СО2
Ацетоацетат и гидроксибутират имеют физиологическое значение. В норме они являются дыхательным топливом и количественно важными источниками энергии. их потребляют сердечная мышца и корковое вещество надпочечников. Глюкозу употребляет мозг. Он при голодании и сахарном диабете адаптируется к использованию ацетоацетата.
Окисление глицерола происходит по схеме:
глицерол → α-глицерофосфат → диоксиацетонфосфат → пируват → ацетил-КоА.
Ацетил-КоА подвергается превращениям в цикле лимонной кислоты. Суммарно при этих превращениях 1 моль глицерола соответствует образование 22 моль АТФ.
Жиры – очень энергоёмкие вещества. При пересчёте энергетического эффекта распада 1 моль триглицерида пальмитиновой кислоты на число моль АТФ получаем 22 + 3*130 = 412(моль АТФ).
БИОСИНТЕЗ ЛИПИДОВ
Жиры как основная форма депонирования энергии
Приём пищи человеком происходит иногда со значительными интервалами, поэтому в организме выработались механизмы депонирования источников энергии.
Жиры - наиболее выгодная и основная форма депонирования энергии. Это обусловлено следующими причинами:
жиры – наиболее энергоёмкие вещества: при окислении 1глипидов окисляется 39,1 кДж энергии – в 2 раза больше, чем при окислении такого же количества белков или углеводов.
запасы гликогена в организме не превышают 300 г и обеспечивают организм энергией не более суток. Депонированный жир может обеспечивать организм энергией при голодании в течение длительного времени (до 7-8 недель).
молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Подсчитано, что, если бы энергия, запасаемая в жирах, хранилась в форме сильно гидратированных молекул гликогена, то масса тела человека увеличилась бы на 14-15 кг.
Синтез жиров (триацилглицеролов)
Основными структурными блоками для синтеза триацилглицеролов являются α-глицеролфосфат и ацильные производные КоА (ацил-КоА).
Синтез жирных кислот
Жирные кислоты поступают с пищей или синтезируются в организме (кроме полиеновых кислот). Субстраты, необходимые для синтеза жирных кислот, образуются при катаболизме глюкозы и таким образом, часть глюкозы превращается сначала в жирные кислоты, а затем в жиры. Хотя специфический путь катаболизма жирных кислот заканчивается образованием ацетил-КоА, служащим исходным субстратом для синтеза жирных кислот, процессы синтеза и окисления жирных кислот необратимы. Они разобщены и происходят в разных компартментах клеток (биосинтез протекает в цитозоле, а окисление - в митохондриях) и катализируются разными ферментами. Значительная часть заменимых жирных кислот синтезируется в печени, в меньшей степени - в жировой ткани.
Ферменты синтеза организованы в мультиферментный комплекс - синтетаза жирных кислот. Он содержит три домена, выполняющих определённые функции: один из них отвечает за удлинение (элонгацию) цепи, второй – за восстановление цепи жирныхкислот, третий – за высвобождение образовавшегося ацила из комплекса с ферментом в виде ацил-КоА.
Источником углерода для синтеза жирных кислот служит ацетил-КоА, образующийся при β-окислении жирных кислот и при распаде глюкозы в абсорбтивном периоде при окислительном декарбоксилировании пирувата.
Растущая цепь жирных кислот удлиняется путем присоединения двууглеродных остатков.
На всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ).
Роль восстановителя в биосинтезе жирных кислот играет НАДФН. Он частично (на 50%) образуется в реакциях пентозофосфатного цикла, частично – в других реакциях, в частности, в реакциях декарбоксилирования малата и изоцитрата.
Известно, что ацетил-КоА не может диффундировать в цитозоль клетки, так как митохондриальная мембрана непроницаема для данного субстрата. Поэтому вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль, где он расщепляется до Ацетил-КоА и оксалоацетата. Цитрат выступает в роли переносчика ацетильного радикала.
В реакции карбоксилирования ацетил-КоА образуется малонил- КоА:
Н3С-СО-S-КоА + НСО3- + АТФ ----- -ООС-СН2-СО-S-КоА + АДФ +Н3РО4
малонил-КоА
Эта реакция является лимитирующей для всего процесса синтеза жирных кислот.
Ацетил-КоА и малонил-КоА вступают в реакцию с ацилпереносящим белком (АПБ) с образованием ацетил-АПБ и малонил-АПБ.
СН3-СО-S-КоА + НS-АПБ ---- СН3-СО-S-АПБ + НS-КоА
НООС-СН2-СО-S-КоА + НS-АПБ ---- НООС-СН2-СО-S-АПБ + НS-КоА
Ацетил-АПБ и малонил-АПБ вступают в реакцию конденсации с образованием ацетоацетил-АПБ под действием 3-кетоацил-АПБ-синтетазы:
СН3-СО-S-АПБ + НООС-СН2-СО-S-АПБ ---- СН3-СО-СН2-СО-S-АПБ +НS-АПБ + СО2
ацетоацетил-АПБ
Синтез из двух ацетильных остатков невыгоден энергетически. Присоединение малонила с одновременным декарбоксилированием идет с выделением энергии и поэтому протекает активно, не требуя дополнительных условий.
Следующие за конденсацией восстановление, дегидратация и второе восстановление приводят к образованию бутирил-АПБ, содержащего четыре углеродных атома:
3-кетоацил-АПБ-редуктаза
СН3-СО-СН2-СО-S-АПБ + НАДФН + Н+-------------------------
---- СН3-СН-СН2-СО-S-АПБ + НАДФ+
|
ОН
3-гидроксиацил-АПБ-дегидратаза
СН3-СН-СН2-СО-S-АПБ - Н2О ---------------- СН3-СН=СН-СО-S-АПБ (кротонил-АПБ)
|
ОН
еноил-АПБ-редуктаза
СН3-СН=СН-СО-S-АПБ + НАДФН + Н+ -------------СН3-СН2-СН2-СО-S-АПБ + НАДФ+
(бутирил-АПБ)
Следующие за конденсацией восстановление, дегидратация и второе восстановление приводят к образованию бутирил-АПБ, содержащего четыре углеродных атома.
Во втором цикле бутирил-АПБ конденсируется с малонил-АПБ с образованием шестиуглеродного фрагмента, затем идет образование восьмиуглеродного фрагмента и т.д. до шестнадцатиуглеродного соединения (пальмитоил-АПБ). Пальмитоил-АПБ гидролизуется с образованием пальмитиновой кислоты.
Суммарное уравнение синтеза пальмитиновой кислоты из ацетил-КоА и малонил-КоА имеет следующий вид:
Ац-КоА + 7 Малонил-КоА + 14 НАДФН + 14 Н+ пальмитиновая кислот + 7СО2 +14 НАДФ+ + 8 НS-КоА+ +6Н2О
или
CH3-CO-SKoA + 7 HOOC-CH2-CO-SKoA + 14 (НАДФН + H+) → C15H31COOH + 7 СО2 + 6 Н2О + 8 HSKoA + 14 НАДФ+.
Установлено, что в цитоплазме печеночных клеток синтезируется пальмитиновая кислота (16 углеродных атомов), а в митохондриях этих клеток из уже синтезированной в цитоплазме клетки пальмитиновой кислоты или из жирных кислот экзогенного происхождения, т.е. поступающих из кишечника, образуются жирные кислоты, содержащие 18, 20 и 22 углеродных атома.
Образование ненасыщенных жирных кислот
В отличие от растительных тканей ткани животных обладают ограниченной способностью превращать насыщенные жирные кислоты в ненасыщенные. Установлено, что две наиболее распространенные мононенасыщенные жирные кислоты – пальмитоолеиновая и олеиновая – синтезируются из активированных форм пальмитиновой и стеариновой кислот.
Эти превращения протекают в микросомах клеток печени и жировой ткани. Ферменты, участвующие в этих превращениях, получили название десатураз. Наряду с десатурацией жирных кислот (образование двойных связей) происходит и их удлинение, причем оба эти процесса могут сочетаться и повторяться.
Установлено, что в микросомах млекопитающих отсутствуют десатуразы, которые могли бы катализировать образование двойных связей в цепи далее 9-го углеродного атома. Поэтому не могут образовываться линолевая, линоленовая, арахидоновая кислоты. Они относятся к категории незаменимых жирных кислот и должны поступать с продуктами питания, в частности, с растительными маслами.
Образование глицерол-3-фосфата
Наряду с жирными кислотами к субстратам в синтезе жиров относится α-глицеролфосфат, являющийсяпредшественником фосфатидной кислоты –важнейшего метаболита в процессе образования липидов.
α-Глицеролфосфат образуется в печени двумя путями:
восстановлением дигидроксиацетонфосфата - промежуточного метаболита гликолиза с участием НАДН2:

фосфорилированием глицеролкиназой свободного глицерола с участием АТФ.

В жировой ткани глицеролкиназа отсутствует, и восстановление дигидроксиацетонфосфата - единственный путь образования глицерол-3-фосфата.
Основные особенности синтеза жиров
Синтез жиров активируется в абсорбтивный период и происходит в основном в жировой ткани и печени. Но если жировая ткань - место депонирования жира, то печень выполняет важную роль превращения части углеводов, поступающих с пищей, в жиры, которые затем секретируются в кровь в составе ЛПОНП и доставляются в другие ткани (в первую очередь, в жировую). Синтез жиров в печени и жировой ткани стимулируется инсулином.
Мобилизация жира активируется в тех случаях, когда глюкозы недостаточно для обеспечения энергетических потребностей организма: в постабсорбтивный период, при голодании и физической работе под действием гормонов глюкагона, адреналина, соматотропина. Жирные кислоты поступают в кровь и используются тканями как источники энергии.
Метаболический путь синтеза жиров в печени и жировой ткани одинаков, за исключением разных путей образования глицерол-3-фосфата.
Синтез жиров в жировой ткани может происходить только в абсорбтивный период, когда глюкоза поступает в адипоциты с помощью белка-переносчика глюкозы ГЛЮТ-4, активного только в присутствии инсулина, и распадается по пути гликолиза.
В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП. Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя фосфатидную кислоту. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацилглицерола.
Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот.
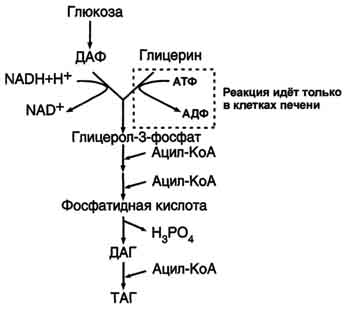
Схема основных превращений в ходе синтеза жиров в печени и жировой ткани
Печень - основной орган, где идёт синтез жирных кислот из продуктов гликолиза. В гепатоцитах жирные кислоты активируются и сразу же используются для синтеза жиров, взаимодействуя с глицерол-3-фосфатом. Как и в жировой ткани, синтез жиров идёт через образование фосфатидной кислоты. Синтезированные в печени жиры упаковываются в ЛПОНП и сек-ретируются в кровь. Скорость синтеза жирных кислот и жиров в печени существенно зависит от состава пищи. Если в пище содержится более 10% жиров, то скорость синтеза жиров в печени резко снижается.
Какой процесс будет преобладать в организме - синтез жиров (липогенез) или их распад (липолиз), зависит от поступления пищи и физической активности. В абсорбтивном состоянии под действием инсулина происходит липогенез, в постабсорбтивном состоянии - липолиз, активируемый глюкагоном. Адреналин, секреция которого увеличивается при физической активности, также стимулирует липолиз.
Регуляция синтеза жиров. В абсорбтивный период при увеличении соотношения инсулин/ глюкагон в печени активируется синтез жиров. В печени инсулин активирует ферменты, участвующие в превращении части глюкозы, поступающей с пищей, в жиры. Это - регуляторные ферменты гликолиза, пируватдегидрогеназный комплекс и ферменты, участвующие в синтезе жирных кислот из ацетил-КоА. Результат действия инсулина на обмен углеводов и жиров в печени - увеличение синтеза жиров и секреция их в кровь в составе ЛПОНП.
Мобилизация депонированных жиров стимулируется глюкагоном и адреналином и, в меньшей степени, некоторыми другими гормонами (соматотропным, кортизолом). В постабсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему, активирует протеинкиназу А, которая активирует посредством фосфорилирования трицилглицероллипазу (ТАГ-липазу), явлющуюся гормончувствительной липазой, что инициирует липолиз и выделение жирных кислот и глицерина в кровь. При физической активности увеличивается секреция адреналина, который также действует через β-адренергические рецепторы адипоцитов, активирующие аденилатциклазную систему.
Когда постабсорбтивный период сменяется абсорбтивным, инсулин активирует специфическую фосфатазу, которая дефосфорилирует гормончувствительную липазу, и распад жиров останавливается.
В синтезе фосфолипидов, как и в синтезе жиров, ключевым продуктом является фосфатидная кислота.
Основные стадии синтеза (на примере образования фосфатидилхолина):
Фосфорилирование холина с затратой АТФ – образование фосфохолина.
Образование цитидиндифосфохолина (ЦДФ-холина).
Образование диацилглицерола (ДАГ) из фосфатидной кислоты .
4. Взаимодействие ДАГ с ЦДФ-холином с получением фосфатидилхолина.
Все азотистые основания фосфолипидов могут подвергаться взаимопревращениям с участием липотропных веществ.
Липотропные вещества способствуют образованию фосфолипидов и препятствуют синтезу нейтрального жира в печени.
При недостатке липотропных факторов начинается жировая инфильтрация печени.
К липотропным факторам относят:
- аминоспирты (холин, инозитол, этаноламин);
- аминокислоты – серин, метионин как донор метильных групп для синтеза холина;
- витамины (В6, В12, фолиевая кислота)
- полиненасыщенные жирные кислоты.
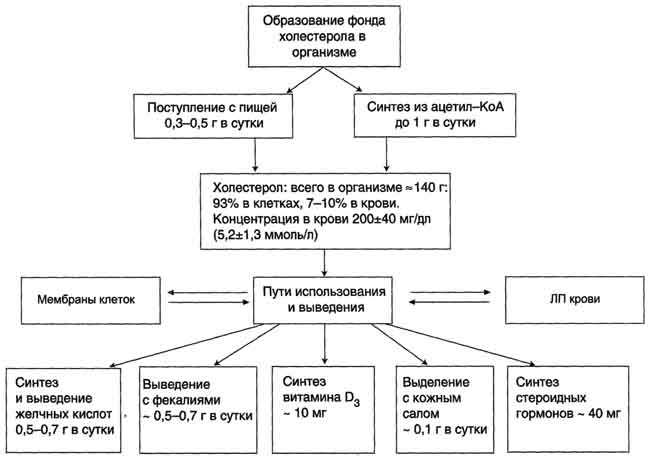
Синтез холестерина
В организме взрослого человека в сутки образуется 1-1,3 г холестерина. Преобладающее количество холестерина (около 80%) образуется в печени. Скорость синтеза регулируется по механизму обратной отрицательной связи. В норме поступление холестерола с пищей снижает синтез собственного холестерола в печени, однако с возрастом эффективность регуляции у многих людей снижается. С пищей поступает обычно около 0,5 г холестерина в сутки. Всасывается около 30% холестерина. Желчь поставляет в кишечник 1,5-2,0 г холестерина. Выведение холестерина происходит в свободном виде и путем окисления его в желчные кислоты.
Основные направления превращений холестерина представлены на схеме:
Биосинтез холестерина чрезвычайно сложен – включает около 100 последовательных реакций. Выделяют три основные этапа:
– превращение ацетил-КоА в мевалоновую кислоту;
– образование из мевалоновой кислоты сквалена, содержащего изопреновые фрагменты;
– циклизация сквалена в холестерин (через промежуточное образование ланостерина).
ацетил-КоА
↓
СН3
|
НООС-СН2-С-СН2-СН2ОН
|
ОН
мевалоновая кислота
↓
сквален
↓
холестерин
Реакция образования мевалоновой кислоты катализируется 3-гидрокси-3-метилглутарил-КоА-редуктазой (ГМГ-КоА-редуктазой) и является регуляторной в метаболическом пути синтеза холестерола. Регуляция синтеза холестерола происходит путём регуляции ключевого фермента ГМГ-КоА-редуктазы.
В абсорбтивный период при увеличении соотношения инсулин/глюкагон этот фермент дефосфорилируется и переходит в активное состояние. Одновременно увеличивается и доступность исходного субстрата для синтеза холестерола - ацетил-КоА (в результате приёма пищи, содержащей углеводы и жиры, так как ацетил-КоА образуется при распаде глюкозы и жирных кислот).
В постабсорбтивном состоянии глюкагон стимулирует фосфорилирование ГМГ-КоА-редуктазы, переводя её в неактивное состояние. В результате синтез холестерола в постабсорбтивном периоде и при голодании ингибируется.
НАРУШЕНИЯ ЛИПИДНОГО ОБМЕНА
Дислипопротеинемии обычно являютсянаследственными заболеваниями. Они сопровождаются либо дефектами структуры липопротеинов, либо патологией рецепторов к липопротеинам, либо нарушением регуляции образования липопротеинов.
Наиболее распространены нарушения обмена триацилглицеролов и холестерола.
Ожирение
Жировая ткань составляет 20-25% от общей массы тела у женщин и 15-20% у мужчин. При полном голодании этот запас расходуется 5-7 недель. При нормальном питании количество жира в организме не изменяется. Жиры обновляются постоянно.
Избыточное накопление жира в адипоцитах (ожирение) широко распространено. Среди взрослого населения некоторых стран около 50% людей страдает ожирением. Ожирением считают состояние, когда масса тела превышает 20% от "идеальной" для данного индивидуума. Образование адипоцитов происходит ещё во внутриутробном состоянии, начиная с последнего триместра беременности, и заканчивается в препубертатный период. После этого жировые клетки могут увеличиваться в размерах при ожирении или уменьшаться при похудании, но их количество не изменяется в течение жизни.
Причины первичного ожирения:
генетические нарушения (до 80% случаев ожирения - результат генетических нарушений);
состав и количество потребляемой пищи, метод питания в семье (при ежедневном употреблении 3 г лишней пищи за 10 лет образуется избыточная масса тела в 10 кг. В зависимости от интенсивности нагрузки и возраста суточная потребность в энергии колеблется у женщин от 2000 до 3000 ккал в день, а у мужчин - от 2300 до 4000 ккал. Количество потребляемой пищи определяется многими факторами, в том числе и химическими регуляторами чувства голода и насыщения. Эти чувства определяются концентрацией в крови глюкозы и гормонов, которые инициируют чувство насыщения;
уровень физической активности;
психологические факторы.
Ожирение - важнейший фактор риска развития инфаркта миокарда, инсульта, сахарного диабета, артериальной гипертензии и желчнокаменной болезни.
Нарушения обмена холестерола чаще всего приводят к гиперхолестеролемии и последующему развитию атеросклероза. При атеросклерозе происходит образование на стенках артерий так называемых атеросклеротических бляшек, представляющих собой в основном отложения холестерола. Атеросклеротические бляшки разрушают клетки эндотелия сосудов, и в таких местах часто образуются тромбы.
Атеросклероз - полигенное заболевание. Одна из основных причин развития атеросклероза - нарушение баланса между поступлением холестерола с пищей, его синтезом и выведением из организма. Выведение холестерола ограничено, не превышает 1,2-1,5 г/сут, а поступление с пищей при неправильном питании может превысить этот барьер, поэтому с возрастом постепенно происходит накопление холестерола в организме. Важным фактором развития атеросклероза являются генетические дефекты белков и ферментов, участвующих в обмене холестерола. К причинам развития атеросклероза относят: нарушение транспорта, синтеза холестерола (избыток липопротеинов низкой плотности (ЛПНП), недостаток липопротеинов высокой плотности ЛПВП, низкая активность липопротеинлипазы).
Факторы риска развития атеросклероза: курение, гиподинамия, стрессы, недостаток витаминов А,Е,С и ненасыщенных жирных кислот; переедание, эндокринные патологии, наследственные факторы.
ЛПОНП и ЛПНП считаются "атерогенными", поскольку они переносят холестерол к тканям и, что особенно важно, к клеткам эндотелия сосудов, где избыток холестерола может вызвать атеросклероз.
ЛПВП считаются "антиатерогенными", т.к.
они убирают избыток холестерола от сосудов и предотвращают развитие атеросклероза.
При занятиях спортом или физкультурой в крови увеличивается доля ЛПВП, вот почему физическая работа полезна в борьбе с атеросклерозом.
Желчнокаменная болезнь - патологический процесс, при котором в жёлчном пузыре образуются камни, основу которых составляет холестерол. У большинства больных желчнокаменной болезнью усилен синтез холестерола, а процесс образования из него жёлчных кислот замедлен, что приводит к диспропорции количества холестерола и жёлчных кислот, секретируемых в жёлчь. Если камни начинают перемещаться из жёлчного пузыря в жёлчные протоки, то они вызывают спазм жёлчного пузыря и протоков, что больной ощущает как приступ сильной боли.
Причин образования жёлчных камней много: пища, богатая холестеролом, гиперкалорийное питание, застой жёлчи в жёлчном пузыре, нарушения синтеза жёлчных кислот, инфекции жёлчного пузыря.
|
|
|
 Скачать 3.68 Mb.
Скачать 3.68 Mb.