Сборник всех лекций. Общая характеристика обмена веществ и энергии. Биоэнергетика
 Скачать 3.68 Mb. Скачать 3.68 Mb.
|
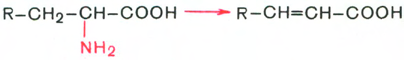
ОБМЕН БЕЛКОВ, АМИНОКИСЛОТПлан: Значение белкового обмена. Взаимосвязь обмена белков и аминокислот. Источники и пути использования аминокислот. Переваривание белков. Химические превращения аминокислот. Основные пути связывания аммиака. Орнитиновый цикл. Значение белкового обмена. Взаимосвязь обмена белков и аминокислот. Источники и пути использования аминокислот Обмен белков играет ведущую роль в метаболизме живых организмов, так как именно он обеспечивает самовоспроизведение организмами себе подобных путем программированного синтеза специфических белков. Все остальные виды обмена подчинены этой глобальной задаче живого: используются энергия обмена углеводов и липидов, строительный материал в виде углеродных остатков промежуточных продуктов метаболизма углеводов для синтеза аминокислот и др. В течение всей жизнедеятельности в организме постоянно и с высокой скоростью совершаются два противоположных процесса: распад белковых соединений и синтез этих соединений. В день человеку необходимо 80-100 г белка, людям физического труда - 120-150 г, при этом животных белков должно быть 50-70 г. Даже в раннем детском возрасте требуется 55–70 г белка в сутки. Особенно чувствительны к белковому голоданию ЦНС и кора головного мозга. Даже при полном голодании они обновляют свои белки за счет белков мышц и печени, т.е. белки плазмы крови, печени и мышц могут служить в качестве «резервных», обеспечивая нормальную деятельность жизненно важных органов. Белки пищи бывают полноценными и неполноценными. Полноценные белки в своем составе содержат все незаменимые аминокислоты: (лизин, валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан), а также полузаменимые, образующиеся в организме, но в недостаточном количестве (аргинин, гистидин). В неполноценных белках отсутствует одна или несколько незаменимых аминокислот. Полноценными белками являются - альбумины молока и яиц, казеин, (в основном белки животного происхождения), а также некоторые растительные белки, например, глутенин пшеницы. Неполноценными являются многие растительные белки. Они обычно бедны лизином, метионином, триптофаном. Содержание белка в растительных продуктах невелико. При вегетарианском питании требуется значительный объем пищи и ее разнообразие. Некоторые растительные белки плохо перевариваются. Качественный белковый состав пищи имеет существенное значение, так как отсутствие или недостаток хотя бы одной какой-либо незаменимой аминокислоты может служить лимитирующим фактором биосинтеза всех белков в организме. Синтез белка подчиняется закону «все или ничего» и осуществляется при условии наличия в клетке полного набора всех 20 аминокислот. Даже при поступлении всех аминокислот с пищей организм может испытывать состояние белковой недостаточности, если всасывание какой-либо одной аминокислоты в кишечнике замедлено или если она разрушается в большей степени, чем в норме, под действием кишечной микрофлоры. В этих случаях будет происходить ограниченный синтез белка или организм будет компенсировать недостаток аминокислоты для биосинтеза белка за счет распада собственных белков. На долю аминокислот (в свободном виде и в составе белков) приходится 95% всего азота организма. Поэтому о состоянии аминокислотного и белкового обмена можно судить по азотистому балансу, т.е. разнице между количеством азота, поступающего с пищей, и количеством выделяемого азота (используется также понятие белковый баланс). У взрослого здорового человека при нормальном питании имеет место азотистое равновесие (или белковое равновесие), т.е. количество выделяемого азота (белка) равно количеству поступающего. Наименьшее содержание белков в пище, при котором устанавливается белковое равновесие, называется белковым минимумом. Оно сохраняется и при избытке белков, невозможно откладывание белков в организме и поэтому происходит выведение продуктов их распада кислой природы - ацидоз. Кислые продукты выводятся из организма и нейтрализуются минеральными щелочными веществами, содержащимися в овощах и фруктах. Избыточное одностороннее питание животными белками вызывает в кишечнике усиленные гнилостные процессы с образованием токсических веществ. На кишечник благоприятно действуют кисломолочная и растительная пища. Положительный азотистый баланс наблюдается в период роста и при выздоровлении после истощающих заболеваний. Отрицательный азотистый баланс – при старении, голодании, истощающих заболеваниях. При отсутствии белковой пищи количество выводимого азота составит около 4 г за сутки (или 25 г белков собственных тканей), при полном голодании отрицательный азотистый баланс ещё больше. Обмен белков тесно связан с обменом аминокислот, нуклеиновых кислот. Значение аминокислот для организма в первую очередь определяется тем, что они используются для синтеза белков, метаболизм которых занимает особое место в процессах обмена веществ между организмом и внешней средой. Аминокислоты непосредственно участвуют в биосинтезе не только белков, но и большого количества других биологически активных соединений, в том числе нуклеотидов, гема и других веществ. Катаболизм аминокислот может служить источником энергии для синтеза АТФ. Энергетическая функция аминокислот становится значимой при голодании, некоторых патологических состояниях (сахарный диабет и др.) и преимущественно белковом питании. Именно обмен аминокислот осуществляет взаимосвязь многообразных химических превращений в живом организме. Фонд свободных аминокислот организма составляет примерно 35 г. Большая часть аминокислот входит в состав белков, количество которых в организме взрослого человека нормального телосложения составляет примерно 15 кг. Источники свободных аминокислот в клетках: - белки пищи; - собственные белки тканей; - синтез аминокислот из углеводов. Специальной формы депонирования аминокислот, подобно глюкозе (в виде гликогена) или жирных кислот (в виде жиров), не существует. Поэтому резервом аминокислот могут служить все функциональные и структурные белки тканей, но преимущественно белки мышц, поскольку их больше, чем всех остальных. В организме человека в сутки распадается на аминокислоты около 400 г белков, примерно такое же количество синтезируется. Поэтому тканевые белки не могут восполнять затраты аминокислот при их катаболизме и использовании на синтез других веществ. Первичными источниками аминокислот не могут служить и углеводы, так как из них синтезируются только углеродная часть молекулы большинства аминокислот, а аминогруппа поступает от других аминокислот. Следовательно, основным источником аминокислот организма служат белки пищи. 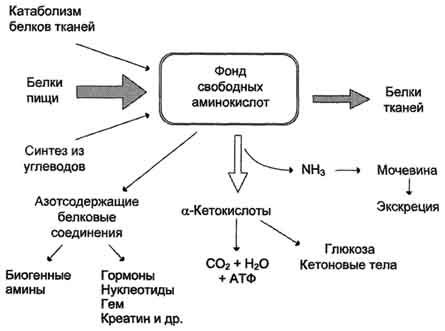 Источники и пути использования аминокислот Продукты превращений аминокислот Преобладающая доля аминокислот, продуктов гидролитического распада, используется для ресинтеза белка; часть преобразуется в другие аминокислоты, либо более простые соединения, выводимые из организма человека. Белки, пептиды синтезируются из аминокислот в результате реакции поликонденсации. Окситоцин и вазопрессин - это циклические пептиды с гормональным действием (содержат по 9 аминокислотных остатков). Глутатион - это трипептид (γ-глутамилцистеинилглицин), он принимает активное участие в ОВР и переносе аминокислот через биологические мембраны. Взаимопревращения аминокислот: например, тирозин образуется окислением фенилаланина; метионин превращается в цистеин путем переноса метильной группы; серин превращается в глицин, и наоборот, отщеплением или присоединением активного формила (с участием тетрагидрофолиевой кислоты и пиридоксальфосфата). Меланин (темноокрашенный пигмент), гормон адреналин образуются в ходе метаболических превращений тирозина. Гистамин (биогенный амин, обладающий сосудорасширяющим действием, являющийся медиатором при болевом синдроме) образуется декарбоксилированием гистидина декарбоксилазой в присутствии пиридоксаль-5-фосфата. Холин образуется метилированием этаноламина, при этом донором «активных» СН3- является метионин. Фолиевая кислота (птероилглутаминовая кислота) синтезируется с участием глутаминовой кислоты. Кофермент А образуется из аденозин-3',5'-дифосфата и пантотеинфосфата. Пантотеновая кислота образуется из пантоевой кислоты (α,γ-диокси-β,β-диметилмасляной кислоты) и β-аланина. Никотинамидмононуклеотид (NMN) образуется из никотиновой кислоты, являющейся одним из главных продуктов превращения триптофана. Синтез пуринов, пиримидинов связан с метаболизмом глицина, аспарагиновой кислоты, глутамина. Углеводы образуются из гликогенных аминокислот, метаболизм которых заканчивается образованием пирувата, либо в процессе глюконеогенеза из некоторых метаболитов цикла лимонной кислоты. Жирные кислоты образуются при деградации некоторых аминокислот. Аминокислоты, не использованные для биосинтеза, подвергаются разложению до конечных продуктов распада. Это происходит, если организм получает больше аминокислот, чем необходимо для биосинтеза белка; во время голодания или при сахарном диабете. Мочевина - конечный продукт распада аминокислот (см. цикл мочевины). СО2 выделяется при декарбоксилировании аминокислот до аминов (в присутствии пиридоксальфосфата). Аммиак образуется при аэробном дезаминировании всех аминокислот. В этом процессе принимают участие оксидазы. Переваривание белков В пищевых продуктах содержание свободных аминокислот очень мало. Подавляющее их количество входит в состав белков, которые гидролизуются в ЖКТ под действием ферментов протеаз (пептидгидролаз). Субстратная специфичность этих ферментов заключается в том, что каждый из них с наибольшей скоростью расщепляет пептидные связи, образованные определёнными аминокислотами. Протеазы, гидролизующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, относящиеся к группе экзопептидаз, гидролизуют пептидную связь, образованную концевыми аминокислотами. Под действием всех протеаз ЖКТ белки пищи распадаются на отдельные аминокислоты, которые затем поступают в клетки тканей. Переваривание белков начинается в желудке. Желудочный сок является жидкостью с сильнокислой реакцией (pH=2), он содержит соляную кислоту, которая активирует профермент пепсиноген, превращающийся в пепсин, создаёт оптимум рН (1,0-2,5) для действия пепсина и препятствует попаданию патогенных бактерий в кишечник. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ). Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты. При различных заболеваниях ЖКТ в желудке нарушается выделение НСl и пепсиногена, при этом переваривание белков заметно снижается. Переваривание белков в кишечнике Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную кишку. В тонкий кишечник из поджелудочной железы выделяется панкреатический сок, содержащий НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0. Под действием ферментов поджелудочной железы - панкреатических ферментов - и клеток кишечника завершается переваривание белков. В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, прокарбоксипептидазы. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, карбоксипептидазы. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками. В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот. Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что эти ферменты образуются в виде неактивных предшественников. В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. Транспорт аминокислот в клетки Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью. Существуют транспортные системы, обеспечивающие перенос аминокислот через мембраны, одним из важнейших является γ-глутамильный цикл. Перенос аминокислоты внутрь клетки осуществляется в комплексе с глутамильным остатком глутатиона под действием γ-глутамилтрансферазы. Затем аминокислота освобождается, а γ-глутамильный остаток в несколько стадий превращается в глутатион, который способен присоединять следующую молекулу аминокислоты. Химическиепревращения аминокислот Различают 3 типа реакций аминокислот в организме: по карбоксильной группе, α-аминогруппе и радикалу. 1. Декарбоксилирование При декарбоксилировании аминокислот образуются первичные амины. В эту реакцию вступают все аминокислоты; образующиеся амины далее превращаются под действием моноаминооксидазы или диаминоксидазы. Реакции декарбоксилирования в отличие от других процессов промежуточного обмена аминокислот являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, в них простетические группы представлены пиридоксальфосфатом (ПФ), как и у аминотрансфераз. Р  аспад некоторых кислот (гистидина, тирозина, глютаминовой кислоты) приводит к образованию биогенных аминов, которые даже в малых концентрациях обладают большой биологической активностью. Например, гистамин, образовавшийся при декарбоксилировании гистидина, снижает кровяное давление, усиливает деятельность желез внутренней секреции. аспад некоторых кислот (гистидина, тирозина, глютаминовой кислоты) приводит к образованию биогенных аминов, которые даже в малых концентрациях обладают большой биологической активностью. Например, гистамин, образовавшийся при декарбоксилировании гистидина, снижает кровяное давление, усиливает деятельность желез внутренней секреции.гистидин гистамин Продукты распада тирозина и триптофана - тирамин и серотонин - обладают сосудосуживающим действием, серотонин возбуждает ЦНС. В клинической практике широко используется продукт α-декарбоксилирования глутаминовой кислоты – γ-аминомасляная кислота (ГАМК) - ингибитор активности нервных клеток. Фермент, катализирующий эту реакцию (глутаматдекарбоксилаза), является высокоспецифичным: 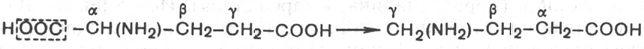 глутаминовая кислота ГАМК Большая концентрация биогенных аминов представляет угрозу для нормального протекания обмена веществ, поэтому декарбоксилирование протекает с низкой скоростью. Биогенные амины распадаются с образованием аммиака и альдегидов. 2. Дезаминирование Во всех реакциях дезаминирования происходит отщепление аминогруппы и высвобождение её в виде аммиака. Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Различают 4 типа дезаминирования аминокислот:
Для животных тканей, растений и большинства аэробных микроорганизмов преобладающим типом реакций является окислительное дезаминирование аминокислот, за исключением гистидина, подвергающегося внутримолекулярному дезаминированию. При окислительном дезаминировании аминокислот образуются соответствующие кетокислоты. NAD, FAD или FMN выполняют роль акцептора водорода. В этой реакции принимают участие оксидазы аминокислот и дегидрогеназы. Окислительное дезаминирование идет в две стадии: 1. Кислота подвергается окислению с образованием иминокислоты и восстановленного кофермента. 2. На второй стадии кофермент передает водород по дыхательной цепи, образуется вода и высвобождается энергия. Иминокислота самопроизвольно гидролизуется. 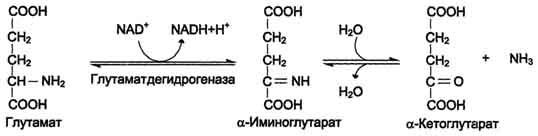 3. Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота. Константа равновесия для большинства таких реакций близка к единице (Кр1,0), поэтому процесс трансаминирования легко обратим. Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) - производное витамина В6 (пиридоксина). Вступать в реакции трансаминирования могут почти все аминокислоты, за исключением лизина, треонина и пролина. 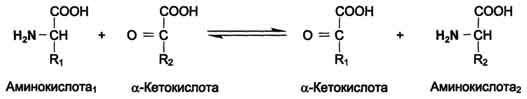 Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартат и соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат. Суммарно эти реакции можно представить в виде схемы: 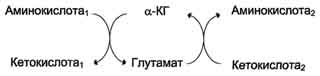 Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2). Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз. Наиболее распространёнными ферментами в большинстве тканей млекопитающих являются аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (ACT). АЛТ (АлАТ) катализирует реакцию трансаминирования между аланином и α-кетоглутаратом. 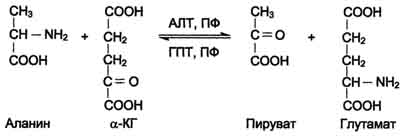 ACT (АсАТ) катализирует реакцию трансаминирования между аспартатом и α-кетоглутаратом аналогично предыдущей. В результате образуются оксалоацетат и глутамат. Наибольшее количество АСТ и АЛТ обнаружено в клетках сердечной мышцы и печени. 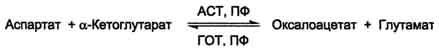 Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование - заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется. Органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3–5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке крови резко повышается (в 20–30 раз). При поражениях клеток печени, например при гепатитах, также наблюдается гипертрансаминаземия (за счет преимущественного повышения уровня АлАТ). Повышение уровня трансаминаз в сыворотке крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии. 4. Модификация боковой цепи (радикала) Например, тирозин образуется окислением фенилаланина; метионин превращается в цистеин путем переноса метильной группы; серин превращается в глицин, и наоборот, отщеплением или присоединением активного формила (с участием тетрагидрофолиевой кислоты и пиридоксальфосфата. Биосинтез заменимых аминокислот Реакции переаминирования с кетокислотами представляют новообразование аминокислот, но служат примером вторичного синтеза из предшествующих аминокислот. 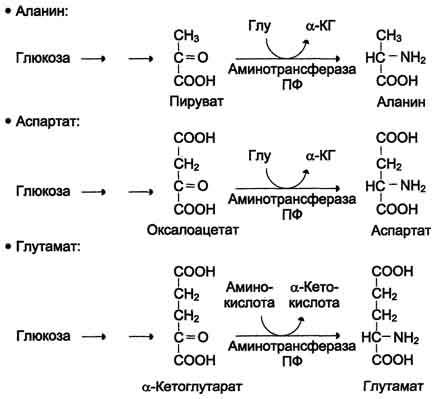 Универсальным донором α-аминогруппы служит глутамат. Первичный синтез аминокислот осуществляется восстановительным аминированием кетокислот – это главный путь новообразования аминокислот. Восстановительное аминирование – это обратная реакция окислительного дезаминирования аминокислот. Первичное усвоение аммиака у всех живых организмов происходит в результате трех основных реакций, приводящих к образованию: 1. глутаминовой кислоты, 2. глутамина, 3. карбамоилфосфата. Карбомоилфосфат используется только для синтеза пиримидинов и аргинина, а глутамат и глутамин прямо или косвенно являются источниками всех атомов азота, входящих в состав аминокислот. Глутамат образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой: a-кетоглутарат + NH4+ + НАДН ® глутамат + НАД+ + Н2О Реакция идет при участии фермента - глутаматдегидрогеназы. НООС-СН2-СН2-СО-СООН + NН4+ + НАДН®НООС-СН2-СН2-СН-СООН + НАД+ + Н2О | NH2 Глутамат способен связывать аммиак с образованием глутамина под действием глутаминсинтетазы: НООС-СН2-СН2-СН-СООН + NH3 + AТФ ® НООС-СН2-СН2-СН-СО-NН2 + АДФ + Н3РО4 | | NH2 NH2 Другой кетокислотой, активно подвергающейся восстановительному аминированию, является пировиноградная кислота, превращающаяся в аланин. Среди природных дегидрогеназ аминокислот активность проявляют именно глутамат- и аланиндегидрогеназы, поэтому синтез остальных протеиногенных аминокислот путём восстановительного аминирования практического значения не имеет. Таким образом выделяют три основные пути биосинтеза аминокислот: 1. Прямое аминирование кетокислот или непредельных кислот. 2. Реакции трансаминирования аминокислот и a-кетокислот. 3. Ферментативные превращения аминокислот: аргинин ® орнитин глутамат ® пролин серин ® глицин фенилаланин ® тирозин. Частично заменимые аминокислоты аргинин и гистидин синтезируются сложным путём в небольших количествах. Большая их часть должна поступать с пищей. Синтез аргинина происходит в реакциях орнитинового цикла. Гистидин синтезируется из АТФ и рибозы. Для синтеза условно заменимых аминокислот тирозина и цистеина требуются незаменимые аминокислоты фенилаланин и метионин соответственно. Аминокислоты, не использованные клетками, подвергаются распаду до конечных продуктов обмена. ОСНОВНЫЕ ПУТИ СВЯЗЫВАНИЯ АММИАКА. ОРНИТИНОВЫЙ ЦИКЛ Физиологическое действие аммиака Катаболизм аминокислот в тканях происходит постоянно со скоростью ∼100 г/сут. При этом в результате дезаминирования аминокислот освобождается большое количество аммиака. Значительно меньшие количества его образуются при дезаминировании биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков в кишечнике) и поступает в кровь воротной вены. Концентрация аммиака в крови воротной вены существенно больше, чем в общем кровотоке. В печени задерживается большое количество аммиака, что поддерживает низкое содержание его в крови. В крови и цитозоле клеток при физиологических значениях рН аммиак переходит в ион аммония - NH4+, количество неионизированного NH3 невелико ( 1%). Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом. Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем: - угнетение обмена аминокислот (реакции трансаминирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.), нарушение проведения нервных импульсов; - гипоэнергетическое состояние; гипоксия тканей. Связывание (обезвреживание) аммиака Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций. Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы. Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров и других соединений. 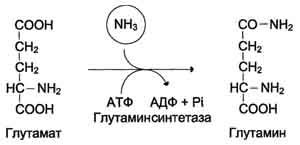 Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы. 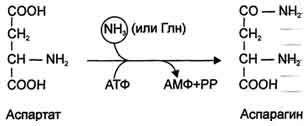 Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина. В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования. Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там опять окисляется до пирувата Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл: 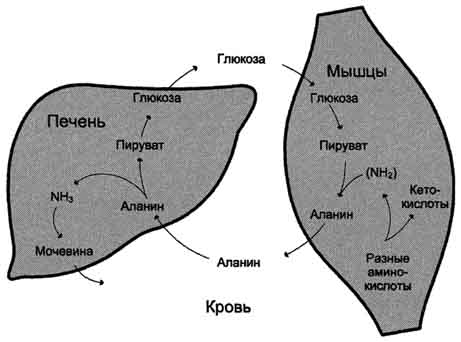 Доминирующими ферментами в обмене аммиака служат глутаматдегидрогеназа и глутаминсинтетаза. Орнитиновый цикл Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 моль АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины. Мочевина - основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. Экскреция мочевины в норме составляет ∼25 г/сут. При повышении количества потребляемых с пищей белков экскреция мочевины увеличивается. Мочевина синтезируется только в печени, что было установлено ещё в опытах И.Д. Павлова. Поражение печени и нарушение синтеза мочевины приводят к повышению содержания в крови и тканях аммиака и аминокислот (в первую очередь, глутамина и аланина). В 40-х годах XX века немецкие биохимики Г. Кребс и К. Гензелейт установили, что синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого, замыкающим цикл, является орнитин. Поэтому процесс синтеза мочевины получил название "орнитиновый цикл", или "цикл Кребса-Гензелейта". 1. Реакции синтеза мочевины Мочевина (карбамид) - полный амид угольной кислоты: Мочевина содержит 2 атома азота. Источником одного из них является аммиак, который в печени связывается с диоксидом углерода с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы: 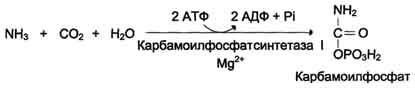 Далее под действием орнитинкарбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на α-аминокислоту орнитин, и образуется другая α-аминокислота - цитруллин. 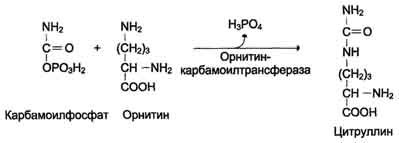 В следующей реакции аргининосукцинатсинтетаза связывает цитруллин с аспартатом и образует аргининосукцинат (аргининоянтарную кислоту). Аспартат - источник второго атома азота мочевины . 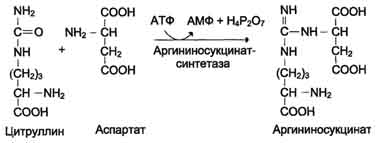 Далее фермент аргининосукцинатлиаза (аргининосукциназа) расщепляет аргининосукцинат на аргинин и фумарат, при этом аминогруппа аспартата оказывается в молекуле аргинина. 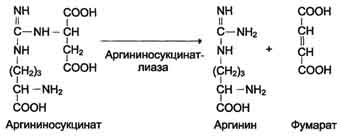 Аргинин подвергается гидролизу под действием аргиназы, при этом образуются орнитин и мочевина. Высокие концентрации орнитина и лизина, являющихся структурными аналогами аргинина, подавляют активность этого фермента: 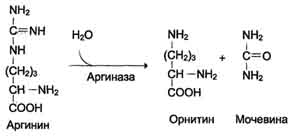 Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается. Первые две реакции процесса происходят в митохондриях гепатоцитов. Затем цитруллин, являющийся продуктом этих реакций, транспортируется в цитозоль, где и осуществляются дальнейшие превращения. Полный набор ферментов орнитинового цикла есть только в гепатоцитах. Отдельные же ферменты орнитинового цикла обнаруживаются не только в печени, но и в других клетках. Суммарное уравнение синтеза мочевины: СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04) + АМФ + H4P2O7. Энергетический баланс процесса: в реакциях орнитинового цикла расходуются четыре макроэргических связи трёх молекул АТФ на каждый оборот цикла. Однако процесс превращения аминокислот в безазотистые остатки и мочевину имеет пути компенсации энергозатрат с участием его метаболитов. Биологическая роль орнитинового цикла Кребса-Гензелейта Орнитиновый цикл выполняет 2 основные функции: превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов, главным образом аммиака; синтез аргинина и пополнение его фонда в организме. Регуляторные стадии процесса - синтез карбамоилфосфата, синтез цитруллина и заключительная стадия, катализируемая аргиназой. Эффективность работы орнитинового цикла при нормальном питании человека и умеренных физических нагрузках составляет примерно 60% его мощности. Запас мощности необходим для избежания гипераммониемии при изменениях количества белка в пище. Увеличение скорости синтеза мочевины происходит при длительной физической работе или длительном голодании, которое сопровождается распадом тканевых белков. Некоторые патологические состояния, характеризующиеся интенсивным распадом белков тканей (сахарный диабет и др.), также сопровождаются активацией орнитинового цикла. При избыточном белковом питании количество ферментов орнитинового цикла в печени увеличивается, что приводит к интенсификации синтеза мочевины. Все нарушения орнитинового цикла приводят к значительному повышению в крови концентрации аммиака, глутамина и аланина. | ||||||||||||||||