патфиз устно (1). Общая патофизиология патофізіологія як наука та навчальна дисципліна. Методи патофізіології
 Скачать 1.44 Mb. Скачать 1.44 Mb.
|
|
16.43. Какие факторы организма влияют на развитие злокачественных опухолей? Развитие опухоли определяется не только свойствами самих опухолевых клеток, но и влиянием организма на этот процесс. Наибольшее значение имеют: а) васкулярилзация опухоли. Показано, что максимальная удаленность опухолевых клеток от просвета кровеносных сосудов не может быть больше 1-2 мм. Если расстояние превышает эту величину, клетки опухоли погибают. В злокачественную опухоль, как правило, интенсивно прорастают кровеносные сосуды. Это связано с тем, что опухолевые клетки высвобождают так называемый ангиогенетичний фактор (ангиогенин), что стимулирует рост капилляров и размножения эндотелиальных клеток; б) гормоны. Хотя опухолевый процесс является автономным, существуют, однако, опухоли, которые проявляют высокую чувствительность к гормонам. Это, в частности, рак молочной железы, матки, яичников, предстательной железы. Одни гормоны усиливают рост указанных опухолей, другие, наоборот, тормозят; в) состояние механизмов противоопухолевой защиты организма. 16.44. Какие механизмы противоопухолевой защиты существуют в организме? Иммунная защита. Далеко не всякий возникший в организме клон опухолевых клеток превращается в злокачественную опухоль. Организм располагает определенными, хотя и ограниченными, средствами противодействия. На первых этапах действует система так называемой естественной неспецифической резистентности, способная элиминировать небольшое количество (от 1 до 1000) опухолевых клеток. К ней относятся естественные киллеры — крупные гранулярные лимфоциты, составляющие от 1 до 2,5 % от всей популяции периферических лимфоцитов, и макрофаги. Специфический противоопухолевый иммунитет обычно развивается слишком поздно и не очень активен. Спонтанные опухоли животных и человека слабоантигенны и легко преодолевают этот барьер. Однако в некоторых случаях он, по-видимому, способен играть существенную роль. Паранеопластический синдром - проявление генерализованного воздействия опухоли на организм. Его формы разнообразны — состояние иммунодепрессии (повышенная подверженность инфекционным заболеваниям), тенденция к повышению свертываемости крови, сердечнососудистая недостаточность, мышечная дистрофия, некоторые редкие дерматозы, пониженная толерантность к глюкозе, острая гипогликемия при опухолях больших размеров и другие. Одним из проявлений паранеопластического синдрома является так называемая раковая кахексия (общее истощение организма), которая возникает в периоде, близком к терминальному, и часто наблюдается при раке желудка, поджелудочной железы и печени Она характеризуется потерей массы тела, в основном из-за усиленного распада белков скелетных мышц (частично миокарда, а также истощения жировых депо, сопровождается отвращением к пище (анорексией) и изменением вкусовых ощущений. Одна из причин кахексии — повышенный (иногда на 20—50 %) расход энергии, обусловленный по- видимому, гормональным дисбалансом. Механизмы противоопухолевой резистентности могут быть условно разделены по этапу и фактору канцерогенеза на три основных обобщенных вида: 1. Антиканцерогенные, адресованные этапу взаимодействия канцерогенного (причинного) фактора с клетками, органеллами, макромолекулами. 2. Антитрансформационные, адресованные этапу трансформации нормальной клетки в опухолевую и тормозящие его. 3. Антицеллюлярные, адресованные этапу превращения образования отдельных опухолевых клеток в клеточную колонию - опухоль. Антиканцерогенные механизмы представлены тремя группами. К 1-ой группе относятся атиканцерогенные механизмы, действующие против химических канцерогенных факторов: 1. Реакции инактивации канцерогенов: а) окисление с помощью неспецифических оксидаз микросом, например полициклических углеводородов; б) восстановление с помощью редуктаз микросом, например аминоазокрасителей - диметиламиноазобензола, о-аминоазотолуола; в) диметилирование — ферментативное или неферментативное; г) коньюгация с глюкуроновой или серной кислотой с помощью ферментов (глюкуронидазы сульфатазы); 2. Элиминация эзо- и эндогенных канцерогенных агентов из организма в составе желчи, кала, мочи; 3. Пиноцитоз и фагоцитоз канцерогенных агентов, сопровождающиеся их обезвреживанием; 4. Образование антител против кацерогенов как гаптенов; 5. Ингибирование свободных радикалов антиоксидантами. Ко 2-ой группе относятся антиканцерогенные механизмы, действующие против биологических этиологических факторов - онкогенных вирусов: 1. Ингибирование онкогенных вирусов интерферонами; 2. Нейтрализация онкогенных вирусов специфическими антителами. Третья группа антиканцерогенных механизмов представлена механизмами, действующими против физических канцерогенных факторов - ионизирующих излучений. Основными среди них являются реакции торможения образования и инактивации свободных радикалов (антирадикальные реакции) и перекисей - липидных и водорода (антиперекисные реакции), являющиеся, по-видимому, «медиаторами», через которые ионизирующие излучения, по крайней мере, отчасти, реализуют свое опухолеродное влияние. Антирадикальные и антиперекисные реакции обеспечиваются витамином Е, се- леном, глутатион-дисульфидной системой (состоящей из восстановленного и окисленного глютатиона), глутатионпероксидазой (расщепляющей перекиси липидов и водорода), супероксиддисмутазой, которая инактивирует супероксидный анион-радикал, каталазой, расщепляющей перекись водорода. Антитрансформационные механизмы За счет этих механизмов происходит ингибирование трансформации нормальной клетки в опухолевую. К ним относятся: 1. Антимутационные механизмы, являющиеся функцией клеточных ферментных систем репарации ДНК, устраняющие повреждения, «ошибки» ДНК (генов) и поддерживающие благодаря этому генный гомеостаз;2. Антионкогенные механизмы, являющиеся функцией специальных клеточных генов - антагонистов онкогенов и поэтому названные антионкогенами. Действие их сводится к подавлению размножения клеток и стимуляции их дифференцировки. О наличии антионкогенов в нормальных клетках свидетельсвуют опыты группы Э. Стан- бридж и сотрудников. Они ввели в нормальную хромосому (11-я пара из клетки человека) в клетку опухоли Вильямса. В результате опухолевые клетки подверглись трансформации в нормальные клетки. В качестве косвенного аргумента в пользу антионкогенов называют отсутствие такого гена (так называемого Rb-гена) в 13-ой паре хромосом в клетках ретинобластомы и в их нормальных предшественниках - клетках сетчатки. Антицеллюлярные механизмы Эти механизмы включаются с момента образования первых бластомных клеток. Они направлены на ингибирование и уничтожение отдельных опухолевых клеток и опухолей в целом. Факторами, включающими антицеллюлярные противоопухолевые механизмы, являются антигенная и «клеточная» чужеродность опухолей. Выделяют две группы антицеллюлярных механизмов: иммуногенные и неиммуногенные 1. Иммуногенные антицеллюлярные механизмы являются функциями иммунной системы, осуществляющей так называемый иммунный надзор за постоянством антигенного состава тканей и органов организма. Они делятся на специфические и неспецифические. К специфическим иммуногенным механизмам относятся цитотоксическое действие, ингибирование роста и уничтожение опухолевых клеток: а) иммунными Т-лимфоцитами- киллерами; б) иммуными макрофагами с помощью секрктируемых ими факторами: макрофаг-лизина, лизосомальных ферментов, факторов комплемента, ростингибирующего компонента интерферона, фактора некроза опухолей; в) К-лимфоцитами, обладающими Fc-рецепторами к иммуноглобулинам и благодаря этому проявляющими сродство и цитотоксичность к опухолевым клеткам, которые покрыты IgG. Неспецифические иммуногенные механизмы. К ним относятся неспецифическое цитотоксическое действие, ингибирование и лизис опухолевых клеток: а) натуральными киллерами (НК- клетками), являющимися, как и К-лимфоциты, разновидностью лимфоцитов, лишенных характерных маркеров Т- и В-лимоцитов; б) неспецифически активированными (например под влиянием митогенов, ФГА и др.); в) неспецифически активированными макрофагами (например, под влиянием БЦЖ или бактерий, эндотоксинами, особенно липополисахаридами из гамотрицательных микроорганизмов) с помощью секретируемых ими фактора некроза опухолей (ФНО), интерлейкина-1, интерферона и др.; д) «перекрестными» антителами. 2. Неиммуногенные антицеллюлярные факторы и механизмы. К ним относят: 1) фактор некроза опухолей, 2) аллогенное торможение, 3) интерлейкин-1, 4) кейлонное ингибирование, 5) канцеролиз, индуцированный липопротеидами, 6) контактное торможение, 7) лаброцитоз, 8) регулирующее влияние гормонов. Фактор некроза опухолей. Продуцируется моноцитами, тканевыми макрофагами, Т- и В-лимфоцитами, гранулоцитами, тучными клетками. Вызывает деструкцию и гибель опухолевых клеток. Интерлекин -1 (ИЛ-1). Механизм антибластомного действия ИЛ-1 связан со стимуляцией К-лимфоцитов, Т-лимфоцитов-киллеров, синтезом ИЛ-2, который в свою очередь стимулирует размножение и рост Т-лимфоцитов (включая Т-киллеры), активацией макрофагов, образованием у-интерферона и, возможно, отчасти посредством пирогенного действия. Аллогенное торможение. Применительно к опухолевым клеткам это подавление жизнедеятельности и уничтожение их окружающими нормальными клетками. Предполагают, что аллогенное торможение обусловлено цитотоксическим действием антигенов гистонесовместимых метаболитов и различием поверхности мембран.Кейлонное ингибирование. Кейлоны — это тканеспецифические ингибиторы размножения клеток, в том числе и опухолевых. Канцеролиз, индуцированный липопротеидами. Канцеролиз - это растворение опухолевых клеток. Фракция щ -липопротеидов оказывает специфическое онколитическое действие. На ауто-, гомо- и гетерологические нормальные клетки эта фракция не оказывает литического влияния. Контактное торможение. Полагают, что в реализации феномена контактного торможения принимают участие циклические нуклеотиды - циклический аденозин-3, 5- монофосфат (цАМФ) и циклический гуанозин-3,5-монофосфат (цГМФ). Увеличение концентрации цАМФ активирует контактное торможение. Напротив, цГМФ тормозит контактное торможение и стимулирует деление клеток. Лаброцитоз. Кацерогенез сопровождается увеличением числа лабро-цитов (тучных клеток), продуцирующих гепарин, который ингибирует образование фибрина на поверхности клеток опухоли (фиксированных и циркулирующих в крови). Это препятствует развитию метастазов, благодаря торможению превращения ракового клеточного эмбола в клеточный - тромбо-эмбол. Регулирующее влияние гормонов. Гормоны оказывают регулирующее влияние на антибластомную резистентность организма. Характерной особенностью этого влияния является его многообразие, зависящее от дозы гормона и вида опухоли. Возникает вопрос: почему, несмотря на столь мощные антицеллюлярные механизмы, направленные против опухолевой клетки, последняя нередко сохраняется и превращается в бластому? Происходит это потому, что причины, вызывающие опухоли, одновременно (задолго до развития опухоли) обусловливают иммунодепрессию. Возникшая опухоль, в свою очередь, сама потенцирует иммунодепрессию. Следует отметить, что иммунодепрессия, возникшая вне связи с действием канцерогенов, например наследственная Т-иммунная недостаточность (при синдроме Вискотта-Олдрича и др.), а также приобретенная (используемая при пересадке органов или развивающаяся при пересадке органов или развивающаяся при лечении цитостатиками) резко увеличивает риск возникновения опухоли. Так, иммунодепрессия при пересадке органов увеличивает риск развития опухоли в 50-100 раз. Препятствует уничтожению и, напротив, способствует сохранению опухолевых клеток и ряд других феноменов: антигенное упрощение; реверсия антигенов - появление эмбриональных белков-антигенов, к которым в организме имеется врожденная толерантность; появление особых антител, защищающих опухолевые клетки от Т-лимфоцитов и названных «блокирующими» антителами. 16.45. Назовите основные патогенетические подходы к лечению опухолей. 1. Хирургическое удаление. 2. Лучевая терапия (использование радиоактивного облучения). 3. Химиотерапия. 4. Иммунотерапия. 5. Повышение неспецифической резистентности (например, введение БЦЖ). 59. Визначення поняття та принципи класифікації гіпоксії. Механізми розвитку гіпоксії: зменшення постачання і порушення утилізації кисню клітинами. Етіологія основних типів гіпоксії: гіпоксичної, респіраторної, циркуляторної, гемічної, тканинної, субстратної, перевантажувальної, змішаної. Зміна газового складу артеріальної та венозної крові при різних типах гіпоксії. Негайні і довготривалі механізми пристосування і адаптації до гіпоксії. Стійкість до гіпоксії. Фактори, які її забезпечують. Механізми лікувально-профілактичної дії дозованих гіпоксичних тренувань. 19.1. Дайте определение понятия "гипоксия". Гипоксия (кислородное голодание) - это типовой патологический процесс, возникающий в результате недостаточного снабжения тканей кислородом или в результате нарушения его использования клетками. " 19.2. Как классифицируют кислородное голодание? I. Этиологическая классификация: а) гипоксическая (экзогенная) б) дыхательная (респираторная) в) сердечно-сосудистая (циркуляторная) г) кровяная (гемическая) г) тканевая (гистотоксической) гипоксия. II. По темпам развития и продолжительности выделяют: а) молниеносную; б) острую; в) подострую; г) хроническую гипоксию Нет. В зависимости от распространенности процесса гипоксия может быть общей и местной. 19.3. В каких биохимических процессах, происходящих в организме, используется кислород? I. Тканевое (клеточное) дыхание. Осуществляется в митохондриях клеток с участием дегидрогеназ и других компонентов дыхательной цепи, обеспечивающие транспорт электронов от субстрата на кислород. Основная функция клеточного дыхания - высвобождение энергии питательных веществ и аккумулирования ее в макроэргических связях АТФ (окислительное фосфорилирования). На эти процессы клетками используется не менее 90% кислорода, поглощается. II. Микросомальное окисления. Осуществляется в эндоплазматическом ретикулуме клеток. Особенно интенсивно проходит в печени и некоторых эндокринных железах (надпочечников, половых). Катализаторами микросомального окисления являются ферменты оксигеназы, которые присоединяют кислород непосредственно к субстрату. В зависимости от количества атомов кислорода, который присоединяется, различают монооксигеназы и диоксигеназы.Первые обеспечивают реакции гидроксилирования (образование стероидных гормонов, преобразования пролина в оксипролина), вторые - реакции детоксикации в печени. III. Пероксидгенеруючи реакции. Осуществляются в пероксисомах, а также в гранулах нейтрофилов и макрофагов. их катализаторами являются ферменты оксидазы, что обеспе- щих образования пдропероксидш целого ряда соединений и пероксида водорода. Указанные процессы имеют значение в катаболизме некоторых соединений (аминокислот, пуринов), а в лейкоцитах является одним из механизмов бактерицидности. IV. Перекисное окиснсння липидов (см. Разд. 11). В норме интенсивность этого процесса незначительна. Он существенно активируется при повреждении клеток. 19.4. Какие механизмы могут лежать в основе уменьшения напряжения кислорода в тканях? 1. Уменьшение доставки кислорода кровью. 2. Нарушение диффузии кислорода от кровеносных капилляров в клетки. 3. Усиленное использование кислорода клетками. 19.5. Назовите причины уменьшения доставки кислорода кровью. где С - содержание кислорода в артериальной крови Q - объемная скорость течения крови. Причинами нарушения доставки кислорода кровью могут быть: а) уменьшение содержания кислорода в артериальной крови б) уменьшение объемной скорости кровотока в ткани (нарушение кровоснабжения) в) уменьшение отдачи кислорода гемоглобином (уменьшение диссоциации оксигемоглобина). 19.6. Чем может быть обусловлено уменьшение содержания кислорода в артериальной крови? где - С к - содержание кислорода в артериальной крови [НЬ] - концентрация гемоглобина в крови S - насыщение гемоглобина кислородом; 1,34 - число Хюфнер. Причиной уменьшения содержания кислорода в артериальной крови могут быть: а) уменьшение концентрации гемоглобина, способного связывать кислород (уменьшение кислородной емкости крови). Это может быть обусловлено либо анемией (уменьшается общее содержание гемоглобина), или инактивацией гемоглобина; б) уменьшение насыщения гемоглобина кислородом. Закономерно возникает при уменьшении напряжения кислорода в артериальной крови ниже 60 мм рт. ст. 19.7. Изменения могут уменьшать объемную скорость тока крови в тканях и приводить к гипоксии? поскольку где Q - объемная скорость течения крови Р а - артериальное давление в начале, а Р ВСН - венозное давление в конце перфузируемой участка; (Р т - Р) перфузионное давление; R - гемодинамический сопротивление, то уменьшение кровоснабжения тканей может быть обусловлено такими группами причин. И. Уменьшение перфузионного давления в сосудах органа или ткани: а) снижение артериального давления; б) увеличение венозного давления. IJ. Увеличение гемодинамического сопротивления сосудов данного участка: а) сужение сосудов; б) повышение вязкости крови. 19.8. Какие факторы вызывают смещение кривой диссоциации оксигемоглобина? Кривая диссоциации оксигемоглобина отображает зависимость между напряжением кислорода в артериальной крови и насыщением гемоглобина кислородом (рис. 61). 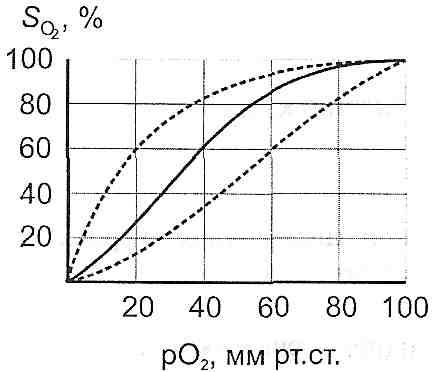 Рис. 61. Кривая диссоциации оксигемоглобина Смещение этой кривой влево происходит при: а) снижении температуры; б) алкалозе; в) гипокапнии; г) уменьшении в эритроцитах содержания 2,3-дифос- -фоглицерату; г) отравлениях оксидом углерода (II) д) появление наследственно обусловленных патологических форм гемоглобина, не отдают кислород тканям. При смещении кривой влево гемоглобин легче присоединяет кислород в капиллярах легких, но хуже отдает его тканям. Причиной смещения кривой диссоциации оксигемоглобина вправо могут быть: а) повышение температуры; б) ацидоз в) гиперкапния; г) увеличение содержания в эритроцитах 2,3-дифосфоглицерата. Влияние ацидоза и гиперкапнии на диссоциацию оксигемоглобина известный как эффект Бора. При смещении кривой вправо гемоглобин хуже присоединяет кислород в капиллярах легких, но лучше отдает его тканям. С этим, в частности, связано защитно-компенсаторное значение эффекта Бора при кислородном голодании. 19.9. Какие факторы обусловливают нарушения диффузии кислорода в тканях? Согласно закону Фика где m - количество газа, диффундирует (диффузный поток) k - коэффициент диффузии; S - общая площадь поверхности, через которую осуществляется диффузия; 1 - расстояние диффузии; (Pj -Р 2 ) - разность между напряжением В, в капиллярах и клетках. Отсюда следует, что причинами нарушения диффузии кислорода в тканях могут быть: 1) уменьшение коэффициента диффузии кислорода (например, при отложениях в ткани липидов, гиалина, амилоида, солей кальция) 2) уменьшение общей площади поверхности кровеносных капилляров при уменьшении их количества; 3) увеличение диффузионной расстоянии (например, при отеке) 4) уменьшение напряжения кислорода в капиллярах; 5) увеличение напряжения кислорода в клетках. 19.10. Что такое гипоксия нагрузки? Гипоксия нагрузки - это кислородное голодание, возникающее при увеличении функциональной нагрузки. Оно связано с усиленным использованием кислорода клетками. При этом доставка кислорода тканям может даже расти. Если все-таки доставка кислорода не покрывает его усиленного использования клетками, напряжение кислорода в тканях падает и развивается гипоксия. 19.11. Что такое гипоксическая гипоксия? Когда она возникает? Типоксичною (экзогенной) называют гипоксию, причиной которой является уменьшение парциального давления кислорода во вдыхаемом воздухе. Гипоксическая гипоксия может наступать при: а) снижении атмосферного давления (при подъеме на высоту в горы) 6) уменьшении содержания кислорода во вдыхаемом воздухе (работа в шахтах, неисправность систем кислородного обеспечения в летательных аппаратах, на подводных лодках, в скафандрах). 19.12. Назовите патогенетические факторы развития горной болезни. Горная болезнь возникает при подъеме неадаптированного организма в горы. Она является примером подострой и хронической гипоксии. Ведущее значение в патогенезе горной болезни имеет уменьшение парциального давления кислорода во вдыхаемом воздухе (гипоксическая гипоксия). Кроме того, при подъеме в горы патогенное действие оказывают и другие факторы, в частности, уменьшение собственно атмосферного давления (синдром декомпрессии), солнечная радиация, снижение температуры внешней среды, сухость вдыхаемого воздуха, увеличение физической нагрузки. 19.13. Какие зоны выделяют при подъеме в горы с учетом признаков гипоксии, развивается? I. Нейтральная зона (высота от 0 до 2000 м над уровнем моря). Функции организма не страдают. II. Зона полной компенсации (высота от 2000 до 4000 м над уровнем моря). Отмечается увеличение частоты пульса, дыхания, повышение артериального давления. В то же время уменьшается физическая и умственная работоспособность, развивается эйфория, нарушается тонкая координация движений, ослабляется внимание. III. Зона неполной компенсации (высота от 4000 до 6000 м над уровнем моря). Развиваются тяжелые, но обратимые изменения. Тахикардия сменяется брадикардией, падает артериальное давление, дыхание становится частым и поверхностным, иногда развивается дыхание Чейна-Стокса, характерные сонливость, вялость, тошнота. IV. Критическая зона (свыше 7000 м над уровнем моря). Развиваются необратимые изменения. Артериальное давление падает до 0, пульс становится нитевидным, появляется терминальное дыхание, человек теряет сознание, развиваются судороги и наступает смерть. 19.14. Что такое высотная болезнь? Высотная болезнь - это острая или молниеносная форма гипоксической гипоксии, возникающей во время высотных полетов в летательных аппаратах с кабинами открытого типа или при нарушении герметичности кабин закрытого типа. 19.15. Изменения показателей газового состояния крови характерны для гипоксической гипоксии? Уменьшение р0 2 и РС0 2 артериальной крови, развитие газового алкалоза. 19.16. Что такое дыхательная гипоксия? Дыхательная гипоксия - это кислородное голодание, причиной которого является недостаточность внешнего дыхания. Причины ее развития см. разд. 29. 19.17. Изменения показателей газового состояния крови характерны для дыхательной гипоксии? Уменьшение р0 2 и увеличение РС0 2 артериальной крови, развитие газового ацидоза .: 19.18. Что такое циркуляторная гипоксия? Циркуляторная гипоксия - это кислородное голодание, причиной которого является расстройства общей гемодинамики или нарушения местного кровообращения. В основе нарушений системного кровообращения могут лежать недостаточность сердца и недостаточность сосудов (шок, коллапс). К местной гипоксии приводят ишемия, тромбоз, эмболия, венозная гиперемия. В зависимости от механизмов развития некоторые авторы выделяют две формы циркуляционный насос-ной гипоксии: ишемическойи застойную. 19.19. Изменения показателей газового состояния крови характерны для циркуляторной гипоксии? Увеличение артериовенозной разницы по кислороду за счет полного исключения его из артериальной крови. 19.20. Что такое кровяная (гемическая) гипоксия? Назовите ее виды. Кровь 'яна (гемическая) гипоксия - это кислородное голодание, возникающее вследствие уменьшения кислородной емкости крови. Выделяют две формы кровяной гипоксии: а) анемическую - возникает как следствие анемии (см. разд. 26); б) гипоксию, связанную с инактивацией гемоглобина. 19.21. Назовите формы инактивированного гемоглобина. 1. Карбоксигемоглобин - продукт взаимодействия гемоглобина с оксидом углерода (II) (угарным газом, CO). 2. Метгемоглобин - гемоглобин, в котором железо находится в окисленном, трехвалентного состоянии. 3. Сульфгемоглобин - соединение гемоглобина с сероводородом. 19.22. Какие механизмы обусловливают развитие нарушений в организме при отравлении оксидом углерода ( II )? В патогенезе нарушений, вызываемых оксидом углерода (II), имеют значение такие факторы: | < - * • а) инактивация гемоглобина, уменьшает кислородную емкость крови, - развивается кровь "яна гипоксия; б) смещение кривой диссоциации оксигемоглобина влево - даже то гемоглобин, который не испытал инактивации, плохо отдает кислород тканям; в) связывания оксида углерода (II) с железом других белков, содержащих в себе гем, в частности цитохрома - развивается тканевая гипоксия. 19.23. Какие факторы могут быть причиной образования метгемоглобина, а следовательно и развития кровяной гипоксии? Причины образования метгемоглобина: 1) екзогенниречовшы-окислители (метгемоглобинообразователи). К ним относят: а) нитросоединения (оксид азота (II), нитриты, нитраты) б) аминосоединения (анилин, фенилгидразин) в) окислители (хлораты, перманганат, хиноны) г) окислительно-восстановительные красители (метиленовый синий в высоких концентрациях) д) лекарственные препараты (нитроглицерин, амилнитрит, сульфаниламиды, барбитураты) 2) недостаточность антиоксидантных систем эритроцитов, восстанавливающие метгемоглобин. Это наблюдается при нарушениях пентозного цикла и глютатион-редуктазы. Описаны генетически обусловленный дефект фермента - НАДФ-зависимой метгемоглобинредуктазы. 19.24. Изменения показателей газового состояния крови характерны для кровь "яной гипоксии? Уменьшение кислородной емкости крови. 19.25. Что такое тканевая гипоксия? Тканевая гипоксия - это кислородное голодание, возникающее в результате нарушения утилизации кислорода клетками. В ее основе лежат два типа нарушений: а) угнетение биологического окисления; б) разъединение окисления и фосфорилирования (см. разд. 17). 19.26. Изменения показателей газового состояния крови характерны для тканевой гипоксии? Уменьшение артериовенозной разницы по кислороду и увеличение рО, венозной крови. 19.27. Дайте сравнительную характеристику основных показателей газового состояния крови при различных видах гипоксии. 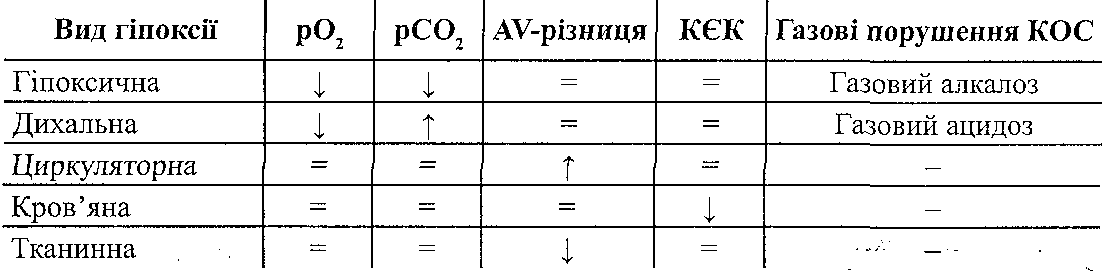 р0 2 - напряжение кислорода в артериальной крови РС0 2 - напряжение углекислого газа в артериальной крови AV-разница - артериовенозная разница по кислороду; КЕК - кислородная емкость крови КОС - кислотно-основное состояние. 19.28. На какие группы можно разделить все защитно-компенсаторные реакции, возникающие при гипоксии? I. Реакции, направленные на увеличение доставки кислорода кровью. II. Местные (тканевые) реакции, направленные на улучшение обеспечения клеток кислородом. III. Реакции в системах утилизации кислорода. 19.29. Назовите защитно-компенсаторные реакции организма, направленные на увеличение доставки кислорода тканям. 1. Реакции внешнего дыхания. Направленные на увеличение р0 2 артериальной крови, поэтому могут быть эффективными только при гипоксической и дыхательной гипоксии. Они проявляют себя: а) увеличением глубины дыхания; б) увеличением частоты дыхания; в) мобилизацией резервных альвеол. Комплекс указанных изменений получил название гипервенпгиляции. 2. Реакции системы кровообращения. Направленные на увеличение кровоснабжения тканей и эффективны при всех видах гипоксии, кроме тканевой. К этим реакциям относятся: а) увеличение минутного объема крови за счет увеличения силы и частоты сердечных сокращений б) повышение артериального давления; в) перераспределение кровотока - уменьшение кровообращения в коже, скелетных мышцах, органах брюшной полости и увеличение - в сердце и головном мозге. 3. Реакции системы крови. Направленные на увеличение кислородной емкости крови и проявляют себя увеличением количества эритроцитов и концентрации гемоглобина в периферической крови. Это достигается за счет: а) выхода дополнительного количества эритроцитов из депо; б) активации эритропоэза (при гипоксии усиливается образование почечных эры-тропоетинив). Кроме того, защитное значение имеет смещение кривой диссоциации оксигемоглобина вправо - эффект Бора (см. Запрос. 19.8). 19.30. Нежелательные последствия может иметь гипервентиляция при гипоксической гипоксии? Гипервентиляция, возникающая, ведет к уменьшению РС0 2 артериальной крови - гипо- капнии. Это имеет ряд негативных последствий: а) происходит угнетение дыхательного центра; б) развивается газовый алкалоз; в) наступает спазм мозговых и коронарных сосудов; г) кривая диссоциации оксигемоглобина смещается влево - кровь плохо отдает кислород тканям. 19.31. Назовите местные (тканевые) реакции, направленные на улучшение обеспечения клеток кислородом в условиях гипоксии. 1. Усиление местного кровообращения - артериальная гиперемия. Развивается как следствие непосредственного влияния уменьшения р0 2 на гладкие мышцы сосудов и действия на сосуды вазо- активных метаболитов (аденозина, молочной кислоты, ионов калия и водорода и др.) 2. Увеличение количества капилляров, которые функционируют. В результате уменьшается расстояние диффузии кислорода и увеличивается общая площадь диффузионной поверхности. 3. Повышение содержания в клетках миоглобина, который в мышцах является внутриклеточным депо кислорода. 19.32. Назовите защитно-компенсаторные реакции в системах утилизации кислорода при гипоксии. 1. Снижение функциональной активности клеток, вследствие чего уменьшается их потребность в кислороде. 2. Увеличение количества дыхательных ферментов и митохондрий в клетках. 3. Увеличение родства цитохромоксидазы с кислородом. 4. Повышение степени сопряженности окисления и фосфорилирования в максимально возможной величины, равной 3. 5. Активация гликолиза. 19.33. При каких значениях напряжения кислорода в тканях начинает уменьшаться образования АТФ в клетках? При уменьшении р0 2 в тканях ниже ЗО мм рт. ст. снижается интенсивность потребления кислорода клетками, а следовательно, падает интенсивность образования АТФ. "Критическая" напряжение 0 2 в митохондриях - 0,1-1 мм рт. ст. При уменьшении рО, ниже этой величины цитохромоксидаза не способна передавать электроны на кислород - тканевое дыхание полностью прекращается. 19.34. Какие механизмы составляют основу гипоксического повреждения клеток? И. Гипоксия, вызывая дефицит АТФ в клетках, приводит к нарушению работы ионных насосов. Следствием этого является увеличение концентрации ионов кальция и на- трию в цитоплазме, что начинает кальциевые и электролитно-осмотические механизмы повреждения клетки (см. разд. 11). II. При гипоксии происходит активация анаэробного гликолиза. Это приводит к накоплению молочной кислоты и развитию внутриклеточного ацидоза. Как следствие, включаются ацидотического механизмы повреждения клетки (см. Разд. 11). III. При значительном дефиците кислорода компоненты дыхательной цепи находятся в восстановленном состоянии. Они "сбрасывают" свои электроны непосредственно на молекулы кислорода, оставшегося минуя дыхательную цепь. Это ведет к одноэлектронных-го восстановления кислорода и образование супероксидных радикалов - активируются реакции свободнорадикального окисления. Результатом является инициация перекисного окисления липидов (ПОЛ) и реализация "липидноитриады" повреждения клеток (см. Разд. 11). 19.35. От каких факторов зависит чувствительность клеток к гипоксии? Существует закономерность: чем выше интенсивность потребления кислорода клетками, тем выше их чувствительность к кислородному голоданию. Поскольку потребление кислорода определяется энергетическими потребностями, а остальные - функциональной активностью клеток, становится понятным, почему мозг, сердце, печень, почки очень чувствительны, а кости, хрящи, сухожилия резистентные к гипоксии. Кроме того, чувствительность к гипоксии зависит от скорости окислительных процессов в организме и от температуры тела. При уменьшении температуры чувствительность тканей к кислородному голоданию падает. Это обстоятельство используют в медицине при проведении длительных операций на сердце (искусственная гипотермия). 7 9.36. Какие периоды характерны для острой гипоксии клеток? I. Латентный период. Длится несколько секунд. Клетки функционируют нормально. II. Период нарушения функций. Продолжается до полного прекращения функций органа, ткани. III. Период оживления. Охватывает время от момента полного прекращения функции до начала развития необратимых структурных изменений. IV. Период необратимого повреждения клеток. Продолжается до гибели клеток. и9.37. Какова динамика изменений в ЦНС при острой гипоксии? Головной мозг является "критическим органом" при острой гипоксии. Это означает, что ги-поксичне повреждения структур ЦНС, развиваясь очень быстро, приводит к смерти организма, несмотря на то, что другие органы и ткани еще некоторое время сохраняют свою жизнеспособность. Латентный период острой гипоксии для ЦНС составляет 4 с. Через 8-12 с. после полного прекращения снабжения головного мозга кислородом функции ЦНС прекращаются и человек теряет сознание. Через 20-30 с. исчезает спонтанная электрическая активность коры головного мозга (на электроэнцефалограмме - изоэлектрическая линия). Предел оживления головного мозга составляет 8-10 мин. В то же время предел оживления организма в целом - 4-5 мин. после остановки сердца. Это объясняется тем, что после возобновления работы сердца необходимо еще 4-5 мин., Чтобы создать артериальное давление, достаточное для кровоснабжения мозга. 60. Поняття про екстремальні стани. Шок: види, клінічні прояви, причини і механізми розвитку. Стадії шоку: компенсована, прогресивна та необоротна. Участь нервових та ендокринних механізмів у розвитку шоку. Порушення загальної гемодинаміки та мікроциркуляції в патогенезі шокових станів. Механізм централізації кровообігу. Роль гормонів та фізіологічно активних речовин і продуктів пошкодження тканин у патогенезі шокових станів. Поняття про «шокові органи». Патофізіологічні основи профілактики і терапії шоку. 12.2. Что такое шок? Шок - это тяжелый патологический процесс, сопровождающийся истощением жизненно важных функций организма и приводит его на грань жизни и смерти из-за критического уменьшения капиллярного кровообращения в пораженных органах. 12.3. Назовите основные виды шока. В зависимости от причин возникновения выделяют следующие виды шока: травматический, геморрагический (см. Разд. 26), ожоговый (см. Разд. 5), турникетный (развивается после снятия жгута через 4:00 и более после его наложения), ангидремичний (см. Разд . 23), кардиогенный (см. разд. 27), панкреатический (см. разд. ЗО), анафилактический (см. разд. 10), септический, инфекционно-токсический и др. В зависимости от первичных механизмов, лежащих в основе патогенеза шока, выделяют: 1) гиповолемический шок (геморрагический, ангидремичний) 2) шок, связанный с нарушениями насосной функции сердца (кардиогенный) 3) сосудистые формы шока (анафилактический, панкреатический) 4) болевой шок, при котором нарушается центральная регуляция кровообращения (травматический, ожоговый). 12.4. Какие механизмы лежат в основе нарушений общей гемодинамики и микроциркуляции при шоке? Независимо от причин возникновения шок проявляется комплексом нарушений гемодинамики, для которого характерны снижение артериального давления, минутного объема сердца, венозного возврата к сердцу, объема циркулирующей крови, объемной скорости органного кровообращения нарушение реологических свойств крови (агрегация форменных элементов, повышение вязкости крови). Комплекс этих нарушений может быть определен как острая недостаточность кровообращения. Согласно законам гемодинамики первичное нарушение одних ее показателей при любой разновидности шока ведет вторично к нарушениям всех. В основе развития расстройств кровообращения в условиях шока могут лежать следующие механизмы. |
