Клин фарма. Нозокомиалка. Общие симптомы
 Скачать 290.54 Kb. Скачать 290.54 Kb.
|
|
При всех инфекционных заболеваниях можно выделить несколько групп признаков и симптомов, которые позволяют установить диагноз. Общие симптомы, характерные для большинства случаев инфекций: - повышение температуры тела, озноб; - симптомы интоксикации (недомогание, общая слабость, потливость, потеря аппетита, тошнота, рвота, мышечные боли). Выраженность общих симптомов может существенно изменяться в зависимости от тяжести инфекции. При ограниченной инфекции общие симптомы отсутствуют. Местные симптомы, появление которых зависит от локализации инфекции, например: боль в грудной клетке, кашель с мокротой, одышка - при пневмонии; боль в поясничной области, частые позывы на мочеиспускание - при пиелонефрите. Лабораторные симптомы: при бактериальной инфекции - обычно лейкоцитоз, нейтрофилез, сдвиг лейкоцитарной формулы влево, увеличение скорости оседания эритроцитов, резкое повышение концентрации С-реактивного белка в крови1. О развитии инфекции свидетельствуют также результаты ряда инструментальных исследований. Например, рентгенография органов грудной клетки дает ценную информацию при диагностике 1 Лейкоцитоз - увеличение общего количества лейкоцитов в крови; нейтрофилез - увеличение числа нейтрофилов (подвида лейкоцитов, принимающих участие в защите организма от бактериальных инфекций); сдвиг формулы влево - появление в крови незрелых форм нейтрофилов, что свидетельствует об активной продукции этих клеток в костном мозге; лейкопения - снижение количества лейкоцитов (характерна для тяжелого течения бактериальной инфекции и ряда вирусных инфекций), увеличение СОЭ может косвенно указывать на активный воспалительный процесс. пневмонии или туберкулеза, результаты микроскопического исследования мочи позволяют поставить диагноз мочевой инфекции. Для каждого инфекционного заболевания существуют свои критерии, по которым устанавливают диагноз. Например, для пневмонии решающее значение имеют результаты дополнительных методов исследования: диагноз этого заболевания может быть установлен только при наличии специфической инфильтрации (затемнения) на рентгеновском снимке. Однако для установления диагноза целого ряда инфекций достаточно клинических симптомов. Окончательным признаком, свидетельствующим об инфекционном процессе, считают выделение возбудителя в тканях и физиологических жидкостях организма, а также результаты серологического исследования - выявление в крови больного антител к микроорганизмам. Понятие нозокомиальной инфекции В зависимости от места возникновения все инфекции можно разделить на внебольничные и нозокомиальные (внутрибольничные, госпитальные). К нозокомиальной инфекции относят заболевания, возникавшие в условиях лечебного учреждения (через 48 ч после госпитализации больного или позже). Выделение нозокомиальной инфекции в отдельную группу обусловлено особым характером возбудителей. Например, обычную (внебольничную) пневмонию, как правило, вызывают пневмококки, чувствительные к пенициллину и другим бета-лактамным препаратам. Нозокомиальную пневмонию чаще вызывают другие микроорганизмы - стафилоккоки, синегнойная палочка, клебсиеллы, причем в большинстве случаев эти микроорганизмы устойчивы к целому ряду антибиотиков. Нозокомиальная инфекция передается в стационарах от одного больного к другому, при этом выживают только штаммы1, обладающие природной или приобретенной устойчивостью к антибиотикам. Это обстоятельство требует особого подхода к этиологическому лечению нозокомиальных инфекций, кроме того, нозокомиальная инфекция, как правило, протекает тяжелее и имеет более серьезный прогноз. 1 Штамм - культура микроорганизмов одного вида, выделенная из общего источника и обладающая определенными общими свойствами (способность возбуждать инфекционный процесс, резистентность к антибиотикам). Виды антибактериальной терапии Специфические возбудители вызывают заболевания со строго определенной клинической картиной: бледная трепонема - сифилис, мико-бактерия туберкулеза - туберкулез, но есть заболевания, которые могут быть вызваны целым рядом различных неспецифических возбудителей: пневмония, пиелонефрит, отит (оппортунистические инфекции). Антимикробная терапия, в свою очередь, бывает двух видов: этио-тропная и эмпирическая. Этиотропная терапия - целенаправленное применение антимикробных препаратов против установленного возбудителя инфекционного процесса. Этот вид лечения считают наиболее рациональным. Эмпирическая терапии - применение антимикробных препаратов до получения сведений о возбудителе и его чувствительности к этим препаратам. В большинстве случаев острой инфекции врач вынужден прибегать к эмпирической терапии из-за того, что идентификация возбудителя требует нескольких суток и не всегда возможна. Выбор препарата для эмпирической терапии проводят с учетом наиболее вероятных возбудителей данной инфекции, например наиболее частый возбудитель пневмонии - пневмококк. Общие принципы эмпирической терапии Для повышения эффективности эмпирической терапии следует придерживаться определенных принципов применения антибактериальных препаратов. • Выбор препарата должен быть основан на точном диагнозе. Знание диагноза позволяет определить предполагаемого возбудителя. • Следует избегать необоснованного назначения антибактериальных препаратов, например, при вирусной инфекции. • Предпочтение следует отдавать препаратам с более узким спектром действия, направленным на предполагаемый возбудитель. • Антибактериальные препараты необходимо назначать с учетом особенностей их фармакокинетики (биодоступность, распределение, проникновение через физиологические барьеры, концентрация в жидкостях и тканях организма, метаболизм, скорость выведения). Фармакокинетика и фармакодинамика антибактериальных препаратов В микробиологии выделяют понятие минимальной ингибирую-щей концентрации (МИК) - минимальная концентрация антибио- тика, способная подавить видимый рост микроорганизмов in vitro. Чем меньше значение МИК, тем больше чувствительность микроорганизма к препарату. Антимикробное действие антибиотиков зависит от создания и поддержания определенной концентрации препарата в очаге инфекции, при этом эффективная концентрация препарата должна превышать величину МИК. Эффективность антибактериальных препаратов зависит от следующих факторов (рис. 29-1): - T >МИК - время, в течение которого концентрация препарата в тканях превышает величину МИК; - величина пиковой концентрации (ПК) - максимальная концентрация антибиотика в крови; - величина площади под кривой «время - концентрация» (AUC - area under curve). 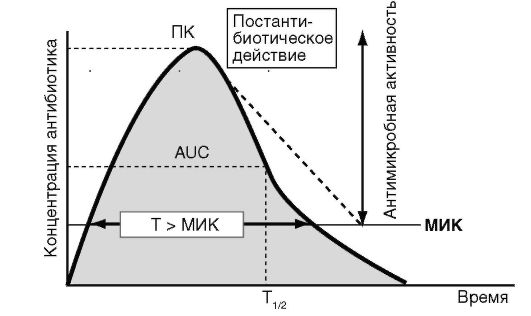 Рис. 29-1. Фармакокинетические/фармакодинамические параметры антимикробных препаратов Ряд препаратов эффективны только при T >МИК больше 50% от интервала между очередными дозами препарата. Другие препараты обладают постантибиотическим действием - способностью подавлять размножение организмов даже после того, как концентрация препаратов в организме снижается. Для таких антибиотиков критерием эффективности считают отношение ПК/МИК или АиС/МИК. Таким образом, по антимикробной активности все антибактериальные препараты можно разделить на три основные группы. • Эффективность зависит от дозы. Препараты, имеющие выраженный постантибиотический эффект. Антимикробная активность определяется созданием высокой пиковой концентрации (например, аминогликозиды). Эффективность этих ЛС в основном зависит от величины соотношений AUC/МИК или ПК/МИК. Эти препараты, как правило, имеют большой интервал дозирования. • Эффективность зависит от продолжительности действия. Препараты, эффективность которых зависит от продолжительности действия и имеющие минимальное постантибиотическое действие (β-лактамы). В этом случае основным параметром эффективности считают отношение T >МИК. Для таких препаратов необходимо постоянное превышение МИК, следовательно, их необходимо вводить чаще. К таким препаратам относят большинство β-лактамных антибиотиков и макролиды (кроме азитромицина). • Эффективность зависит и от дозы, и от продолжительности действия. В третьей группе эффективность определяется как продолжительностью действия, так и концентрацией (фторхинолоны, тетрациклины). Таким образом, основным фармакокинетиче-ским/фармакодинамическим параметром эффективности можно считать соотношение AUC/МИК. Еще одним важным параметром, определяющим эффективность антимикробных средств, считают их способность проникать в очаг инфекции, т.е. преодолевать гистогематические барьеры (гематоэн-цефалический и пр.), проникать в ткани (например, в костную ткань хорошо проникают линкозамиды), клетки (на внутриклеточных возбудителей воздействуют макролиды), а также не терять активность в кислой среде, возникающей в воспалительном очаге. Контроль эффективности антибактериальной терапии К критериям клинической эффективности относят нормализацию температуры тела, исчезновение общих и местных симптомов инфекции. Из лабораторных показателей об эффективности лечения свидетельствует снижение количества лейкоцитов (в первую очередь нейтрофилов), уменьшение концентрации С-реактивного белка и уменьшение СОЭ. При ряде инфекций важную информацию об эффективности лечения можно получить при рентгенологическом исследовании пораженных органов или с помощью других методов визуализации (УЗИ, компьютерной томографии, эндоскопического исследования). При оценке микробиологической эффективности необходимо учитывать возможность: - эрадикации возбудителя - исчезновения первоначального возбудителя; - суперинфекции - появления в ходе лечения нового возбудителя; - рецидива - повторного появления возбудителя; - реинфекции - появления нового вида, нового серотипа или нового биотипа возбудителя после эрадикации первоначального; - колонизации - присутствия микроорганизмов в месте локализации инфекции без признаков активного инфекционного процесса. Контроль безопасности антибактериальной терапии Для оценки безопасности применения любого антимикробного препарата существуют клинические и лабораторные методы обнаружения НЛР, т.е. любых неблагоприятных событий, возникших в период приема препарата. Кроме клинического контроля развития НЛР необходимо проводить лабораторный контроль, при этом метод зависит от имеющихся сведений о препарате и имеющегося опыта работы с ним. Соответственно при применении препаратов, обладающих нефро-токсическим действием, необходимо контролировать функцию почек (по концентрации креатинина в крови), например выявление нефро-токсического действия аминогликозидов по повышению концентрации креатинина более чем на 50% от первоначальных данных, на фоне приема препарата. Для выявления гепатотоксического действия определяют активность печеночных ферментов (АЛТ, АСТ), например выявление гепатотоксического действия пефлоксацина при увеличении активности печеночных ферментов (АЛТ, АСТ) более чем в 2,5-3 раза. Одним из методов оценки безопасности фармакотерапии также считают терапевтический лекарственный мониторинг - контроль концентрации ЛС в плазме крови с целью подбора индивидуального режима дозирования препарата. Этот метод используют при приеме аминогликозидов, ванкомицина. Регистрация НЛР может потребовать прекращения проводимого лечения или нет. Тактика зависит от тяжести зарегистрированных НЛР. 29.2. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ПЕНИЦИЛЛИНОВ Класс β-лактамов включает в себя пенициллины, цефалоспори-ны, монобактамы и карбапенемы. Все эти препараты объединяет наличие в структуре молекулы β-лактамного кольца, что объясняет одинаковый механизм действия, сходные механизмы резистентности, а также целый ряд общих свойств данных препаратов (бактерицидное действие, синергизм с аминогликозидами, низкую токсичность, возможность перекрестной аллергии). Пенициллин был открыт Александром Флемингом в 1928 г., но коммерческое производство бензилпенициллина (пенициллина G) стало доступным только в 1940-е годы. После идентификации 6-аминопеницилланового ядра было создано большое количество производных, обладающих различными преимуществами в сравнении с бензилпенициллином: по спектру активности, стабильности к действию β-лактамаз, фармакокинетике. Пенициллины разделяют на группы в зависимости от спектра активности (табл. 29-1). Механизм действия β-лактамных препаратов заключается в нарушении образования клеточной стенки бактерий путем необратимого связывания с пенициллиносвязывающими белками (ПСБ). Эти белки по своей природе - ферменты, обеспечивающие синтез клеточной стенки бактерий. Нарушение их функции вызывает гибель микробной клетки. Таким образом, пенициллины обладают бактерицидными свойствами. Особенно чувствительны к пенициллинам грамположительные бактерии с толстой клеточной стенкой. Таблица 29-1. Классификация пенициллинов 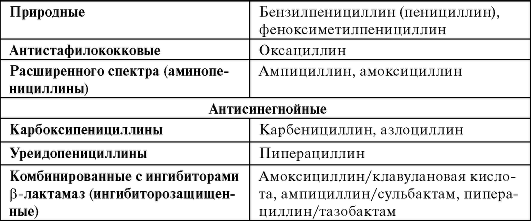 Резистентность к β-лактамам возможна у большинства микроорганизмов и обусловлена разнообразными механизмами. Первый механизм - в большей степени бактерии защищаются от действия антибиотиков путем продукции ферментов - β-лактамаз. Эти ферменты нарушают целостность β-лактамного кольца, что приводит к инактивации антибиотиков. β-Лактамазы часто вырабатывают такие микроорганизмы, как стафилококки, кишечная палочка, гонококки, анаэробы. β-лактамазы разделяют: - по субстратному профилю - пенициллиназы, цефалоспорина-зы, карбапенемазы; - по локализации в микробной клетке генов, кодирующих продукцию β-лактамаз: хромосомные и плазмидные. Из всех β-лактамных препаратов только карбапенемы отличаются высокой стабильностью к гидролизу всеми хромосомными и плаз-мидными β-лактамазами, в том числе β-лактамазы расширенного спектра действия. Для преодоления резистентности, связанной с продукцией β-лактамаз, были разработаны соединения, способные подавлять активность этих ферментов, так называемые ингибиторы β-лактамаз, - кла-вулановую кислоту, сульбактам и тазобактам. Их используют при создании комбинированных (ингибиторозащищенных) пенициллинов (амоксициллин/клавулановая кислота, ампициллин/сульбактам и др.), а также цефалоспоринов (цефоперазон/сульбактам), но сами по себе антимикробной активностью они не обладают. Второй механизм - изменение ПСБ участка микробной клетки, на которую действует антибиотик (модификация мишени). Это ведет к тому, что антибиотик не может связаться с мишенью, на которую направлена его активность. Примером таких микроорганизмов можно считать пенициллинорезистентный пневмококк. Третий механизм - синтез дополнительного ПСБ (механизм «обходного пути»). При этом, несмотря на действие антибиотика, жизнедеятельность микроорганизма не нарушается. Такой механизм характерен для стафилококков, устойчивых к метициллину®, оксацил-лину и другим пенициллинам и цефалоспоринам. Четвертый механизм - нарушение проницаемости клеточной стенки для β-лактамов. Такой механизм обеспечивает устойчивость синегнойной палочки к β-лактамам. Фармакокинетика Основные фармакокинетические свойства пенициллинов следующие: • сохраняют активность в очаге воспаления (при низком рН, концентрации О2, высокой концентрации белка, большом количестве лейкоцитов); • плохо проникают в моноциты и через гематоэнцефалический барьер при отсутствии воспалительного процесса; • менее активны в отношении колоний с высокой концентрацией бактерий; • как правило, безопасны при беременности. Наиболее высокой биодоступностью (93%) обладают специальные растворимые таблетки амоксициллина - флемоксин солютаб*. Бензилпенициллин, карбокси- и уреидопенициллины в значительной степени разрушаются в желудке, из-за этого их вводят только парентерально. Феноксиметилпенициллин, оксациллин и аминопенициллины более кислотоустойчивы, их можно назначать внутрь. Наилучшее всасывание из ЖКТ характерно для амок-сициллина - 75-93%, в то же время его биодоступность не зависит от пищи. Всасывание феноксиметилпенициллина составляет 40-60% (при приеме натощак концентрация в крови несколько выше). Хуже всасываются ампициллин (35-40%) и оксациллин (25-30%), причем пища значительно снижает их биодоступность. Всасывание ингибитора β-лактамаз - клавулановой кислоты - составляет 75%. Бензилпенициллина новокаиновую соль* и бензатина бензил-пенициллин вводят только внутримышечно. Медленно всасыва- ясь из места инъекции, они создают более низкие, по сравнению с натриевой и калиевой солями бензилпенициллина, концентрации в сыворотке крови. Обладают пролонгированным действием, их иногда называют «депо-пенициллины». Терапевтическая концентрация бензилпенициллина новокаиновой соли* в крови сохраняется на протяжении 18-24 ч, а бензатина бензилпеницил-лина - 3-4 нед. Пенициллины распределяются во многих органах, тканях и биологических жидкостях. Создают высокие концентрации в легких, почках, слизистой оболочке кишечника, репродуктивных органах, костях, плевральной и перитонеальной жидкости. Наиболее высокая концентрация в желчи характерна для уреидопенициллинов. проникают через плаценту и в грудное молоко. Плохо проходят через гематоэнцефалический и гематоофтальмический барьер, а также в предстательную железу. При менингите проницаемость гематоэн-цефалического барьера увеличивается. Клинически значимой биотрансформации в печени могут подвергаться оксациллин (до 45%) и уреидопенициллины (до 30%). Другие пенициллины практически не подвергаются метаболизму и выводятся из организма в неизмененном виде. Среди ингибиторов β-лактамаз наиболее интенсивно биотрансформируется клавулановая кислота (около 50%), в меньшей степени - сульбактам (около 25%), еще слабее - тазобактам. Большинство пенициллинов экскретируется почками. Их Т1 / 2 составляет в среднем около 1 ч (кроме «депо-пенициллинов») и значительно возрастает при почечной недостаточности. Оксациллин и уреидопенициллины выводятся двумя путями - через почки и желчевыводящие пути. Их Т1 / 2 в меньшей степени изменяется при нарушении функций почек. Почти все пенициллины полностью удаляются при гемодиализе. Концентрация пиперациллин/тазобактама снижается при проведении гемодиализа на 30-40%. |
