Основная цель лабораторных занятий связать теоретиче
 Скачать 131.07 Kb. Скачать 131.07 Kb.
|
ЛАБОРАТОРНАЯ РАБОТА № 7. ИССЛЕДОВАНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙЦель работы: познакомиться с наиболее распространенны- ми окислителями и восстановителями, с продуктами их взаимодей- ствия между собой и научиться составлять уравнения окислительно- восстановительных реакций. Общие сведенияОкислительно-восстановительные реакции (ОВР) – хими- ческие реакции, в ходе которых происходит изменение степеней окисления атомных частиц элементов. Степень окисления (СО) – число, которое по формальным правилам может быть приписано атомной частице любого элемента, другими словами, – это формальный заряд атомной частицы элемен- та, рассчитанный по определенным правилам (–4 ≤ СO ≤ 8). Правила определения степеней окисления следующие: 8 В простых веществах степени окисления атомов равны ну- лю, например Cu0, S0 . Некоторые элементы в сложных веществах и сложных частицах имеют, как правило, постоянные степени окисления. К ним относятся: 56 2 Cs1O ; а) Cs, Fr, K, Li, Na, Rb – степень окисления +1, например K+I, б) Ba, Be, Ca, Cd, Mg, Ra, Sr, Zn – степень окисления +2, на- пример Be+2Cl2, Zn+2S; в) Ac, Al, La, Y, Sc – степень окисления +3, например Al+3F3, La+3Br3; 2 г) F – степень окисления -1, например CaF , RbF ; д) O – степень окисления -2 [за исключением соединений с фтором, пероксидов ( O2 – пероксид-ион), надпероксидов ( O − 2 2 3 надпероксид-ион) и озонидов ( O – озонид-ион)], например CO2 , 3 SO2 ; е) Br, Cl, I – степень окисления -1 (кроме соединений с фто- 2 ром, кислородом, азотом и между собой), например MgCl , NaI ; ж) H – степень окисления +1 [кроме соединений с элемента- ми, перечисленными в пунктах а), б), в), с бором(III), с медью(I) и с золотом(I), в которых степень окисления водорода -1], например H1O , NH1 . 2 3 Степень окисления элемента в одноатомном ионе равна электрическому заряду иона, например, в катионе Pb2+ степень окис- ления элемента свинца составляет +2. Сумма произведений степеней окисления всех элементов молекулы или «условной молекулы» (формульной единицы вещест- ва) и их стехиометрических индексов в формуле молекулы («услов- ной молекулы») равна нулю. Это правило используют для определе- ния неизвестной степени окисления. Например, определим степень окисления кислорода (обозначив ее «x») в веществе H2O2: 2 2 HOx , 1 2 x 2 0 x 1. Сумма произведений степеней окисления всех элементов молекулярного иона и их стехиометрических индексов в формуле иона равна электрическому заряду иона. Это правило тоже исполь- зуют для определения неизвестной степени окисления. Например, 57 определим степень окисления фосфора (обозначив ее «z») в ионе 4 HPO2 . 4 H+1PzO-2 2 , 1 1 z 1+( -2) 4= -2 z=+5 . Высшая (максимальная) степень окисления (ВСО), как и число валентных электронов, как правило, равна номеру группы. Исключениями являются элементы IB-группы и приведенные в табл. (f-элементы не рассматриваются). Низшая (минимальная) степень окисления (НСО) для s- и d-элементов, а также для p-элементов IIIA группы, как правило, рав- на нулю, а для остальных p-элементов может быть найдена по фор- муле: НСО № группы 8 . Исключения приведены в табл. 7.2 (f-элементы не рассматриваются). Таблица 7.1 ВСО некоторых элементов
Таблица 7.2 НСО некоторых элементов
58 Окислительно-восстановительная реакция – единая реакция, которая может быть условно разбита на две полуреакции: окислениеи восстановление. Окисление – полуреакция, при которой степень окисления атомной частицы элемента повышается вследствие отдачи электро- нов. Восстановление – полуреакция, при которой степень окис- ления атомной частицы элемента понижается вследствие присоеди- нения электронов. Уравнение реакции 2 C+2O-2 Cu+2O-2 Cu0 C+4O-2 . Уравнения полуреакций: C2 2e=C4 окисление, Cu2 2e Cu0 – восстановление. Вещества, между которыми происходит процесс окисления- восстановления, называются окислителеми восстановителем. Окислитель – реагент, содержащий атомную частицу эле- мента, понижающую степень окисления путем присоединения элек- тронов. Сама атомная частица тоже окислитель. В приведенном примере – это оксид меди(II) за счет атомной частицы элемента медь в СО +2, понижающей ее до 0. Восстановитель – реагент, содержащий атомную частицу элемента, повышающую степень окисления путем отдачи электро- нов. Сама атомная частица тоже восстановитель. В приведенном примере – это оксид углерода(II) за счет атомной частицы элемента углерод в СО +2, повышающей ее до +4. В ходе ОВР окислитель восстанавливается, а восстановитель окисляется. Другими словами, окислитель восстанавливается вос- становителем, а восстановитель окисляется окислителем. Таким об- разом, восстановление немыслимо без окисления, а окислитель без восстановителя. 59 Низшая степень окисления – степень окисления, существо- вание ниже которой для атомной частицы элемента невозможно. Вещества (частицы), в состав которых входят атомные час- тицы элемента, находящиеся в НСО, за счет них могут быть только восстановителями. Например, аммиак за счет атомной частицы элемента азот в степени окисления –3 может быть только восстановителем. Высшая степень окисления – степень окисления, существо- вание выше которой для атомной частицы элемента невозможно. Вещества (частицы), в состав которых входят атомные час- тицы элемента, находящиеся в ВСО, за счет них могут быть только окислителями. Например, азотная кислота за счет атомной частицы элемен- та азот в степени окисления +5 может быть только окислителем. Промежуточная степень окисления – степень окисления атомной частицы элемента, которая больше низшей степени окисле- ния, но меньше высшей степени окисления. Вещества (частицы), в состав которых входят атомные час- тицы элемента, находящиеся в промежуточной степени окисления, за счет этого элемента могут быть как восстановителями, так и окислителями, т.е. проявляют окислительно-восстановительнуюдвойственность. Например, оксид азота(II) за счет атомной частицы элемента азот в степени окисления +2 может быть как восстановителем, так и окислителем. Определение стехиометрических коэффициентов в уравне- ниях ОВР обычно выполняют методом электронного баланса и ме- тодом полуреакций, или ионно-электронным методом. Метод электронного баланса основан на том, что общее число электронов, принимаемых окислителем и отдаваемых восста- новителем в одной и той же окислительно-восстановительной реак- ции, должно быть одинаковым. По получении схемы ОВР определение стехиометрических коэффициентов рекомендуется проводить в следующей последова- тельности: 60 Расставить СО атомных частиц элементов в реагентах и продуктах; Определить восстановитель, окислитель и продукты окисле- ния и восстановления; Составить электронные уравнения процессов окисления и восстановления; Найти наименьшее общее кратное (НОК) для чисел отдан- ных и присоединенных электронов. Делением НОК на числа отдан- ных и присоединенных электронов определить множители для урав- нений процессов окисления и восстановления (в приведенном при- мере они указаны правее вертикальной черты в п. 2) и умножить на них каждое из уравнений соответственно. Записать электронный баланс; Составить суммарное уравнение электронного баланса пу- тем сложения уравнений процессов окисления и восстановления. Электроны при этом взаимно уничтожаются; Перенести коэффициенты, полученные в п. 4, в уравнение реакции, поставив их (с учетом стехиометрических индексов при атомных частицах-восстановителях, атомных частицах-окислителях и атомных частицах-продуктах окисления, атомных частицах-про- дуктах восстановления) перед формулами восстановителя, окисли- теля, продуктов окисления и восстановления; Соблюдая материальный баланс, привести к натуральным числам стехиометрические коэффициенты, полученные в п. 5, перед формулами восстановителя, окислителя, продуктов окисления и вос- становления; Определить стехиометрические коэффициенты при фор- мулах остальных реактантов, соблюдая следующую последователь- ность: соли, кислоты (щелочи), вода; Проверить правильность расстановки стехиометрических коэффициентов, убедившись в равенстве суммарного числа атомных частиц каждого элемента в левой и правой частях уравнения. Рассмотрим приведенный алгоритм на конкретном примере. Na2SO3 K2Cr2O7 H2SO4 Na2S2O6 +Cr2 SO4 3 K2SO4 Na2SO4 H2O 61 2 3 2 2 7 2 4 2 2 6 Na1S4O2 K1Cr6O2 H1S6O2 Na1S5O2 1. 2 4 2 4 2 4 2 3 Cr3 S6O2 K1S6O2 Na1S6O2 H1O2 Na 2SO3 – восстановитель; K2Cr2O7 – окислитель; Na2S2O6 – продукт окисления; Cr2 SO4 3 – продукт восстановления; H2SO4 – среда. S4 2. e = S5 3 . Gr+6 3e= Cr3 1 НОК 3 . Электронный баланс 3S4 3e= 3S5 . Cr6 3e=Cr3 Суммарное уравнение электронного баланса 3S4 Cr6 3S5 Cr3 . 3Na2S4O3 0,5K2Cr6O7 H2SO4 1,5Na S5O6 5. 0, 5Cr3 SO 2 2 2 K SO Na SO H O. 2 4 3 2 4 2 4 2 6Na2S4O3 K2Cr6O7 H2SO4 3Na S5O6 6. Cr3 SO 2 2 2 K SO Na SO H O. 2 4 3 2 4 2 4 2 6Na2S4O3 K2Cr6O7 7H2SO4 3Na S5O6 7. Cr3 SO 2 2 2 K SO 3Na SO 7H O. 2 4 3 2 4 2 4 2 62 С правой и с левой сторон уравнения по 53 атомных частиц ки- слорода. Метод полуреакций или ионно-электронный метод при- меняется для ОВР, протекающих в водных растворах (или распла- вах) с участием электролитов. Он основан на составлении ионно- молекулярных уравнений с участием электронов для процессов окисления и восстановления с последующим их суммированием в общее ионно-молекулярное уравнение. Как и в методе электронного баланса, общее число электронов, «отдаваемых» восстановителем и «принимаемых» окислителем в одной и той же реакции должно быть одинаковым. Метод полуреакций рассматривает более реальные час- тицы, существующие в растворе, поэтому он не столь формален, как предыдущий, но зато он неприменим для газофазных ОВР и реак- ций, протекающих на границе раздела между твердыми и газообраз- ными веществами. Отметим также, что определение коэффициентов с помощью ионно-электронного метода не нуждается в понятии сте- пени окисления. Рассмотрим последовательность действий согласно методу полуреакций на примере той же ОВР, что и ранее, схема которой Na2SO3 + K2Cr2O7 + H2SO4 → Na2S2O6 + Cr2(SO4)3 + + K2SO4 + H2O + Na2SO4. Составляем полную, а затем краткую ионно-молекулярные схемы реакции (без каких бы то ни было коэффициентов). Напом- ним, что в диссоциированной форме, т.е. в виде формул ионов, в этих уравнениях записываются только формулы сильных электроли- тов, которые хорошо растворимы в воде. Формулы неэлектролитов, слабых электролитов и малорастворимых веществ в этих уравнениях записываются в недиссоциированной форме. 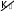 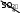 Полная схема Полная схема3 Na+ + SO2 - + + Cr2O2 - + H+ + → 7 6 → Na+ + S2O2 - + Cr3 + + - + + H2O. 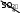 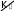 Краткая схема Краткая схема63 SO2 + Cr O2 + H+ → S O2 - + Cr3 + H2O. 3 2 7 2 6 Составим ионно-электронные уравнения полуреакций – процессов окисления и восстановления. Учтем, что в кислой среде во взаимодействие с частицами-восстановителями и окислителями могут вступать ионы H+ и молекулы H2O, в нейтральной - только молекулы H2O, а в щелочной – ионы OH и молекулы H2O. В на- шем примере среда кислая, так как. реакция протекает в растворе серной кислоты. Последовательность написания уравнений полуре- акций SO2 → S O2 , 3 2 6 2SO2 → S O2 , , 3 2 6 2SO2 –2e = S O2 ; 3 2 6 7 Cr2O2 → Cr3 , 7 Cr2O2 → 2Cr3 , Cr2O2 + H → 2Cr3 + H O , 7 2 Cr2O2 - + 14H → 2Cr3 + 7H O , 7 2 Cr2O2 + 14H + 6e = 2Cr3 + 7H O . 7 2 Находим наименьшее общее кратное (НОК) для чисел «отданных» и «присоединенных» электронов и с его помощью рас- считываем множители для обоих ионно-электронных уравнений: НОК для 2 и 6 равно 6; множитель для первого уравнения 6 : 2 = 3; множитель для второго уравнения 6 : 6 = 1. Обычно это записывают так: 64 Восст-ль2 SO2 – 2е= S O2 - 3 Ок-ие 3 2 6 Ок-льCr2O2 + 14H + 6е = 2Cr3 + 7H O НОК = 6 1 В-ие. 7 2  Схему подобного типа называют схемой баланса полуреакций или Схему подобного типа называют схемой баланса полуреакций илиионно-электронным балансом.Составляем краткое ионное уравнение ОВР с учетом зако- на сохранения массы (число атомов каждого элемента слева и справа от знака равенства должно быть одинаково). Для этого умножаем уравнения полуреакций на множители, рассчитанные в п.3., и скла- дываем полученные уравнения между собой (электроны должны со- кратиться) 6 SO2 – 6е = 3S O2 3 2 6 7 2 Cr2O2 + 14H + 6е = 2Cr3 + 7H O 6SO2 + Cr O2 + 14H = 3S O2 + 2Cr3 + 7H O . 3 2 7 2 6 2 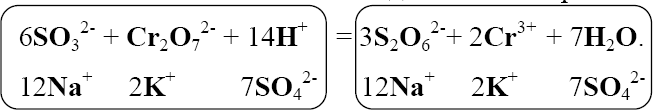 Составляем молекулярное уравнение ОВР. Для этого в ле- вой части ионно-молекулярного уравнения к каждой формуле анио- на добавляем соответствующие формулы катионов, и наоборот. Ес- тественно, что речь может идти только о ионах, формулы которых присутствуют в полной ионно-молекулярной схеме данной реакции. Число противоионов при этом должно быть таким, чтобы нейтрали- зовать заряд всех ионов левой части. Затем те же формулы противо- ионов в таком же количестве добавляем к правой части. После чего объединяем ионы в формульные единицы. Составляем молекулярное уравнение ОВР. Для этого в ле- вой части ионно-молекулярного уравнения к каждой формуле анио- на добавляем соответствующие формулы катионов, и наоборот. Ес- тественно, что речь может идти только о ионах, формулы которых присутствуют в полной ионно-молекулярной схеме данной реакции. Число противоионов при этом должно быть таким, чтобы нейтрали- зовать заряд всех ионов левой части. Затем те же формулы противо- ионов в таком же количестве добавляем к правой части. После чего объединяем ионы в формульные единицы.6Na2SO3 + K2Cr2O7 + 7H2SO4 → 3Na2S2O6 + 65 + Cr2(SO4)3 + K2SO4 + 7H2O + 3Na2SO4. Видно, что независимо от применяемого метода коэффициенты в уравнении реакции получаются одни и те же. Для ряда окислителей глубина восстановления зависит от характера среды. Например, в кислой среде марганец перманганата восстанавливается до степени окисления +2. В нейтральной среде, ввиду недостатка ионов Н+, восстановление идет до MnO2, а в ще- лочной среде восстановление заканчивается уже на стадии образо- 4 вания Mn+6 в форме манганат-иона MnO2 . Контрольные вопросыми? та? Какие реакции называют окислительно-восстановительны- В каком случае элемент является окислителем? В каком случае элемент является восстановителем? Что такое степень окисления? Чему равна максимальная степень окисления элемента? Как определить минимальную степень окисления элемен- Как зависит состав продуктов восстановления пермангана- та калия от рН среды? В какой степени окисления элементы обладают окисли- тельно-восстановительной двойственностью? Оборудование и реактивыВ штативе: иодид калия, бромид калия, хлорид бария, нитрат калия, сульфат хрома(III), бихромат калия, сульфат марганца(II), роданид аммония, гидроксид натрия, гидроксид калия, иод – раство- ры концентрацией 5 %. В вытяжном шкафу: перманганат калия, сер- ная кислота – 2 н раствор, серная кислота - раствор концентрацией 20 %, соляная кислота – раствор концентрацией 15 %, соляная ки- слота – концентрированный раствор, азотная кислота – 15 % рас- твор, азотная кислота – концентрированный раствор, хлорная вода, 66 бромная вода, сероводород – раствор, сульфид натрия – раствор концентрацией 5 %. Получить у преподавателя: пробирки – 5 шт.; пероксид водорода – концентрированный раствор; ССl4; крахмал, сульфит натрия, нитрит натрия, хлорид олова(II), хлорид олова(IV), сульфат железа(II), гексацианоферрат(III) калия – растворы концен- трацией 5 %; медь металлическая, сера – порошок, уголь, оксид свинца(IV) – порошок, оксид марганца(IV). Выполнение работыДля всех реакций, выполняемых в ходе работы, необходимо составить уравнения ОВР и найти стехиометрические коэффициен- ты. Опыт 1. Окислительные свойства пероксида водорода. Налить в пробирку 3 − 4 капли раствора пероксида водорода, доба- вить 2 − 3 капли 2 н раствора серной кислоты и столько же раствора иодида калия. К содержимому пробирки добавить крахмал. Обра- тить внимание на окраску раствора. |
