Онкогематология. Острый миелобластный лейкоз у взрослых
 Скачать 1.28 Mb. Скачать 1.28 Mb.
|
|
Исследования GMALL 06/99 и 07/2003. Протокол GMALL 06/99 был начат как пилотное исследование. Основная цель заключалась в разработке нового, более короткого и интенсивного режима индукции, построенному на новых принципах в сравнении с предыдущими протоколами. Основные отличия заключались в следующем: · Использование дексаметазона вместо преднизолона для повышения антилейкемического эффекта и профилактики нейролейкоза; · Предфаза с циклофосфамидом и кортикостероидами; · Использование G-CSF одновременно с химиотерапией; · Интенсификация введения даунорубицина – два двухдневных введения вместо четырех еженедельных; · Одно введение PEG-аспарагиназы вместо 14 введений L-аспарагиназы в индукции. II фаза индукции и консолидация I остались без изменений. Пациентам с высоким и очень высоким (Ph+) риском планировалась аллогенная трансплантация ГСК в первой ремиссии. Пациенты со стандартным риском получали шесть курсов консолидации и реиндукцию. Поддерживающая терапия выбиралась в зависимости от наличия минимальной резидуальной болезни. Протокол GMALL 07/2003.
В исследование было включено 843 пациента с медианой возраста 36 лет. Частота полных ремиссий составляла 83%. Ранняя смертность – 7%. Использование в индукционной терапии дексаметазона увеличило вероятность достижения ремиссии. Снижение дозы дексаметазона привело к уменьшению летальности на фоне индукционной терапии за счет снижения частоты тяжелых инфекционных осложнений. Более раннее использование G-CSF привело к существенному уменьшению нейтропений III/IV степени и, вероятно, мукозитов [36]. Оптимизированный режим индукции использовался в протоколе GMALL 07/2003 и продолжает использоваться в протоколе GMALL 08/2010. Предварительные результаты подтверждают высокую эффективность модифицированного режима индукции – полные ремиссии достижимы в 89% случаев при ранней летальности 4% [36]. Дополнительными модификациями были использование иматиниба в процессе индукции при Ph позитивном ОЛЛ и ритуксимаба при В-ОЛЛ с экспрессией CD20. 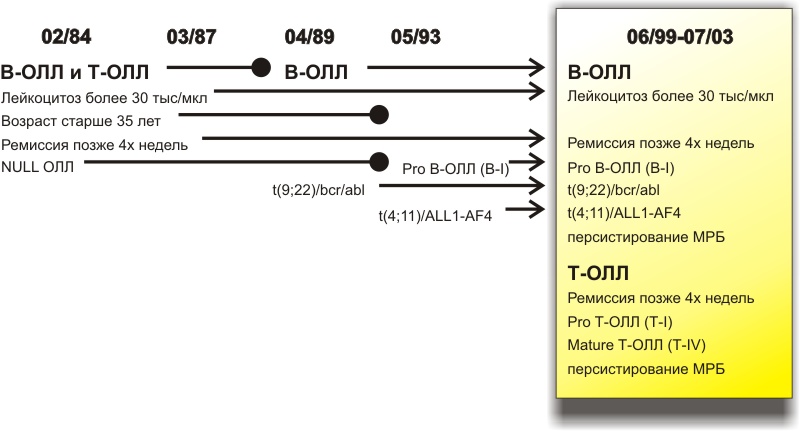 Одним из важных достижений Немецкой группы по изучению ОЛЛ у взрослых является разработка прогностических критериев заболевания, которые позволяют оптимизировать лечение. В течение 30 лет критерии, которые позволяли отнести пациента к группе высокого риска, менялись (рисунок), но два клинических критерия сохраняют актуальность до настоящего времени – лейкоцитоз более 30 х 109/л и отсутствие ремиссии после завершения первой фазы индукции. Очень важным было введение в число критериев цитогенетических, молекулярно-генетических маркеров и, в последних исследованиях, минимальной резидуальной болезни. a) Терапия спасения (уровень доказательности D) [37]. Блинатумомаб представляет собой биспецифическое одноцепочное антитело, таргетное к антигену CD 19. Данный препарат относится к новому классу антител, которые перенаправляют Т-клетки для специфического лизиса опухолевых клеток. В настоящее время блинатумомаб используется для лечения пациентов с рецидивом, рефрактерным течением острого лимфобластного лейкоза, либо персистенцией МРБ. В США проведено исследование, в которое была включена группа, состоящая из 21 пациента с персистенцией МРБ, включая специфические абберации – BCR/ABL и MLL/AF4, которые получали блинатумомаб по следующей схеме: 15 мкг/м2 в виде 24-часовой инфузии в течение 4х недель. Далее делался перерыв в течение 2х недель. У 16 пациентов из данной группы достигнута полная ремиссия, с отрицательной МРБ. У 12 пациентов из этих 16 было рефрактерное течение заболевание, без ответа на предыдущую химиотерапию. Таким образом, безрецидивная выживаемость составила 78%, медиана наблюдения 405 дней. b) Особенности введения беременных с острым лимфобластным лейкозом (уровень доказательности С) [38-39]. При диагностике острого лимфобластного лейкоза в первый триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности. Химиотерапия в первом триместре беременности имеет 10-20% риск развития тяжелых аномалий развития. Химиотерапию у беременных рекомендуется начинать не раньше второго триместра (после 14-15 недель гестации), когда завершается формирование гемоплацентарного барьера. Препараты в высоких дозах могут проникать через гематоэнцефалический барьер. Использование высоких доз метотрексата во время беременности ассоцируется с развитием аминоптеринового синдрома (диостоз черепа, задержка окостенения, гипертелоризм, микрогнатия, аномалия глаз). Иматиниб не проникает через гематоэнцефалический барьер и, вероятно, через гематоплацентарный барьер. Поэтому врожденные аномалии очек, костей, головного мозга, кишечника и сердца при использовании данного препарата возможны только при использовании в первом триместре, причем данная патология возникает в 19% случаев. При проведении терапии у беременных необходимо исключить использование фторхинолонов (риск развитии артропатии, нарушение остеогенеза), сульфаниламидов (дефекты нервной трубки, мальформация сердца). Применение циклофосфамида, треотинина, ритуксимаба во втором и третьем триместрах является безопасным для плода. По данным двух ретроспективных исследований, охвативших соответственно 84 и 111детей, матери которых получали в период беременности химиотерапию по поводу гемобластозов и других опухолей, в отдаленном периоде (медиана наблюдения 18,7 лет) не выявлено нарушений нервно-психического, полового развития и увеличения риска новообразований. c) Трансфузионая поддержка. Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения. Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходмиости профилактичесиких трансфузий концентрата тромбоцитов. Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней. Эритроцитарная масса/взвесь (уровень доказательности D): · Уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде; · Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de novo депрессией или элевацией ST); · Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов; · При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
Концентрат тромбоцитов (уровень доказательноти D): · При снижении уровня тромбоцитов менее 10 х109/л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов. · Профилактическая трансфузия аферезных тромбоцитов у пациентов с лихорадкой, пациентам, которым планируется инвазивное вмешательство может проводится при более высоком уровне - 10 х109/л. · При наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью. |
