Патология системы крови-1. Патология системы крови
 Скачать 0.79 Mb. Скачать 0.79 Mb.
|
|
§ Нормоцитемическая гиповолемия (эквивалентное уменьшение общего содержания форменных элементов и плазмы крови). § Снижение показателя объёма циркулирующих эритроцитов. § Ht, число эритроцитов, уровень Hb в единице объёма крови в рамках нормальных диапазонов. ‡ 2–3 е сутки после кровопотери. § Снижение уровня Hb ниже нормы. § Уменьшение числа эритроцитов в единице объёма крови и падение Ht. § Сохранение в пределах нормы цветового показателя (в связи с тем, что в крови циркулируют зрелые эритроциты, находившиеся в сосудистом русле (в том числе — в депо) до кровопотери. § Тромбоцитопения (в результате потребления кровяных пластинок в процессе тромбообразования, гемодилюции, а также утраты их при кровопотере). § Лейкопения (вследствие потери лейкоцитов во время кровотечения и последующей гемодилюции). ‡ 4–5 е сутки после кровопотери. § Пониженное содержание Hb, эритропения, сниженный Ht. § Гипохромия эритроцитов (цветовой показатель ниже 0,85). Обусловлена отставанием скорости синтеза Hb от темпа пролиферации эритроидных клеток. § Увеличение числа молодых клеток эритроидного ряда: ретикулоцитов, иногда полихроматофильных и оксифильных эритробластов (как результат высокой регенераторной способности костного мозга). § Тромбоцитопения и лейкопения. • Терапия. Восстановление ОЦК (хирургическая остановка кровотечения, гемотрансфузии, коллоидные растворы). Хронические постгеморрагические анемии • Причины: †Длительные, повторяющиеся кровотечения в результате нарушения целостности стенок сосудов (например, при инфильтрации в них опухолевых клеток, экстрамедуллярном кроветворении, выраженный венозной гиперемии, язвенных процессах в ЖКТ, коже, слизистых оболочках), эндокринопатий (например, при дисгормональной аменорее) и расстройств гемостаза (например, при нарушении сосудистого, тромбоцитарного или коагуляционного механизмов у пациентов с геморрагическими диатезами). • Патогенез и проявления связаны в основном с нарастающим дефицитом железа в организме. Они являются частным вариантом железодефицитных анемий. В связи с этим механизм и проявления хронических постгеморрагических анемий рассматриваются далее в разделе «Дизэритропоэтические анемии». Гемолитические анемии Гемолитические анемии — большая группа заболеваний, характеризующихся снижением средней продолжительности жизни эритроцитов (в норме 120 дней) и преобладанием интенсивности гемолиза эритроцитов в сравнении с их образованием. Гемолиз (разрушение эритроцита) может быть внесосудистым (в селезёнке, печени или костном мозге) и внутрисосудистым. Виды гемолитических анемий В зависимости от степени замещения разрушенных клеток новыми эритроцитами говорят о компенсированных и некомпенсированных гемолитических анемиях. Гемолитические анемии классифицируют также по этиологическому фактору — идиопатические (причина не известна) и вторичные (например, вызванные приёмом ЛС), по форме течения — острые, подострые, хронические, по типу дефекта (табл. 21–3). Таблица 21-3. Классификация гемолитических анемий по виду дефекта.
* Г-6-ФД — глюкозо-6-фосфат дегидрогеназа. Этиология Гемолитические анемии возникают при дефектах эритроцитов (внутриклеточные факторы) либо под воздействием внешних по отношению к эритроцитам причин (внеклеточные факторы). Обычно внутриклеточные факторы — наследуемые, а внеклеточные — приобретённые. • Внеклеточные факторы Микроокружение эритроцитов представлено плазмой и эндотелием сосудов. Присутствие в плазме ауто- или изоантител, токсических веществ или инфекционных агентов вызывает изменения стенки эритроцита, что приводит к его разрушению. Это наблюдается при: † Изоиммунной гемолитической анемии при эритробластозе плода. сюда также † Дефектах эндотелия сосудов — микроангиопатиях (например, анемия гемолитическая микроангиопатическая). У детей может протекать остро в виде гемолитико-уремического синдрома. † Гемоглобинурии пароксизмальной холодовой. † Гемолизе эритроцитов, вызванном энзимопатиями. † Назначении некоторых ЛС (например, сульфаниламидов, противомалярийных препаратов). • Внутриклеточные факторы Внутриклеточные дефекты эритроцитов наследуемы (исключая пароксизмальную ночную гемоглобинурию) и заключаются в: † Аномалиях мембран (например, наследуемый сфероцитоз и эллиптоцитоз, гемоглобинурия пароксизмальная ночная). † Гемоглобинопатиях (например, серповидно-клеточная анемия). Дефект молекулы глобина способствует нарушению его полимеризации. Изменяются мембрана, форма эритроцита, увеличивается подверженность гемолизу. † Энзимопатиях. Наиболее часто встречаются: ‡ Повышенная активность аденозиндезаминазы (ген ADA, 102700, 20q13.11). ‡ Недостаточность (подробнее см. в статье «Недостаточность ферментов» в приложении «Справочник терминов» на компакт диске) аденилаткиназы, глюкозо-6-фосфат дегидрогеназы, гексокиназы, глутатион редуктазы, глутатион синтетазы, глюкозо-6-фосфат изомеразы, пируват киназы, фосфофруктокиназы и др, а также мутации неферментных белков (например, стоматоцитоз I). Патогенез гемолитических анемий Общий механизм лизиса эритроцитов (рис. 21–7) заключается в дезорганизации фосфолипидно белковой структуры их мембраны. 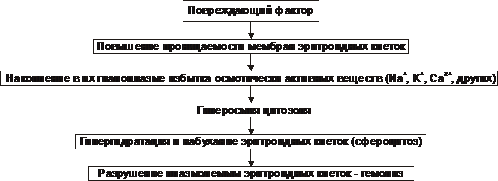 Рис. 21–7. Изменения в эритроцитах, ведущие к их гемолизу. • Механизмы повреждения мембраны Масштаб повреждений мембраны эритроцита может колебаться в широком диапазоне — от микроразрывов до декомпозиции макромолекул и образования пор. В двух последних случаях развивается каскад нижеперечисленных реакций. • Повышение проницаемости мембран клеток эритроидного ряда (от проэритробласта до зрелого эритроцита) для ионов и органических веществ. • Утрата клетками эритроидного ряда микро и макромолекулярных веществ (K+, фосфатов, ферментов и др.). • Избыточное поступление в эритроциты Na+, Ca2+, органических соединений и воды. • Высвобождение в цитозоль ионов, микро- и макромолекулярных соединений, ранее находившихся в митохондриях, эндоплазматической сети и других органоидах. • Увеличение осмоляльности внутриклеточной жидкости (за счёт ионов, метаболитов, липидов, углеводов, белков и их соединений). • Ток избытка жидкости в клетки по градиенту осмотического и онкотического давлений. • Гипергидратация эритроидных клеток, их набухание, утрата дискоидной формы, округление их (сфероцитоз). • Разрушение эритроидных клеток. ‡ Наиболее гидратированные клетки гемолизируются в просвете сосудов (внутрисосудистый гемолиз). ‡ Менее гидратированные, но с пониженной способностью к деформации клетки разрушается в капиллярах тканей, синусах селезёнки, печени, поглощается и лизируется макрофагами (внутриклеточный гемолиз). При этом высвобождающийся из эритроцитов Hb трансформируется в билирубин (см. рис. 21–2). Он циркулирует в крови, проникает в ткани, а также выводится с экскрементами и мочой. Это манифестирует развитие гемолитической желтухи со свойственными ей расстройствами функций физиологических систем организма. Гемолиз эритроцитов при первичных гемолитических анемиях обусловлен генетическим парциальным или сочетанным дефектом структуры их мембран, ферментов или Hb. В соответствии с этим выделяют мембранопатии, ферментопатии и гемоглобинопатии. • Мембранопатии. Гемолитические анемии, обусловленные мембранопатиями, характеризуются нарушением белково липидной структуры и физико химического состояния мембран эритроидных клеток. † Причина: генетический дефект мембранных или околомембранных полипептидов клеток эритроидного ряда. † Патогенез. Для гемолитических анемий, развивающихся вследствие мембранных дефектов, характерен синтез аномальных белков (белковозависимые мембранопатии) либо аномальных липидов (липидозависимые мембранопатии). † Примеры ‡ Гемолитические анемии, развивающиеся в результате белковозависимой мембранопатии: наследственный сфероцитоз (болезнь Минковского Шоффара), наследуемый эллиптоцитоз, стоматоцитоз, пиропойкилоцитоз, синдром «Rh ноль». ‡ Гемолитические анемии, развивающиеся вследствие липидозависимой мембранопатии наблюдаются при акантоцитозе. • Ферментопатии. Гемолитические анемии, обусловленные ферментопатиями, характеризуются нарушением белково липидной структуры и физико химического состояния мембран эритроидных клеток и развиваются при генных мутациях ряда ферментов. • Гемоглобинопатии. Описано большое число гемоглобинопатий, сопровождающихся проявлениями гемолитической анемии (см. далее «Талассемии», а также статью «Гемоглобинопатии» в приложении «Справочник терминов» на компакт диске). Проявления гемолитических анемий Проявления гемолитических анемий разнообразны и в значительной степени определяются конкретным заболеванием. Наиболее общие проявления представлены на рис. 21–8. 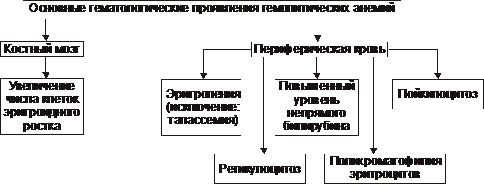 Рис. 21–8. Основные гематологические проявления гемолитических анемий. Дизэритропоэтические анемии Дизэритропоэтические анемии дифференцируют в зависимости от происхождения (рис. 21-9). 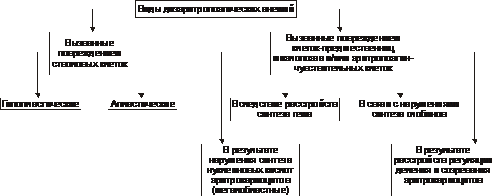 Рис. 21–9. Виды дизэритропоэтических анемий. Гипопластическая и апластическая анемии Гипо и апластические анемии, развивающиеся в результате преимущественного повреждения стволовых клеток, являются результатом подавления функции костного мозга. По происхождению эти анемии подразделяют на первичные и вторичные. • К первичным дизэритропоэтическим анемиям относится анемия Фанкони. • Ко вторичным (приобретённым) — гипо- и апластические — дизэритропоэтические анемии. Они являются результатом действия одной или нескольких групп факторов: физической природы (например, ионизирующего облучения), химической (чаще всего ЛС, например, левомицетина, бутадиона, иммунодепресантов, мепробамата, аминазина, цитостатиков и др.) или биологической природы (главным образом — вирусов, например, вызывающих гепатит, инфекционный мононуклеоз и др., а также антиэритроцитарных АТ и T-цитотоксических лимфоцитов). Патогенез † Высокие дозы ионизирующей радиации обусловливают гипоплазию костного мозга. Выраженность её зависит от дозы облучения. В основе гипоплазии кроветворной ткани лежат необратимое повреждение и гибель стволовых клеток, вплоть до их полного исчезновения, наблюдающегося при аплазии. † Химические и биологические факторы (например, вирусы и ЛС) тормозят синтез нуклеиновых кислот и белка в стволовых клетках, нарушают клеточное и/или физико химическое микроокружение стволовых клеток, что ведёт к расстройствам механизма их пролиферации, повреждают и вызывают гибель стволовых клеток в связи с образованием иммунных лимфоцитов и/или АТ. Любой из указанных механизмов (или их комбинация) обусловливает нарушение пролиферации и/или гибель стволовых гемопоэтических клеток, включая эритропоэтические. Это и ведёт к развитию гипо или апластическим анемиям. Проявления. Для гипо и апластических анемий характерны следующие изменения в костном мозге и периферической крови (рис. 21–10). 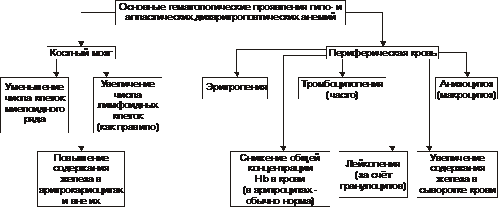 Рис. 21–10. Основные гематологические проявления гипо и апластических дизэритропоэтических анемий. Анемия вследствие нарушения синтеза глобиновых ДНК Анемии вследствие нарушения синтеза глобиновых ДНК — как правило, гиперхромные макроцитарные анемии с мегалобластным типом кроветворения. Мегалобластный эритропоэз возникает вследствие нарушения синтеза ДНК в условиях дефицита витамина B12 (цианкобаламина) или фолиевой кислоты, а также при недостаточности метионин синтетазы и дигидрофолатредуктазы. При макроцитарной мегалобластной анемии эритроидный росток костного мозга представляют аномальные эритроидные клетки — мегалобласты. В эту группу анемий входят пернициозная анемия и другие B12 дефицитные анемии, а также фолиеводефицитная анемия. Указанные анемии протекают тяжело и трудно поддаются лечению. Поэтому мегалобластные анемии ранее называли пернициозными — злокачественными (витамин B12 дефицитная анемия, в том числе анемия Аддисона–Бирмера). • Патогенез мегалобластных анемий см. в статьях «Анемии витамин В12-дефицитные», «Анемия фолиеводефицитная», «Витамин B12», «Гиповитаминоз B12», «Кислота фолиевая», «Недостаточность фолиевой кислоты» приложения «Справочник терминов» на компакт диске. • Проявления мегалобластных анемий приведены на рис. 21–11. 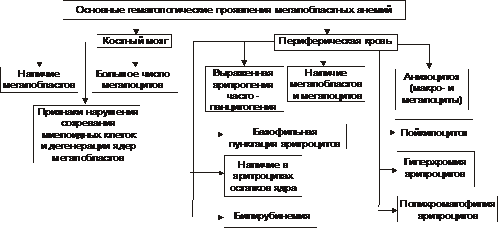 Рис. 21–11. Основные гематологические проявления мегалобластных анемий. Анемии, развивающиеся при нарушениях обмена железа К анемиям, развивающимся при нарушениях обмена железа, относят железодефицитные (сидеропенические) и железорефрактерные (сидероахрестические) анемии. • Обмен железа в организме Железо участвует в функционировании всех биологических систем. Суточная потребность в железе составляет для мужчин 10 мг, для женщин 18 мг (в период беременности и лактации — 38 и 33 мг соответственно). Общее количество железа в организме составляет 4–4,5 г. Различают клеточное железо, внеклеточное железо и железо запасов (рис. 21–12). 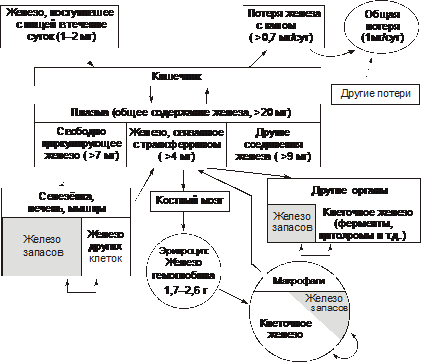 Рис. 21–12. Схема обмена железа (Fe) в организме здорового мужчины с массой тела 70 кг. Дефицит железа в организме развивается, когда потери его превышают 2 мг/сут. К этому могут привести: † Увеличение потерь железа при хронических, повторных кровопотерях (желудочных, кишечных, маточных и др.), а также массированных кровоизлияниях. † Возрастание расходования железа организмов при беременности и последующем вскармливании ребёнка (за этот период теряется в общей сложности более 800 мг железа), особенно на фоне ещё не проявляющегося клинического дефицита железа). † Снижение поступления железа в организм вследствие общего голодания, значительного уменьшения в рационе продуктов питания, содержащих железо, нарушения всасывания железа в ЖКТ (всасывается главным образом двухвалентное железо, входящее в состав гема; нарушение этого процесса развивается при хронических гастритах, энтеритах, резекциях желудка и особенно тонкой кишки). • Железодефицитные анемии † Общая и клиническая характеристика железодефицитных анемий рассмотрена в статье «Анемия железодефицитная» (приложение «Справочник терминов» на компакт диске). † Патогенез железодефицитных анемий приведён на рис. 21–13. 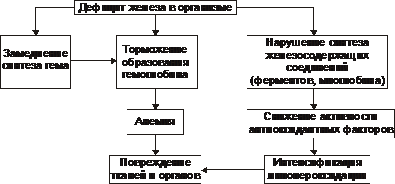 Рис. 21–13. Основные звенья патогенеза железодефицитных анемий. † Проявления железодефицитных анемий приведены на рис. 21–14. 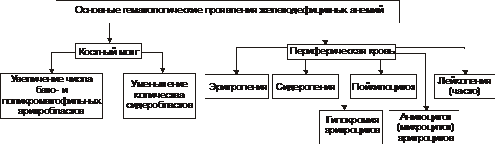 Рис. 21–14. Основные гематологические проявления железодефицитных анемий. ‡ Костный мозг. § Сохраняется нормобластический тип кроветворения. § Часто (но не всегда) наблюдаются умеренная гиперплазия клеток красного ростка гемопоэза. Увеличено число базофильных и полихроматофильных эритробластов при уменьшении количества оксифильных (признак торможения эритропоэза). § Снижено содержание депонированного в костном мозге железа и числа сидеробластов — нормобластов с гранулами железа. ‡ Периферическая кровь. § Снижено количество эритроцитов и значительно уменьшено содержание Hb (до 30–40 г/л). Это обусловливает развитие гемической гипоксии. § Цветовой показатель снижен до 0,6 и более. § Количество ретикулоцитов различно: от нормального до сниженного (при хроническом течении анемии) или повышенного (на начальных этапах анемии). § Пойкилоцитоз, анизоцитоз (много микроцитов), наличие «теней» эритроцитов (в связи со сниженным содержанием в них Hb). § Уровень железа (Fe2+) в плазме крови понижен (сидеропения) до 1,8–7,2 мкмоль/л (при норме 12–30 мкмоль/л). |
