база аналитика. analitika.docx вопросы. Перманганатометрия
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
9. Систематический анализ смеси катионов II аналитической группы. 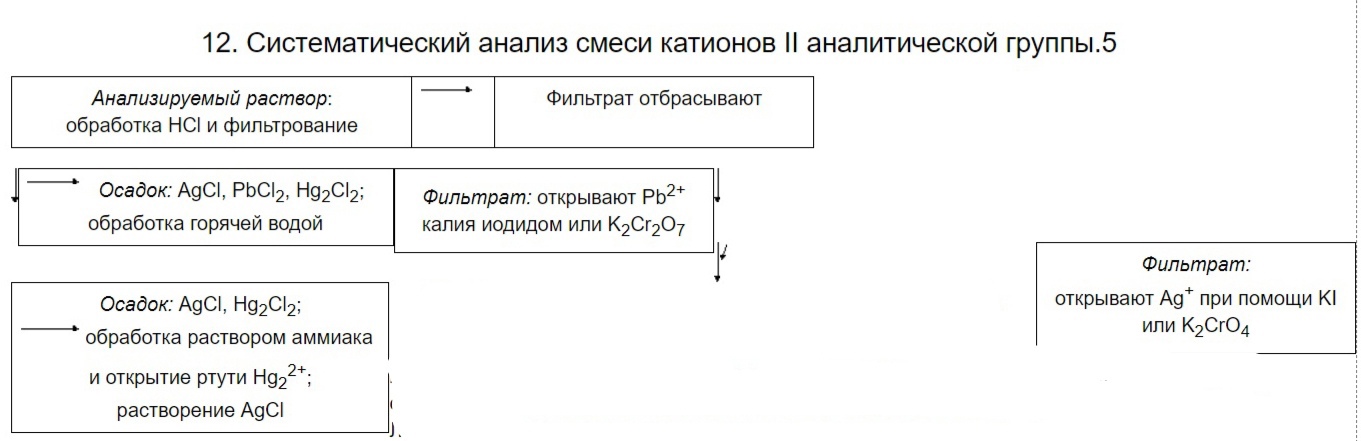 10. III аналитическая группа катионов. Общая характеристика катионов данной группы. Специфические реакции катионов Ca2+, Sr2+, Ba2+. Общая характеристика группы Гидроксиды бария, кальция, стронция являются сильными основаниями, и растворимые соли их, образованные сильными кислотами, гидролизу не подвергаются. Хорошо растворимыми солями этих катионов являются хлориды, нитраты, ацетаты. Карбонаты, сульфаты, хроматы, оксалаты и фосфаты – трудно растворимые Групповым реактивом на катионы III группы является разбавленная серная кислота. Реакции катионов бария (Ba2+) BaCl2 + H2SO4 → BaSO4↓ + 2 HCl Ba2+ + SO42‾ → BaSO4↓ BaSO4 + (NH4)2CO3 (насыщ.) → BaCO3 ↓+ (NH4)2SO4 BaSO4 + CO32‾ → BaCO3 + SO42‾ 1. Калия дихромат K2Cr2O7 образует с ионами бария осадок – хромат бария BaCrO4 желтого цвета. Cr2O72‾ + H2O ↔ 2 HCrO4‾ ↔ 2 H+ + 2 CrO42‾ 2 BaCl2 + K2Cr2O7 + H2O → 2 BaCrO4↓ + 2 KCl + 2 HCl 2 Ba2+ + Cr2O72‾ + H2O → 2 BaCrO4↓ + 2 H+ Желтый осадок бария хромата растворим в минеральных кислотах (кислотах HCl, HNO3), но нерастворим в уксусной кислоте. Работа с осадком: 2 BaCl2 + K2Cr2O7 + H2O + 2 CH3COONa → 2 BaCrO4↓ + 2 KCl + 2 CH3COOH + 2 NaCl 2Ba2+ + Cr2O72‾ + H2O + 2CH3COO‾ → 2BaCrO4↓ + 2CH3COOH 2. Аммония карбонат (NH4)2CO3 с солями бария образует аморфный белый осадок BaCO3, который постепенно переходит в кристаллический. Осадок бария карбоната легко растворяется в соляной, азотной и уксусной кислотах: BaCl2 + (NH4)2CO3 → BaCO3↓ + 2 NH4Cl Ba2+ + CO32‾ → BaCO3↓ BaCO3 + 2 CH3COOH → (CH3COO)2Ва + СО2↑ + Н2О BaCO3 + 2 CH3COOH → 2 CH3COO‾ + Ва2+ + СО2↑ + Н2О BaCO3 + 2 HCl → ВаCl2 + СО2↑ + Н2О BaCO3 + 2 H+ → Ва2+ + СО2 + Н2 3. Аммония оксалат (NH4)2C2O4 с ионами бария образует белый кристаллический осадок бария оксалата ВаC2O4, растворимый в соляной и азотной и нерастворимый в уксусной кислотах. ВaCl2 + (NH4)2C2O4 → ВaC2O4↓ + 2 NH4C Вa2+ + C2O42‾ → ВaC2O4↓ BaC2O4 + 2 HCl → ВаCl2 + Н2С2О4 BaC2O4 + 2 H+ → Ва2+ + Н2С2О4 4. Натрия гидроортофосфат Na2HPO4 образует с солями бария белый аморфный осадок ВаHPO4, растворимый в минеральных и уксусной кислотах: ВaCl2 + Na2HPO4 → ВаHPO4↓ + 2 NаCl Вa2+ + HPO42‾ → ВаHPO4↓ 2 ВаHPO4 + 2 CH3COOH → (CH3COO)2Ва + Ва(H2PO4)2 ВаHPO4 + CH3COOH → CH3COO‾ + Ва2+ + H2PO4 ВаHPO4 + 2 HCl → ВаCl2 + H3PO4 ВаHPO4 + 2 H+ → Ва2+ + H3PO4 5. Насыщенный раствор гипса CaSO4·2H2O (гипсовая вода) образует с ионами Ва2+ белый мелкокристаллический осадок бария сульфата, нерастворимый в минеральных кислотах: BaCl2 + СаSO4 → BaSO4↓ + СаCl Ba2+ + SO42‾ → BaSO4↓ Реакции катионов кальция (Cа2+ CaCl2 + H2SO4 → CaSO4↓ + 2 HCl Ca2+ + SO42‾ → CaSO4↓ 1. Аммония карбонат (NH4)2CO3 с солями кальция образует белый кристаллический осадок СaCO3, легко растворяющийся в соляной и уксусной кислотах: СaCl2 + (NH4)2CO3 → СaCO3↓ + 2 NH4Cl Сa2+ + CO32‾ → СaCO3↓ СaCO3 + 2 CH3COOH → (CH3COO)2Са + СО2↑ + Н2О СaCO3 + 2 CH3COOH → 2 CH3COO‾ + Са2+ + СО2 + Н2О СaCO3 + 2 HCl → СаCl2 + СО2↑ + Н2О СaCO3 + 2 H+ → Са2+ + СО2 + Н2О 2. Аммония оксалат (NH4)2C2O4 с ионами кальция образует белый кристаллический осадок кальция оксалата. CaCl2 + (NH4)2C2O4 → CaC2O4↓ + 2 NH4Cl Ca2+ + C2O42‾ → CaC2O4↓ Осадок не растворяется в уксусной кислоте, но растворяется в минеральных кислотах (HCl, HNO3): СaC2O4 + 2 HCl → СаCl2 + Н2С2О4 СaC2O4 + 2 H+ → Са2+ + Н2С2О4 3. Натрия гидроортофосфат Na2HPO4 образует с солями кальция белый аморфный осадок СаHPO4, растворимый в минеральных и уксусной кислотах: СaCl2 + Na2HPO4 → СаHPO4↓ + 2 NаCl Сa2+ + HPO42‾ → СаHPO4↓ 2 СаHPO4 + 2 CH3COOH → (CH3COO)2Са + Са(H2PO4)2 СаHPO4 + CH3COOH → CH3COO‾ + Са2+ + H2PO4‾ СаHPO4 + 2 HCl → СаCl2 + H3PO4 СаHPO4 + 2 H+ → Са2+ + H3PO4 4. Калия гексацианоферрат (II) K4[Fе(CN)6] в присутствии катионов аммония образует при нагревании белый кристаллический осадок двойной соли кальция-аммония гексацианоферрата (II). CaCl2 + K4[Fe(CN)6] + 2 NH4Cl → Ca(NH4)2[Fe(CN)6]↓ + 4 KCl Ca2+ + [Fe(CN)6]4‾ + 2 NH4+ → Ca(NH4)2[Fe(CN)6]↓ Реакции катионов стронция (Sr2+) SrCl2 + H2SO4 → SrSO4↓ + 2 HCl Sr2+ + SO42‾ → SrSO4↓ 1. Карбонат аммония (NH4)2CO3 при взаимодействии с растворами солей стронция осаждает карбонат стронция в виде белого осадка, растворимого в уксусной, соляной и азотной кислотах: Sr(NO3)2 + (NH4)2CO3 → SrCO3↓ + 2 NH4NO3 Sr2+ + CO32‾ → SrCO3↓ SrCO3 + 2 CH3COOH → (CH3COO)2Sr + СО2↑ + Н2О SrCO3 + 2 CH3COOH → 2 CH3COO‾ + Sr2+ + СО2 + Н2О SrCO3 + 2 HCl → SrCl2 + СО2↑ + Н2О SrCO3 + 2 H+ → Sr2+ + СО2 + Н2О 2. Аммония оксалат (NH4)2C2O4 с ионами стронция образует белый мелкокристаллический осадок стронция оксалата. Sr(NO3)2 + (NH4)2C2O4 → SrC2O4↓ + 2 NH4NO3 Sr2+ + C2O42‾ → SrC2O4↓ Осадок не растворяется в уксусной кислоте, но растворяется в минеральных кислотах (HCl, HNO3): SrC2O4 + 2 HCl → SrCl2 + Н2С2О4 SrC2O4 + 2 H+ → Sr2+ + Н2С2О4 3. Насыщенный раствор гипса CaSO4·2H2O (гипсовая вода) образует с ионами Sr2+ белый осадок стронция сульфата: Sr(NO3)2 + СаSO4 → SrSO4↓ + Са(NO3)2 Sr2+ + SO42‾ → SrSO4↓ Однако при действии гипсовой воды ион стронция дает не обильный осадок, а только небольшую муть, появляющуюся не сразу из-за образования пересыщенного раствора. Нагревание раствора ускоряет образование осадка. +Гипсовая вода не образует осадков с растворами солей кальция ни на холоду, ни при нагревании. Этим ион Ca2+ отличается от ионов Ва2+ и Sr2+. 11. Систематический анализ смеси катионов III аналитической группы. 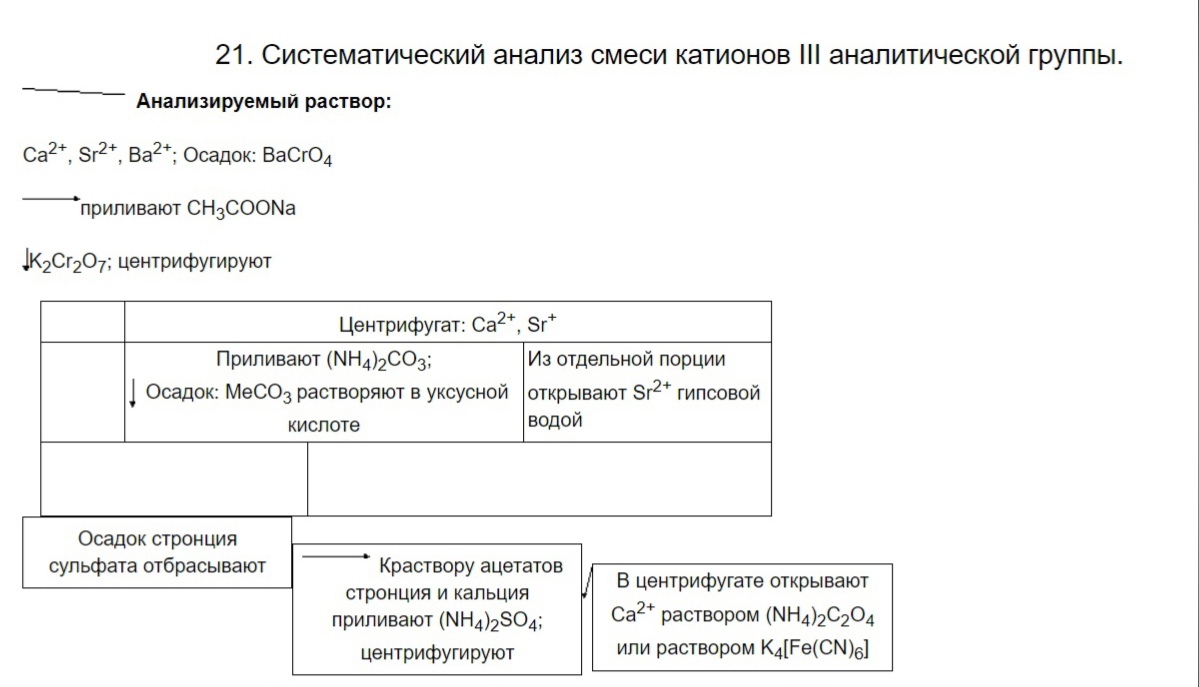 12. IV аналитическая группа катионов. Общая характеристика катионов этой группы. Специфические реакции катионов Al3+, Cr3+, Zn2+, Sn2+, Sn4+, As3+, As5+. Реакции катиона алюминия (Al3+) AlCl3 + 3 KOH → Al(OH)3↓ + 3 KCl AlCl3 + 4 NaOH → Na[Al(OH)4] + 3 NaCl Al3+ + 3 OH‾ → Al(OH)3 Al3+ + 4 OH‾ → [Al(OH)4]‾ 2. Ализарин С14Н5О2(ОН)2SО3Na в аммиачной среде образует нерастворимое в воде и уксусной кислоте соединение "алюминиевый лак", обладающее характерной оранжево-красной (яркой малиновой) окраской. пробирочный метод: к 1-2 каплям раствора K4[Fe(CN)6] добавляют 1-2 капли раствора соли алюминия, 1-2 капли раствора аммиака и 2-3 капли ализарина. Наблюдают красную окраску «алюминиевого лака». 2 AlCl3 + 3 Na2CO3 + 3 H2O → 2 Al(OH)3↓ + 6 NaCl + 3 CO2↑ 2 Al3+ + 3 CO32‾ + 3 H2O → 2 Al(OH)3 + 3 CO2 Реакции катиона хрома (Cr3+) Cr(NO3)3 + 3 NaOH → Cr(OH)3↓ + 3 NaNO3 Cr(OH)3 + 3 NaOH → Na3[Cr(OH)6] Cr3+ + 3 OH‾ → Cr(OH)3 Cr(OH)3 + 3 OH‾ → [Cr(OH)6]3‾ К 4-5 каплям раствора соли хрома приливают небольшой избыток едкой щелочи, 1-2 капли водорода пероксида и в течение 1-2 мин. нагревают до кипения, после чего его фильтруют. Фильтрат приобретает желтый цвет (обусловлен окраской аниона CrO42‾): CrCl3 + 6 KOH → K3[Cr(OH)6] + 3 KCl Cr3+ + 6 OH‾→ [Cr(OH)6]3‾ 2 K3[Cr(OН)6] + 3 H2O2 → 2 K2CrO4 + 8 H2O + 2 KOH Cr2(SO4)3 + 3 Na2CO3 + 3 H2O → 2 Cr(OH)3↓ + 3 Na2SO4 + 3 CO2↑ 2 Cr3+ + 3 CO32‾ + 3 H2O → 2 Cr(OH)3 + 3 CO2 CrCl3 + 2 Na2HPO4 → CrPO4↓ + 3 NaCl + NaH2PO4 Cr3+ + 2 HPO42‾ → CrPO4 + H2PO4‾ Реакции катиона цинка (Zn2+) 3 ZnCl2 + 2 K4[Fe(CN)6] → Zn3K2[Fe(CN)6]2↓ + 6 KCl 3 Zn2+ + 2 K+ + 2 [Fe(CN)6]4‾ → Zn3K2[Fe(CN)6]2↓ 3 ZnCl2 + 2 K3[Fe(CN)6] → Zn3[Fe(CN)6]2↓ + 6 KCl 3 Zn2+ + 2 [Fe(CN)6]3‾ → Zn3[Fe(CN)6]2↓ 2(NH4)2[Hg(SNC)4] + ZnSO4 + CuSO4 → ZnCu[Hg(SNC)4]2↓+ 2 (NH4)2SO4 осадок тетрароданомеркуратов меди и цинка 2 [Hg(SNC)4]2‾ + Zn2+ + Cu2+ → ZnCu[Hg(SNC)4]2 оливково-зеленый 2 (NH4)2[Hg(SNC)4] + ZnCl2 + CoCl2 → ZnCo[Hg(SNC)4]2↓ + 4 NH4Cl фиолетово-голубой 2 [Hg(SNC)4]2‾ + Zn2+ + Cо2+ → ZnCo[Hg(SNC)4]2 2 ZnCl2 + 2 Na2CO3 + H2O → (ZnOH)2CO3↓ + 4 NaCl + CO2↑ 2 Zn2+ + 2 CO3 2-+ H2O → (ZnOH)2CO3↓ + CO2↑ Реакции катиона олова (Sn2+) SnCl2 + 4 KOH → K2[Sn(OH)4] + 2 KCl Sn2+ + 4 OH‾ → [Sn(OH)4]2‾ 2 Bi(NO3)3 + 3 K2[Sn(OH)4] + 6 KOH → 2 Bi↓ + 3 K2[Sn(OH)6] + 6 KNO3 2 Bi3+ + 3 [Sn(OH)4]2‾ + 6 OH‾ → 2 Bi + 3 [Sn(OH)6]2‾ бархатисто-черный HgCl2 + K2[Sn(OH)4] + 2 KOH → Hg↓ + K2[Sn(OH)6] + 2 KC Hg2+ + [Sn(OH)4]2‾ + 2 OH‾ → Hg + [Sn(OH)6]2‾ темно-серый а) пробирочный метод: к 3-5 каплям раствора соли Sn2+ приливают 1-2-кратный избыток едкой щелочи и фильтруют в раствор соли Bi3+ или Hg2+. Наблюдают выпадение осадков. Sn(OH)2 + 2 KOH → K2[Sn(OH)4] Sn(OH)2 + 2 OH‾ → [Sn(OH)4]2 2 SnCl2 + K4[Fe(CN)6] + 4 H2O → 2 Sn(OH)2↓ + H4[Fe(CN)6] + 4 KCl Sn2+ + 2 H2O → Sn(OH)2 + 2 H+ 3 SnCl2 + 2 K3[Fe(CN)6] + 6 H2O → 3 Sn(OH)2↓ + 2 H3[Fe(CN)6] + 6 KCl Sn2+ + 2 H2O → Sn(OH)2 + 2 H+ SnCl4 + 4 NaNO3 + 4 H2O → Sn(OH)4↓ + 4 HNO3 + 4 NaCl Sn4+ + 4 H2O → Sn(OH)4 + 4 Н+ Sn(NO3)2 + MoO3 + 2 HNO3 → Sn(NO3)4 + MoO2 ↓+ H2O Sn2+ + MoO3 + 2 H+ → Sn4+ + MoO2 + H2O SnCl2 + Na2CO3 + H2O → Sn(OH)2↓ + 2 NaCl + CO2↑ Sn2+ + CO32‾ + H2O → Sn(OH)2 + CO2 13. Систематический анализ смеси катионов IV аналитической группы.¶V аналитическая группа катионов. Общая характеристика катионов этой группы. Характерные и специфические реакции катионов: Fe2+, Fe3+, Bi3+, Mn2+, Mg2+. 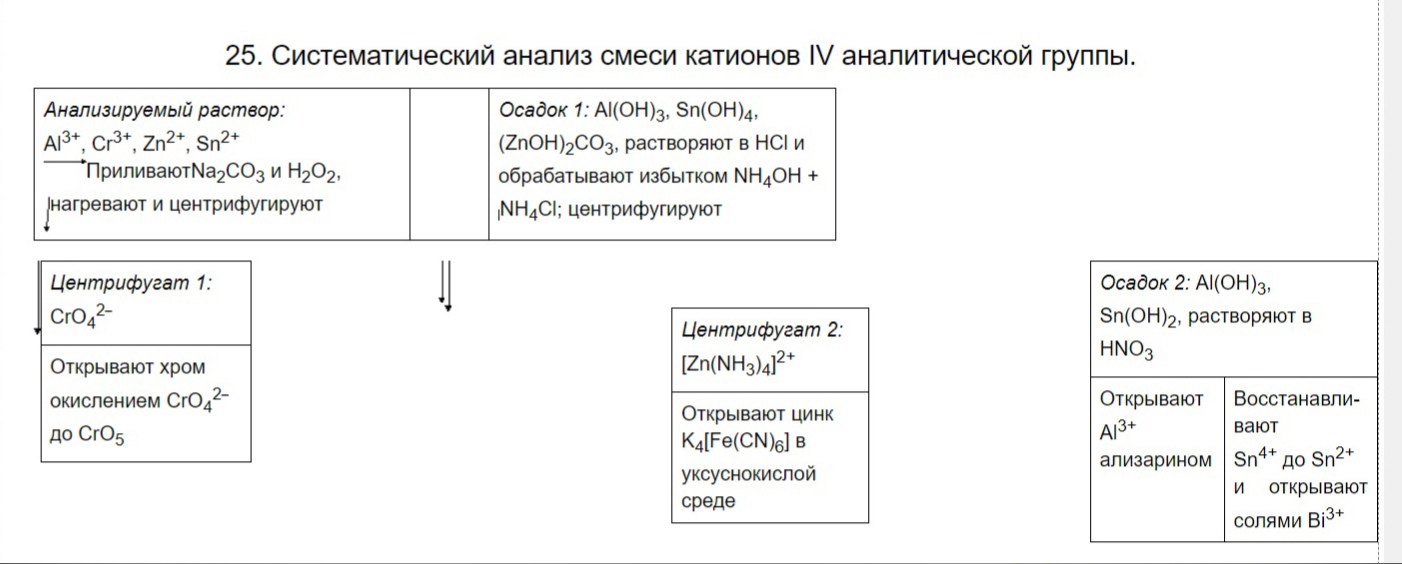 V аналитическая группа катионов. Общая характеристика катионов этой группы. Характерные и специфические реакции катионов: Fe2+, Fe3+, Bi3+, Mn2+, Mg2+ Реакции катионов железа (III) FeCl3 + 3 NH4CNS ↔ Fe(CNS)3 + 3 NH4Cl Fe3+ + 3 CNS‾ ↔ Fe(CNS)3 Калия гексацианоферрат (II) K4[Fe(CN)6] (желтая кровяная соль) образует темно-синий осадок «берлинской лазури»: 4 FeCl3 + 3 K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12 KCl 4 Fe3+ + 3 [Fe(CN)6]4‾ → Fe4[Fe(CN)6]3↓ Na2HPO4 + NH4OH + FeCl3 → FePO4↓ + 2 NaCl + NH4Cl + H2O HPO42‾ + NH4OH + Fe3+ → FePO4↓ + 2 NH4+ + H2O 2 FeCl3 + 3 (NH4)2CO3 + H2O → 2 FeOHCO3↓ + 6 NH4Cl + CO2↑ 2 Fe3+ + 3 CO32‾ + H2O → 2 FeOHCO3↓ + CO2 Работа с осадком: FeOHCO3 + 3 HCl → FeCl3 + 2 H2O + CO2↑ FeOHCO3 + 3 H+ → Fe3+ + 2 H2O + CO2 FeCl2 + 2 NH4OH → Fe(OH)2↓ + 2 NH4Cl Fe2+ + 2 NH4OH → Fe(OH)2↓ + 2 NH4+ 4 Fe(OH)2↓ + O2 + 2 H2O → 4 Fe(OH)3↓ Работа с осадком: р-м в HCl: Fe(OH)2↓ + 2 HCl → FeCl2 + 2 H2O Fe(OH)2↓ + 2 H+ → Fe2+ + 2 H2O Реакции катионов железа (II) Калия гексацианоферрат железа (III) K3[Fe(CN)6] (красная кровяная соль) образует с катионами Fe2+ осадок «турнбулевой сини»: 3 FeCl2 + 2 K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓ + 6 KCl 3 Fe2+ + 2 [Fe(CN)6]3‾ → Fe3[Fe(CN)6]2↓ 2 Na2HPO4 + 2 NH4OH + 3 FeCl2 → Fe3(PO4)2↓ + 4 NaCl + 2 NH4Cl + 2 H2O 2 HPO42‾ + 2 NH4OH + 3 Fe2+ → Fe3(PO4)2↓ + 2 NH4+ + 2 H2O FeCl2 + (NH4)2CO3 → FeCO3↓ + 2 NH4Cl Fe2+ + CO32‾ → FeCO3↓ Работа с осадком: FeCO3 + 2 HCl → FeCl2 + H2O + CO2↑ FeCl3 + 3 KOH → Fe(OH)3↓ + 3 KCl FeCO3 + 2 H+ → Fe2+ + H2O + CO2 Fe3+ + 3 OH‾ → Fe(OH)3 Работа с осадком: р-м в HCl, изб. щелочи Fe(OH)3↓ + 3 HCl → FeCl3 + 3 H2O Fe(OH)3↓ + 3 NaOH → Na3[Fe(OH)6] Fe(OH)3 + 3 H+ → Fe3+ + 3 H2O Fe(OH)3↓ + 3 ОH‾ → [Fe(OH)6]3‾ Реакция катионов марганца (Mn2+) 2MnSO4 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5Bi(NO3)3 + NaNO3 + 2Na2SO4+ 7H2O 2 Mn2+ + 5 BiO3‾ + 16 H+ → 2 MnO4‾ + 5 Bi3+ + 7 H2O + 2 H+ 2 Na2HPO4 + 2 NH4OH + 3 MnCl2 → Mn3(PO4)2↓ + 4 NaCl + 2 NH4Cl + 2 H2O 2 HPO42‾ + 2 NH4OH + 3 Mn2+ → Mn3(PO4)2↓ + 2 NH4+ + 2 H2O MnCl2 + (NH4)2CO3 → MnCO3↓ + 2 NH4C Mn2+ + CO32‾ → MnCO3↓ белый аморфный быстро выпадающий MnCl2 + 2 KOH → Mn(OH)2↓ + 2 KCl 4 Mn(OH)2↓ + O2 + 2 H2O → 4 Mn(OH)3↓ Mn2+ + 2 OH‾ → Mn(OH)2↓ Mn(OH)2↓ + H2O2 → MnO(OH)2↓ + H2O Реакции катионов висмута (Bi3+) Bi(NO3)3 + 3 KI → BiI3 ↓ + 3 KNO3 BiI3 + KI → K[BiI4] Bi3+ + 3 I‾ → BiI3 BiI3 + I‾ → [BiI4]‾ Bi(OH)3 + Na2[Sn(OH)4] → Bi↓ + Na2[Sn(OH)6] 2 Bi(OH)3 + 3 [Sn(OH)4]2‾ → 2 Bi + 3 [Sn(OH)6]2‾ Bi(NO3)3 + H2O ↔ BiONO3↓ + 2 HNO3 Bi3+ + H2O ↔ BiONO3↓ + 2 H+ Na2HPO4 + NH4OH + Bi(NO3)3 → BiPO4↓ + 2 NaNO3 + NH4NO3 + H2O HPO42‾ + NH4OH + Bi3+ → BiPO4 + 2 NH4+ + H2O 2 Bi(NO3)3 + 3 (NH4)2CO3 + H2O → 2 BiOHCO3↓ + 6 NH4NO3 + CO2↑ 2 Bi3+ + 3 CO32‾ + H2O → 2 BiOHCO3↓ + CO BiCl3 + 3 NH4OH → Bi(OH)3↓ + 3 NH4Cl Bi3+ + 3 NH4OH → Bi(OH)3↓ + 3 NH4+ Реакции катионов магния (Mg2+) MgCl2 + 2 NH4OH → Mg(OH)2↓ + 2 NH4Cl Mg(OH)2 + 2 NH4Cl → MgCl2 + 2 NH4OH Mg2+ + 2 NH4OH → Mg(OH)2 + 2 NH4+ Mg(OH)2 + 2 NH4+ → Mg2+ + 2 NH4OH MgCl2 + Na2HPO4 + NH4OH → MgNH4PO4↓ + 2 NaCl + H2O Mg2+ + HPO42‾ + NH4OH → MgNH4PO4 + H2O белый «ползущий» 2 MgCl2 + 2 (NH4)2CO3 + H2O → (MgOH)2CO3↓ + CO2 + 4 NH4Cl 2 Mg2+ + 2 CO32‾ + H2O → (MgOH)2CO3 + CO2 белый Na2HPO4 + NH4OH + MgCl2 → MgNH4PO4↓ + 2 NaCl + H2O HPO42‾ + NH4OH + Mg2+ → MgNH4PO4↓ + 2 H2O белый «ползущий» 2 MgCl2 + 2 (NH4)2CO3 + H2O → (MgOH)2CO3↓ + 2 NH4Cl + CO2↑ 2 Mg2+ + 2 CO32‾ + H2O → (MgOH)2CO3↓ + CO2 MgCl2 + 2 KOH → Mg(OH)2↓ + 2 KCl Mg2+ + 2 OH‾ → Mg(OH)2↓ Работа с осадком: р-м в HCl, солях аммония Mg(OH)2↓ + 2 NH4Cl → MgCl2 + 2 NH4OH Mg(OH)2↓ + 2 NH4+ → Mg2+ + 2 NH4OH 14. Систематический анализ смеси катионов V аналитической группы¶VI аналитическая группа катионов. Общая характеристика катионов этой группы. Характерные и специфические реакции катионов (медь, кобальт, никель).  VI аналитическая группа катионов. Общая характеристика катионов этой группы. Характерные и специфические реакции катионов (медь, кобальт, никель). Реакции катионов меди (Cu2+) 2 CuSO4 + 2 NH4OH → (CuOH)2SO4↓ + (NH4)2SO4 2 Cu2+ +SO42‾ + 2 NH4OH → (CuOH)2SO4↓ + 2 NH4+ Все осадки растворимы в минеральных кислотах, аммиаке и солях аммония (CuOH)2SO4 + 6 NH4OH + (NH4)2SO4 → 2 [Cu(NH3)4]SO4 + 8 H2O (CuOH)2SO4 + 6 NH4OH + 2 NH4+ → 2 [Cu(NH3)4]2+ + SO42‾ + 8 H2O CuSO4 + 2 KOH → Cu(OH)2↓ + K2SO4 Cu2+ + 2 OH‾ → Cu(OH)2 Эти осадки растворяются в минеральных кислотах и концентрированном растворе аммиака (кроме HgO, который в NH4OH нерастворим). CuSO4 + 2 NH4CNS → Cu(CNS)2↓ + (NH4)2SO4 Cu2+ + 2 CNS‾→ Cu(CNS)2↓ 2 Cu(CNS)2 → 2 CuCNS↓ + (CNS)2 (родан) Реакция протекает в кислой среде при нагревании. 2 CuSO4 + 2 Na2S2O3 + 2 H2O → Cu2S↓ + S↓ + 2 H2SO4 + 2 Na2SO4 2 Cu2+ + 2 S2O32‾ + 2 H2O → Cu2S↓ + S↓ + 4 H+ + 2 SO42‾ Реакции катионов ртути (Hg2+) HgCl2 + 2 NH4OH → [NH2Hg]Cl↓ + NH4Cl + 2 H2 Hg2+ + Cl‾ + 2 NH4OH → [NH2Hg]Cl↓ + NH4+ + 2 H2O [NH2Hg]Cl + 2 NH4OH (конц.) + NH4Cl → [Hg(NH3)4]Cl2 + 2 Н2 [NH2Hg]Cl + 2 NH4OH + NH4+ → [Hg(NH3)4]2+ + Cl‾ + 2 Н2О HgCl2 + 2 KOH → HgO↓ + 2 KCl + H2 Hg2+ + 2 OH‾ → HgO↓ + H2O Hg(NO3)2 + 2 KI → HgI2↓ + 2 KNO3 Hg2+ + 2 I‾ → HgI2↓ Работа с осадком: р-м в изб. HgI2 + 2 KI → K2[HgI4] HgI2 + 2 I‾ → [HgI4]2‾ Щелочной раствор K2[HgI4] применяется для открытия ионов аммония под названием реактива Несслера. Реакция на катион кадмия (Cd2+) CdCl2 + 2 NH4OH → Cd(OH)2↓+ 2 NH4Cl Cd(OH)2 + 2 NH4OH + 2 NH4Cl → [Cd(NH3)4]Cl2 + 4 H2O Cd2+ + 2 NH4OH → Cd(OH)2↓+ 2 NH4+ Cd(OH)2 + 2 NH4OH + 2 NH4+ → [Cd(NH3)4]2+ + 4 H2O CdCl2 + 2 KOH → Cd(OH)2↓+ 2 KCl Cd2+ + 2 OH‾ → Cd(OH)2↓ Cd(NO3)2 + 4 NH4OH + 2 KI → [Cd(NH3)4]I2↓+ 2 KNO3 + 4 H2O Cd2+ + 4 NH4OH + 2 I‾ → [Cd(NH3)4]I2↓ + 4 H2O Реакция на катион кобальта (Со2+) CoCl2 + NH4OH → CoOHCl↓ + NH4Cl Co2+ + Cl‾ + NH4OH → CoOHCl↓ + NH4+ CoOHCl + 5 NH4OH(изб.конц.) + NH4Cl → [Co(NH3)6]Cl2 + 6 H2O CoOHCl + 5 NH4OH + NH4+ → [Co(NH3)6]2+ + Cl‾ + 6 H2O CoCl2 + KOH → CoOHCl↓ + KCl Co2+ + OH‾ + Cl‾ → CoOHC Раб. с осадком: CoOHCl + KOH → Co(OH)2↓ + KCl CoOHCl + OH‾ → Co(OH)2↓ + Cl‾ CoCl2 + 4 NH4CNS → (NH4)2[Co(CNS)4] + 2 NH4Cl Co2+ + 4 CNS‾ → [Co(CNS)4]2 При добавлении амилового спирта на поверхность раствора всплывает интенсивно-синий спиртовой слой, окраска которого обусловлена наличием недиссоциированных молекул (NH4)2[Co(CNS)4]: а) пробирочный метод: к 3-4 каплям раствора соли Со2+ приливают избыток насыщенного раствора NH4CNS и 5 капель амилового спирта. Наблюдают темно-синий спиртовой слой. Реакция катионов никеля (Ni2+) NiCl2 + NH4OH → NiOHCl↓ + NH4Cl NiOHCl + 5 NH4OH + NH4Cl → [Ni(NH3)6]Cl2 + 6 H2O Ni2+ + Cl‾ + NH4OH → NiOHCl↓ + NH4+ NiOHCl + 5 NH4OH + NH4+ → [Ni(NH3)6]2+ + 6 H2O NiCl2 + 2 KOH → Ni(OH)2↓ + 2 KCl Ni2+ + 2 OH‾ → Ni(OH)2↓ Специфическим реактивом на катион Ni2+ является диметилглиоксим (реактив Л.А. Чугаева). +В результате этой реакции образуется внутрикомплексная соль никеля диметилглиоксимат, обладающая характерной ало-красной окраской: 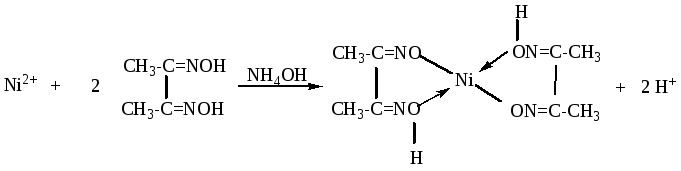 |
