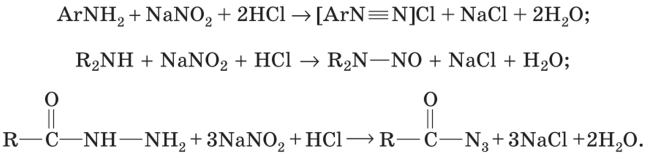|
|
база аналитика. analitika.docx вопросы. Перманганатометрия
Иодометрическое определение меди в растворах. Применение иодометрии в медицине. Определение солей меди (II) в растворах.
Аналогично определяют медь(II). Для этого к анализируемому раствору, содержащему медь(II), прибавляют серную кислоту (чтобы предотвратить образование основных солей меди(II)), избыток раствора иодида калия и оставляют смесь примерно на 10 минут в темном месте (колбу обязательно накрывают стеклом во избежание потерь паров иода). При этом протекает реакция 
Иод, образовавшийся в количестве, эквивалентном количеству прореагировавшей меди(II) в анализируемом растворе, титруют стандартным раствором тиосульфата натрия до бледно-желтой окраски раствора и прибавляют к нему несколько капель раствора крахмала. Титруемый раствор немедленно окрашивается в синий цвет. Продолжают титрование до исчезновения синей окраски титруемого раствора. Концентрация меди(II) рассчитывается аналогично тому, как было описано выше: 
В этой реакции образуется осадок иодида меди(I) CuI, вследствие чего концентрация [Сu+] понижается, реальный ОВ потенциал редокс-пары Cu2+|Cu+ возрастает , равновесие смещается вправо — в сторону образования меди(I). Титрование становится возможным.
Применяется в лабораторной диагностике, используют для определения кофеина.
В фармации комплексонометрическое титрование используют для определения препаратов Са: хлорида, глюконата, лактата кальция; препаратов Zn: оксида и сульфата цинка; сульфата магния, основного нитрата висмута и др.
Широко применяют комплексонометрию при анализе воды для определения жесткости, а также при анализе различных сплавов и минералов. Методами окислительно-восстановительного титрования в клинических и биохимических исследованиях определяют содержание ферментов каталазы, пероксидазы, аскорбиновой кислоты, сахара в крови, мочевой кислоты в моче, ионов Са2+ в сыворотке крови.
Перманганатометрию и иодометрию используют для анализа ряда химических и лекарственных препаратов. Перманганатометрия – один из лучших способов определения железа в различных объектах. Этим методом пользуются для определения общей окисляемости воды или почвы.
34. Титриметрический анализ первичных ароматических аминов (нитритометрия)
Нитритометрическое титрование представляет собой тит- риметрический метод анализа, основанный на применении в качестве титранта NaN02.
В фармацевтическом анализе нитритометрическое титрование используется для количественного определения первичных ароматических аминов (а также ароматических нитросоединений после предварительного восстановления нитрогруппы до аминогруппы), вторичных ароматических аминов и гидразидов. В основе определения первичных ароматических аминов лежит реакция диазотирования, вторичных аминов — реакция образования N-нитрозопроизводных, а гидразидов — реакция образования азидов:
 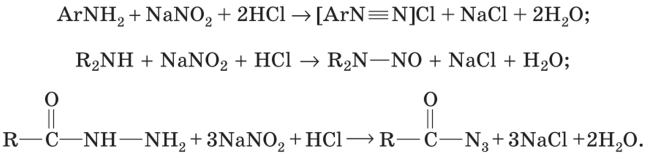
Стандартный раствор NaN02 является вторичным. В качестве первичного стандартного вещества для его стандартизации обычно используют сульфаниловую кислоту, дважды перекристаллизо- ванную из воды и высушенную при 120 °С до достижения постоянной массы. Сульфаниловая кислота малорастворима в воде, поэтому вначале ее переводят в натриевую соль путем взаимодействия с NaHC03. Затем к полученному раствору добавляют раствор НС1, КВг и титруют его стандартизируемым раствором NaN02:
 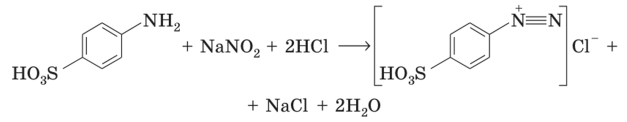
Стандартизацию раствора NaN02 можно проводить также с использованием стрептоцида, перекристаллизованного из горячей воды, либо перманганатометрически (см. § 15.9).
Конечную точку нитритометрического титрования определяют электрохимическими методами (например, потенциометрически) или визуально — с использованием внутреннего или внешнего индикатора. В качестве внутренних индикаторов применяют тропеолин 00 (или его смесь с метиленовым синим) и нейтральный красный:
 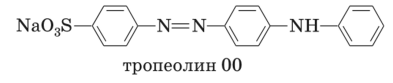
В конечной точке титрования окраска тропеолина 00 из красной переходит в бледно-желтую или вообще исчезает. Если используется смешанный индикатор, состоящий из тропеолина 00 и метиленового синего, окраска которого в процессе титрования не изменяется, то в конечной точке титрования окраска индикатора из красно-фиолетовой превращается в голубую.
Внешним индикатором при нитритометрическом титровании служит полоска фильтровальной бумаги, пропитанная растворами KI и крахмала и затем высушенная (иодидкрахмальная бумага). Каплю титруемого раствора наносят на иодидкрахмальную бумагу с помощью стеклянной палочки. Титрование можно считать законченным, если капля титруемого раствора, взятая через 1 мин после добавления очередной порции титранта, вызывает (немедленно!) синее окрашивание бумаги. Такое окрашивание свидетельствует о появлении в титруемом растворе избытка NaNC>2, который окисляет KI:
 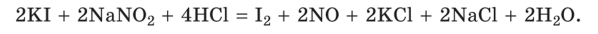
Образовавшийся иод затем взаимодействует с крахмалом.
Иодидкрахмальная бумага непригодна для обнаружения конечной точки титрования, если в растворе присутствуют ионы Fe3+ (металлическим железом часто пользуются при восстановлении нитросоединений до ароматических аминов).
Нитритометрическое титрование проводят в кислой среде (НС1). В случае определения первичных ароматических аминов используют катализатор (КВг). Взаимодействие NaN02 с титруемым органическим веществом требует времени, поэтому добавление титранта следует проводить медленно. Вначале титрант добавляют со скоростью 2 мл в минуту, а в конце титрования (примерно за 0,5 мл до достижения эквивалентного количества) — 1 капля в минуту. Титрование проводят при температуре 15-20 °С (в некоторых случаях при охлаждении до 0-5 °С). Выбор такого температурного интервала обусловлен тем, что при более высоких температурах может происходить разрушение образующихся продуктов реакции (солей диазония), а при более низких — уменьшение скорости и без того медленного взаимодействия титранта с определяемым веществом.
Нитритометрическое титрование является фармакопейным методом определения первичных ароматических аминов, например сульфаниламидов или производных тг-аминобензойной кислоты (бензокаина, прокаина). Нитритометрическому определению может предшествовать гидролиз определяемого вещества или восстановление нитрогруппы (см. § 5.2).
Пример 15.9. Навеску массой 0,4034 г порошка растертых таблеток, содержащих парааминосалицилат натрия, лекарственное средство, используемое при лечении туберкулеза, растворили в смеси воды и хлороводородной кислоты. К полученному раствору добавили 1 г КВг. Для титрования было израсходовано 11,50 мл 0,0977 М NaN02. Вычислите массу парааминосалици- лата натрия (М = 211,2 г/моль) в пересчете на среднюю массу одной таблетки, если известно, что масса 20 таблеток составила 17,200 г.
Решение
В молекуле л-аминосалициловой кислоты имеется одна аминогруппа, а значит, это вещество взаимодействует с NaN02 в молярном соотношении 1:1, т.е.
 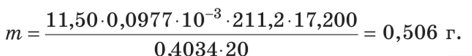
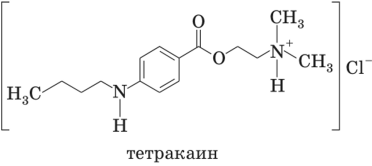
Кроме первичных ароматических аминов нитритометрически могут быть количественно определены вторичные ароматические амины (например, местный анестетик тетракаин) и гидразиды (например, изониазид — см. 15.4.3):
Нитритометрические определения могут быть также основаны на реакциях восстановления нитрит-иона до оксида азота (II) или, наоборот, окисления его до нитрат-иона, например: 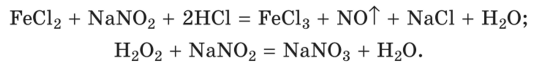
В основу нитритометрического определения фенолов (фенола, резорцина) может быть положена реакция нитрозирования. Однако широкого практического применения подобные методики не находят.
35. Теоретические основы комплексонометрического титрования. Условия проведения комплексонометрического определения содержания металлов в растворе. Комплексоны, их особенности.
Комплексометрия — титрование вещества раствором такого соединения, которое образует с титруемым веществом слабо диссоциирующий (т.е. устойчивый) растворимый комплекс. Метод чаще всего применяется для определения катионов металлов-комплексообразователей. Реакцию комплексообразования, лежащую в основе метода, можно представить в виде (без указания зарядов реагентов): 
где М — катион металла-комплексообразователя — обычно (но не всегда) определяемый компонент X анализируемого раствора; L — лиганд, находящийся в растворе титранта Т; MLn — продукт реакции, представляющий собой комплекс.
Окончание титрования фиксируют либо визуально с помощью индикаторов, либо потенциометрически.
Реакции, используемые в комплексиметрии, должны отвечать основным требованиям.
1) Стехиометричность. В реакции должен образовываться один продукт точно определенного состава. Побочные реакции должны отсутствовать.
2) Полнота протекания реакции. Реакция, лежащая в основе титрования, должна протекать практически до конца, т.е. не менее чем на 99,99%.
3) Реакция комплексообразования должна протекать быстро; равновесие должно устанавливаться практически мгновенно.
4) Реакция должна обеспечивать отчетливую фиксацию КТТ (конечной точки титрования).
Изменение окраски раствора в конечной точке титровании должно быть контрастным. Согласно учению о цвете, предельные цвета, т.е. исходные (окраска чистого МеInd) и конечные (окраска чистого Ind) должны быть по возможности дополнительными – взаимно дополнять друг друга до белого цвета.
Дополнительными цветами, например, являются: красный – сине-зеленый; оранжевый – синий; желтый – синий; желто-зеленый – фиолетовый и т.д. Индикатор, окраска которого изменяется от одного дополнительного цвета к другому, в промежуточной точке становится бесцветным (или серым), т.к. цветовые тона взаимно погашают друг друга. Поэтому такую точку особенно легко заметить. Большинство применяемых металлоиндикаторов лишь в редких случаях изменяют свой цвет на дополнительный. Чтобы достичь максимального цветового эффекта, используют смешанные индикаторы, т.е. к металлоиндикатору добавляют индифферентный краситель, создающий цветовой фон, вследствие чего предельные окраски до и после конечной точки титрования становятся дополнительными. Например, для титрования ионов Ca предложена смесь мурексида и нафтолового зеленого В: переход окраски от оливково-зеленой через красновато-серую к чисто синей.
В последнее время в медико-биологических лабораториях широко применяют методы анализа, основанные на использовании реакций, которые сопровождаются образованием комплексных соединений катионов с органическими реактивами – комплексонами. Образующиеся соединения называют внутрикомплексными (клешневидными, хелатными) солями.
Комплексонами обычно называют органические соединения, представляющие собой производные аминополикарбоновых кислот
36. Комплексиметрическое определение ионов кальция, ионов магния (уравнения реакции, характеристика метода).
Комплексонометрическое определение кальция основано на прямом методе титрования его ионов стандартным раствором комплексона ΙΙΙ в присутствии мурексида или кислотного хром темно-синего. Индикатор образует с ионами кальция комплексное соединение красного цвета. При титровании раствора комплексоном ΙΙΙ в точке эквивалентности красная окраска переходит в окраску, характерную для свободного индикатора.
Титрование солей кальция раствором ЭДТА нужно проводить в сильно щелочной среде при pH>12. В этом случае достигается полная нейтрализация образующейся в процессе титрования свободной кислоты и наблюдается максимальный скачок кривой титрования.
Ход определения. В мерную колбу вместимостью 100 мл возьмите (у преподавателя) определенный объем анализируемой смеси. Раствор доведите до метки дистиллированной водой и тщательно перемешайте. Из колбы отбирают аликвотную часть полученного раствора, добавляют 50 мл дистиллированной воды, 5 мл аммиачной буферной смеси, 2-3 капли эрихром черного Т (или кислотного хром темно-синего) и титруйте 0,05н. стандартным раствором комплексона ΙΙΙ до перехода вино-красной окраски раствора в фиолетово-синюю. Под конец титрование проводят очень медленно. Добейтесь, чтобы красноватый оттенок полностью исчез. Повторить титрование 2-3 раза.
Для определения содержания ионов кальция вновь отбирают аликвотную часть раствора, добавляют 2,5 мл 2н раствора NaOH, доводят общий объем до 100 мл, вносят индикатор и медленно тируют стандартным раствором ЭДТА до перехода красно-розовой окраски в сине–фиолетовую, не исчезающую в течение 3 минут. Повторить титрование 3 раза и из сходящихся отсчетов возьмите среднее.
Вычисления:
Общую жесткость раствора определяют по формуле:
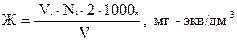
Содержание ионов кальция вычисляют по формуле:
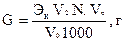
Содержание ионов магния вычисляют по формуле:
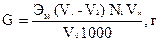
где: Э – эквивалент кальция и магния
V1 – объема комплексона ΙΙΙ, пошедший на титрование смеси магния и кальция, мл
V2 – объем комплексона ΙΙΙ, пошедший на титрование кальция, мл
Vk – объем мерной колбы, мл
V0 – объем пробы, взятой на титрование, мл
2 – коэффициент, учитывающий валентность кальция и магния;
N1 – нормальность раствора комплексона ΙΙΙ.
37.Металлохромные индикаторы. Этилендиаминтетрауксуная кислота и ее динатриевая соль (ЭДТА) как реагенты в хелатометрии. Хелатометрическое определение кальция, магния и жесткости воды. Применение методов комплексонометрии в медико-биологических исследованиях.
В комплексонометрическом титровании конечную точку титрования устанавливают как визуально, так и с использованием инструментальных методов анализа.
При визуальном способе установлении конечной точки применяют металлоиндикаторы(это индикаторы, изменяющие окраску в зависимости от концентрации иона Ме). Металлоиндикаторы – обычно органические соединения, которые с ионами титруемого металла образуют окрашенные комплексы. Их обычно делят на 2 группы:
индикаторы, которые сами не имеют окраски, но образуют с ионами Ме окрашенные комплексы (например, при комплексонометрическом титровании Fe(III) в качестве индикатора используют салициловую или сульфосалициловую кислоту, тайрон; при определении Bi(III) – тиомочевину). Комплексы Fe(III) с салициловой кислотой (с молярным соотношением 1:1) окрашены в красный цвет, с тайроном – в зеленый. Тиомочевинные комплексы с Bi (III) окрашены в желтый цвет. Интенсивность окраски образующихся комплексов обычно невысока. Поэтому, чтобы наблюдать окраску комплекса, концентрация индикатора должна быть ≈ в 10 раз больше концентрации титруемого Ме.
органические соединения, содержащие в своих молекулах хромофорные группы, следовательно, окрашенные и образующие с ионами Ме внутрикомплексные соединения, по цвету отличающиеся от самих индикаторов. Эти индикаторы называются металлохромные.
Рингбом предложил делить индикаторы на 3 группы:
а) индикаторы, содержащие азогруппу –N=N– . Например, эриохромовый черный Т (при рН 9-10 используется для определения Mg2+, Ba2+, Cd2+, Pb2+, Zn2+, Mn2+, Sr2+); и кислотный хромовый темно-синий (Mn2+, Mg2+, Zn2+, Pb2+, Ca2+);
б) индикаторы, относящиеся к классу трифенилметановых красителей. Например, ксиленоловый оранжевый (при рН 1,5-3: Bi3+, Fe3+; при рН 5-7: Cd2+, Co2+, Cu2+, Hg2+, Zn2+); пирокатехиновый фиолетовый ( при рН 2-4:Bi3+, Ti4+; рН 5-6: Cu2+, Fe3+, Pb2+);
в) прочие индикаторы – мурексид (при рН 8-9: Co2+, Ca2+, Zn2+, Ni2+), дитизон, ализарин.
Определение катионов кальция Са2+. Катионы кальция определяют титрованием анализируемого раствора, содержащего Са2+, стандартным раствором ЭДТА в присутствии различных индикаторов: хромового темно-синего (в аммиачном буфере) — в ТЭ вишнево-красная окраска раствора переходит в сине-фиолетовую; мурексида (в щелочной среде при рН >12) — в ТЭ красная окраска раствора переходит в фиолетовую.
Титрование в присутствии мурексида проводят следующим образом. К анализируемому раствору, содержащему катионы Са2+, прибавляют 10%-ный раствор NaOH до рН > 12, небольшое количество индикаторной смеси мурексида до появления розовой окраски раствора и титруют стандартным раствором ЭДТА до изменения розового цвета титруемого раствора в сине-фиолетовый.
Определение катионов магния и кальция при их совместном присутствии. Вначале в отдельной пробе анализируемого раствора определяют сумму катионов Mg2+ и Са2+ титрованием анализируемого раствора в аммиачном буфере (рН
10) стандартным раствором ЭДТА в присутствии индикатора эриохрома черного Т до перехода красной окраски титруемого раствора в фиолетово-синюю вследствие разрушения комплекса магния с индикатором.

Затем в другой пробе анализируемого раствора определяют кальций. К раствору прибавляют щелочь для осаждения магния в виде гидроксида Mg(OH)2. Катионы кальция остаются в растворе. Их определяют титрованием стандартным раствором ЭДТА в присутствии индикатора мурек сида до перехода красной окраски титруемого раствора в сине-фиолетовую вследствие разрушения комплекса кальция с индикатором.
Широкое распространение получила комплексонометрия в медико-биологических работах. Этот метод необходим для определения в живых организмах кальция, магния и многих микроэлементов. Комплексонометрию применяют также при анализе лекарственного сырья и воды.
В биологии и медицине комплексоны применяют не только в аналитических целях. Их используют как стабилизаторы при хранении крови, так как они связывают ионы металлов, катализирующие реакции окисления. При профессиональных заболеваниях с помощью комплексонов из организма выводят ионы токсичных металлов, радиоактивные изотопы и продукты их распада. Имеются сведения об успешном применении комплексонов для растворения камней, образующихся в почках, печени и желчном пузыре.
|
|
|
 Скачать 1.23 Mb.
Скачать 1.23 Mb.