база аналитика. analitika.docx вопросы. Перманганатометрия
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
38. Количественное определение йода методом титриметрии Титриметрический метод анализа – один из наиболее распространенных способов количественного определения йода. Он рекомендован для определения йода в питьевой воде , хлебе и хлебобулочных изделиях ,в пищевой поваренной соли йодатом калия и применяется в ряде стран . при оценке абсорбированного и связанного по двойным связям йода в маслах и жирах . Он простот и доступноступен к выполнению в любых условиях , имеет высокую чувствительность при определении всех форм йода – молекулярного, йодидов и йодатов. В качестве титранта чаще всего используется тиосульфат натрия (в присутствии крахмала в качестве индикатора). Йодометрическое титрование лежит в основе количественного определения, как йодатов, так и и йодидов .В раствор, содержащий йодат , добавляется избыточное количество калия йодида для высвобождения свободного йода, количественного определение которого проводится титриметрически . Количественное определение йодидов в растворе также осуществляется титриметрическим методом, йодиды вначале окисляются бромом в кислой среде до йодатов ,которые восстанавливаются с помощью йодидов в кислой среде до молекулярного йода и оттитровывается тиосульфатом натрия в кислой среде . Йодометрическое титрование необходимо осуществлять на холоде, так как при повышенных температурах наблюдается потеря йода вследствие его улетучивания из раствора. ИНСТРУМЕНАЛЬНЫЙ АНАЛИЗ.¶ 39. Общая характеристика физико-химических методов анализа, их классификация. Теоретические основы оптических и электрохимических методов анализа. Использование инструментальных методов при исследовании биологических систем и процессов. Физико-химическими называют методы количественного анализа, основанные на измерении физико-химических и физических свойств данного вещества. Их вместе с физическими методами анализа называют инструментальными, т.к. они требуют применения приборов и измерительных устройств. В основе физико-химических методов количественного анализа лежит химическая реакция или физико-химический процесс. Характерная особенность физических методов заключается в том, что в них измеряют физические параметры без предварительного проведения химической реакции. В зависимости от измеряемых характеристик различают следующие группы физико-химических методов: 1. Оптические (спектральные), основанные на измерении оптических свойств анализируемых систем ( на взаимодействии веществ с электромагнитным полем). Они позволяют определять структуру, геометрию и полярность молекул, длины связей, а также количество вещества по интенсивности полос в спектре. 2. Электрохимические, основанные на измерении электрохимических свойств. Позволяют проводить анализ растворов электролитов. 3. Физико-химические методы разделения и концентрирования (хроматография, ионный обмен, диализ, электрофорез). 4. Радиометрические, основанные на измерении радиоактивности исследуемых объектов. 5. Масс-спектрометрические, основанные на ионизации атомов и молекул изучаемого вещества с последующим разделением образующихся ионов в пространстве и определения их масс. Позволяют определять состав и строение молекул, энергию тонизации, а также характеристики обратимых процессов. Физико-химические методы анализа имеют следующие достоинства:
физико-химические методы дают возможность работать с ненарушенными образцами, поэтому они нашли широкое применение в биологии и медицине. 40. Спектрофотометрический метод. Его сущность. Основные законы светопоглощения – законы Бугера-Ламберта и Бера. Оптическая плотность и пропускание. Выбор оптимальных условий проведения фотометрической реакции. Спектрофотометрический методанализаоснован на спектрально-избирательном поглощении монохроматического потока световой энергии при прохождении его через исследуемый раствор. Метод позволяет определять концентрации отдельных компонентов смесей окрашенных веществ, имеющих максимум поглощения при различных длинах волн. К оптическим (спектральным) методам анализа относятся методы, основанные на взаимодействии электромагнитного излучения с веществом. Это взаимодействие приводит к различным энергетическим переходам, которые регистрируются экспериментально в виде поглощения, излучения, отражения и рассеяния электромагнитного излучения. Электромагнитное излучение может быть охарактеризовано следующими параметрами: – длина волны (λ) – расстояние между двумя максимумами волны, м, нм, мкм. λ 1 нм = 10‾9 м 1м   км = 10‾6 м км = 10‾6 м– частота (ν) – число колебаний в 1 секунду, с‾1 или Гц. 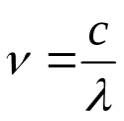 ( ( 2) 2)где с – скорость света в вакууме (2,9979∙108 м/с). –в  олновое число ( олновое число ( ) – число длин волн, приходящихся на 1 см пути излучения в вакууме, см‾1. ) – число длин волн, приходящихся на 1 см пути излучения в вакууме, см‾1.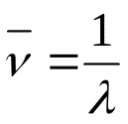 (3) (3)– энергия излучения (Е), Дж или эВ. Е = hν, (4) где h – постоянная Планка (6,626∙10‾34 Дж∙с). Важнейшей характеристикой электромагнитного излучения является его спектр, т.е. совокупность различных значений, которые может принимать данная физическая величина. Совокупность всех частот или длин волн электромагнитного излучения называется электромагнитным спектром. Интервал длин волн от 10‾10 до 10‾1 м разбивают на области:  Ультрафиолетовая область (УФ) охватывает диапазон 10-380 нм, инфракрасная область (ИК) – 750-1·105 нм, видимый свет занимает узкую область – 380-750 нм. закон светопоглощения Бугера-Ламберта-Бера: при прохождении светового потока через поглощающий раствор интенсивность прошедшего светового потока (I) отличается от интенсивности падающего светового потока (Io) на поглощение света раствором. Обычно Т выражают в %:  D –  – важная характеристика раствора, называется оптической плотностью. – важная характеристика раствора, называется оптической плотностью.Т – I/Io называется пропусканием раствора. 41. Основы фотометрического анализа. Фотометрические методы определения одного вещества в растворе (метод градуировочного графика, метод добавок, метод сравнения оптический плотности стандартного и исследуемого окрашенных растворов). ¶Фотометрическое определение железа (III) сульфосалициловой кислотой. Фотометрический анализ раствора перманганата калия. Фотометрический анализ дихромата калия по собственному поглощения. Фотометрический анализ (молекулярная абсорционная спектроскопия) основан на способности вещества поглощать электромагнитные излучения оптического диапазона. В основе фотометрического анализа лежит избирательное поглощение света частицами (молекулами и ионами) вещества в растворе. При некоторых длинах волн свет поглощается интенсивно, а при некоторых – не поглощается совсем. Методы фотометрического анализа ф   отоколориметрия спектрофотометрия отоколориметрия спектрофотометрияанализ на основе измерения анализ на основе измерения поглощения излучения видимой поглощения УФ, видимой и области спектра ИК областей спектра Прибор: Прибор: спектрофотометр фотоэлектроколориметр (ФЭК) Фотоколориметрические методы широко распространены в работе клинических лабораторий для количественного определения йода, азота, мочевой кислоты в моче, билирубина и холестерина в крови и желчи, гемоглобина в крови и т.д. В санитарно-гигиеническом анализе колориметрия применяется для определения аммиака, фтора, нитратов и нитритов, солей железа, витаминов и других веществ. Фотоколориметрический метод анализа основан на сравнении интенсивности окраски исследуемого раствора с окраской раствора, концентрация которого неизвестна. Раствор с известной концентрацией называется стандартным или образцовым раствором. Этим методом можно анализировать лишь окрашенные растворы. Если раствор бесцветный, то в него добавляют реагент, образующий окрашенное соединение с исследуемым веществом (фотометрическая реакция). исслед. в-во + реагент ↔ окраш. соед. Cu2+ + 4NH3 ↔ [Cu(NH3)4]2+ Fe3+ +6CN- ↔ [ Fe(CN)6]3- Существуют различные методы фотоколориметрического определения вещества в растворе: 1. Метод калибровочного (градуировочного) графика. Готовят серию из 5-8 стандартных растворов разных концентраций, измеряют их оптическую плотность, строят график в координатах Д–С. Затем измеряют поглощение анализируемого раствора и по графику определяют его концентрацию (см. рис. 4).  График зависимости оптического поглощения от концентрации График зависимости оптического поглощения от концентрации2. Метод добавок. К анализируемому раствору добавляют точную навеску вещества. Измерив оптическую плотность раствора с добавкой (D) и без добавки (D0), рассчитывают концентрацию анализируемого раствора (С0):  3. Метод стандартных растворов. Оптическую плотность исследуемого раствора (DX) сравнивают с оптической плотность стандартного раствора (Dст.) этого же вещества. Неизвестную концентрацию исследуемого раствора (СХ) рассчитывают по формуле:  где Сст.– концентрация стандартного раствора, моль/л. где Сст.– концентрация стандартного раствора, моль/л.52. Анализ смеси ЛС методом ТСХ. Тонкослойная хроматография — хроматографический метод, основанный на использовании тонкого слоя адсорбента в качестве неподвижной фазы. Он основан на том, что разделяемые вещества по-разному распределяются между сорбирующим слоем и протекающим через него элюентом, вследствие чего расстояние, на которое эти вещества смещаются по слою за одно и то же время, различается. Тонкослойная хроматография предоставляет большие возможности для анализа и разделения веществ, поскольку и сорбент, и элюент могут варьироваться в широких пределах. В ТСХ используют стеклянные, металлические или пластмассовые пластинки, покрытые тонким слоем сорбента. Пластинку помещают в камеру (кювету), содержащую небольшое количество соответствующей жидкой подвижной фазы (элюента), которая перемещается по слою под действием капиллярных сил. При этом компоненты образца перемещаются через слой с различными скоростями, зависящими от адсорбционных коэффициентов компонентов смеси. Проявление заканчивают, удаляя пластинку из камеры и испаряя подвижную фазу. Количественной мерой скорости переноса вещества при использовании определенного сорбента и элюента является величина Rf = 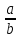 ИЛИ Тонкослойная хроматография (ТСХ) - один из наиболее широко используемых хроматографических методов - имеет огромное значение для быстрого качественного анализа смесей, контроля реакций и определения рабочих параметров, которые следует использовать в препаративной колоночной хроматографии. Разделение производят на плоской пластинке, покрытой тонким слоем сорбента - силикагелем или оксидом алюминия. Разделяемую смесь, растворенную в соответствующем растворителе, наносят в виде капель на пластинку и после испарения растворителя помещают пластинку в проявительную камеру, в которую налито немного растворителя. Растворитель поднимается по слою сорбента под действием капиллярных сил. При этом различные соединения, находящиеся в смеси, поднимаются с разными скоростями в зависимости от их сродства к сорбенту. По достижении растворителем верхнего слоя сорбента соединения в идеальном случае должны полностью разделиться. Процесс разделения - это одна из форм жидкостно-адсорбционной хроматографии. Пластинки для ТСХ состоят из подложки обычно стекла, а иногда пластмассы или толстой алюминиевой фольги, на которую нанесен тонкий слой сорбента толщиной примерно 0,25 мм. Пластинки бывают двух основных типов: многоразового использования и одноразовые. Образец обычно наносят с помощью капилляра в виде 1 - 2%-ного раствора в летучем растворителе типа дихлорметана или эфира. Важно также наносить капли достаточно далеко от нижнего края, чтобы они не погружались в проявляющий растворитель. Хроматограмму проявляют погружением нижнего края пластинки в проявляющий растворитель в сосуде соответствующего размера. Когда фронт растворителя поднимется почти до верха пластинки, выньте ее из камеры и сразу же карандашом или шпателем отметьте положение фронта растворителя. Высушите пластинку в вытяжном шкафу. Если соединения в образце окрашены, то после проявления их легко различить визуально, однако для бесцветных соединений требуется какой-либо метод визуализации. Наиболее употребительный метод - введение в слой сорбента неорганического флуоресцентного агента (0,5 %). При освещении такой пластинки УФ-лампой сорбент начинает светиться бледно-зелёным или голубым светом, а органические соединения, которые гасят флуоресценцию, выделяются в виде темных пятен. Еще один распространенный метод визуализации состоит в использовании склянки с йодом. 51. Разделение смеси веществ методом бумажной хроматографии Хроматография на бумаге является разновидностью метода распределительной хроматографии, носителем для неподвижного растворителя служит при этом фильтровальная бумага, а не колонка с сорбентом. Разделение веществ происходит вследствие различия в распределении между двумя жидкими фазами, одна из которых подвижна (смесь органических растворителей), а другая — неподвижная и представляет собой воду, находящуюся в волокнах фильтровальной бумаги. Разделение смесей веществ или ионов с помощью хроматографии на бумаге основано на различной скорости движения компонентов, которые характеризуются коэффициентом движения Rf. 50. Хроматографические методы анализа. Ионообменная, газовая и жидкостная хроматография. Использование в качественном и количественном анализе. Хроматография – это физико-химический метод разделения веществ, основанный на распределении компонентов между двумя фазами – неподвижной и подвижной. Неподвижной (стационарной) фазой служит твердое вещество (сорбент) или пленка жидкости, нанесенная на твердое вещество; подвижной фазой – жидкость или газ. Подвижную фазу, вводимую в слой неподвижной фазы, называют элюентом, а подвижную фазу, выходящую из колонки и содержащую разделенные компоненты, – элюатом. Ионообменная хроматография относится к жидкостно-твердофазной хроматографии, в которой подвижной фазой является жидкость (элюент), а неподвижной фазой – твердое тело (ионообменник). В основе метода ионообменной хроматографии лежит динамический процесс замещения ионов, связанных с неподвижной фазой, ионами элюента, поступающими в колонку. Разделение происходит благодаря разному сродству к ионообменнику ионов, находящихся в смеси, что приводит к различным скоростям их перемещения по колонке. Cпособы количественного анализа в хроматографии 1. Метод нормировки. Для его использования необходимо, чтобы на хроматограмме были зарегистрированы все компоненты, входящие в состав анализируемой смеси. Доля площади пика соответствует содержанию компонента в массовых процентах. При анализе смеси 3х компонентов содержание компонента, например, соответствующего пику х на хроматограмме, можно рассчитать по формуле: 2. Метод внешнего стандарта. Метод используют при определении отдельных веществ или анализе простых смесей, а также микропримесей. Готовят два стандартных раствора определяемых компонентов, одинаковые их количества вводят в хроматограф и определяют площади пиков (или высоту) каждого компонента S1, Sx и S2. Далее по двум ограничивающим точкам или по большему числу точек строят зависимости площади пика от содержания определяемого компонента в стандартных растворах (градуировочный график). 3. Метод внутреннего стандарта. Его применяют при отсутствии на хроматограмме пиков некоторых компонентов анализируемой смеси. B анализируемую смесь вводят некоторое количество стандартного вещества. Это вещество должно быть химически инертным, отсутствовать в анализируемой пробе и полностью отделяться от других компонентов смеси. Время его удерживания должно быть близким к tR определяемых компонентов. Его концентрация должна быть близка к концентрациям определяемых компонентов. Определяют площади пиков и для каждого компонента рассчитывают поправочный коэффициент по формуле: Во время качественного способа пробу идентифицируют на хроматографе, сравнивая значения с эталонными (которые сохраняются в библиотеке данных). В частности, используется идентификация по времени выхода пика или по логарифмической шкале удерживания. Газовая хроматография — физико-химический метод разделения веществ, основанный на распределении компонентов анализируемой смеси между двумя несмешивающимися и движущимися относительно друг друга фазами, где в качестве подвижной фазы выступает газ (газ-носитель), а в качестве неподвижной фазы - твердый сорбент или жидкость, нанесенная на инертный твердый носитель или внутренние стенки колонки. ( Качественный состав вещества может быть установлен с помощью хроматографической методики по характеристикам полученной хроматограммы или по результатам анализа компонентов смеси после прохождения хроматографической колонки подходящим химическим или физико-химическим методом. Каждому компоненту смеси отвечает свой пик, последовательность появления пиков на хроматограмме закономерна: она соответствует последовательности кислот в гомологическом ряде. Собственно качественный анализ основан на использовании характеристик удерживания: времени удерживания или пропорционального ему объёма удерживания и индексов удерживания. Для этой цели применяются относительные удерживаемые объёмы, которые в значительно меньшей степени, чем абсолютные величины, подвержены действию случайных факторов. Идентификация исследуемых веществ проводится сравнением полученных и табличных данных. Количественный хроматографический анализ основан на измерении различных параметров пика, зависящих от концентрации хроматографируемых веществ - высоты, ширины, площади и удерживаемого объёма - или произведения удерживаемого объёма на высоту пика. При достаточной стабильности условий хроматогрфирования и детектирования определяющим параметром пика можно считать его высоту.) Жидкостная хроматография - это вид хроматографии, в котором подвижной фазой, называемой элюентом, является жидкость. Неподвижной фазой может быть твердый сорбент, твердый носитель с нанесенной на его поверхность жидкостью или гель. В ЖХ разделение чаще всего происходит при комнатной температуре. Молекулы жидкой фазы могут сорбироваться на поверхности неподвижной фазы. При прохождении через колонку находящиеся в элюенте молекулы интересуюшего нас компонента должны вытеснить молекулы элюента с поверхности сорбента. Применяя различные элюенты, можно изменять параметры удерживания и селективность хроматографической системы. |
