база аналитика. analitika.docx вопросы. Перманганатометрия
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
15. Систематический анализ смеси катионов VI аналитической группы. 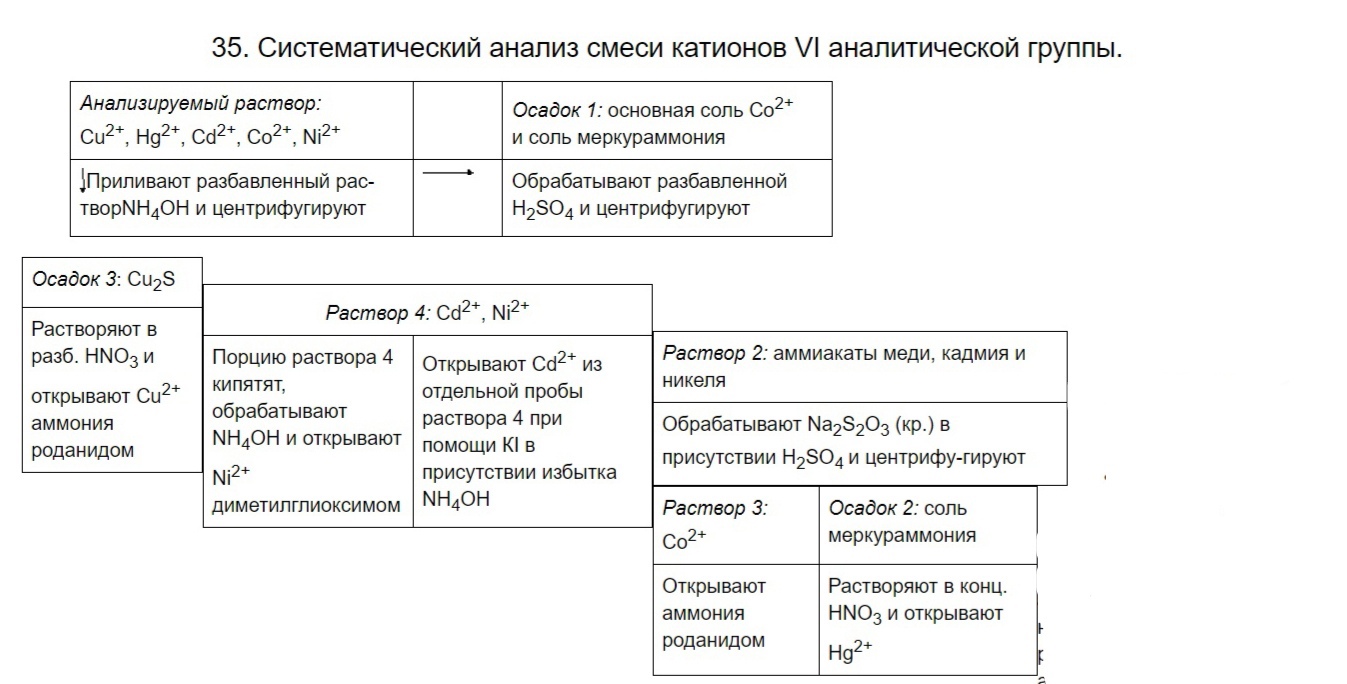 17 Аналитическая классификация анионов. Первая аналитическая группа анионов. Характерные и специфические реакции анионов so42ˉ, so32ˉ, co32ˉ, SiO32ˉ, s2o32ˉ, b4o72ˉ, po43ˉ. К I аналитической группе относятся анионы, образующие мало растворимые в нейтральной среде соли бария. Групповым реактивом анионов этой группы является раствор бария хлорида. Na2SO3 + BaCl2 → BaSO3↓ + 2 NaCl SO32‾ + Ba2+ → BaSO3↓ Na2SO4 + BaCl2 → BaSO4↓ + 2 NaCl SO42‾ + Ba2+ → BaSO4↓ Na2CO3 + BaCl2 → BaCO3↓ + 2 NaCl CO32‾ + Ba2+ → BaCO3↓ 2 Na3PO4 + 3 BaCl2 → Ba3(PO4)2↓ + 6 NaCl 2PO43‾ + 3Ba2+ → Ba3(PO4)2↓ Na2S2O3 + BaCl2 → BaS2O3↓ + 2 NaCl S2O32‾ + Ba2+ → BaS2O3↓ Отношение выпавших осадков к разбавленному раствору HCl: BaSO3↓ + 2 HCl → BaCl2 + SO2↑ + H2O BaSO3↓ + 2 H+ → Ba2+ + SO2↑ + H2O BaCO3↓+ 2 HCl → BaCl2 + CO2↑ + H2O BaCO3↓ + 2 H+ → Ba2+ + CO2↑ + H2O Ba3(PO4)2↓ + 6 HCl → 3 BaCl2 + 2 H3PO4 Ba3(PO4)2↓ + 6 H+ → 3 Ba2+ + 2 H3PO4 BaS2O3↓ + 2 HCl → BaCl2 + S↓ + SO2↑ + H2O BaS2O3↓ + 2 H+ → Ba2+ + S↓ + SO2↑ + H2O Специфические реакции анионов I аналитической группы Реакция карбонат-иона (СО32‾) Na2CO3 + 2 HCl → 2 NaCl + CO2↑ + H2O CO32‾ + 2 H+ → CO2↑ + H2O Реакции фосфат-иона (PO43‾) 2 Na2HPO4 + 3 AgNO3 → Ag3PO4↓ + 3 NaNO3 + NaH2PO4 2 HPO42‾ + 3 Ag+ → Ag3PO4↓ + H2PO4‾ Реакции тетраборат-иона (В4О72‾) В присутствии серной кислоты и этилового спирта тетраборат-ионы образуют борный эфир, который окрашивает пламя в зеленый цвет: Na2B4O7 + H2SO4 + 5 H2O → Na2SO4 + 4 H3BO3 B4O72‾ + 2H+ + 5 H2O → 4 H3BO3 H3BO3 + 3 C2H5OH → (C2H5O)3B + 3 H2O Реакции сульфит-иона (SO32‾) 1. Калия перманганат в кислом растворе окисляет сульфит-ион в сульфат-ион, восстанавливаясь при этом до бесцветного иона Mn2+: 5 Na2SO3 + 2 KMnO4 + 3 H2SO4 → 5 Na2SO4 + 2 MnSO4 + K2SO4 + 3 H2O MnO4‾ + 8 Н+ + 5 ē → Mn2+ + 4 Н2О 2 SO32‾ + Н2О – 2 ē→ SO42‾ + 2 Н+ 5 2 MnO4‾ + 16 Н+ + 5 SO32‾ + 5 Н2О → 2 Mn2+ + 8 Н2О + 5 SO42‾ + 10 Н+ 2. Иодная вода обесцвечивается сульфит-ионом вследствие восстановления I2 до I‾: Na2SO3 + I2 + H2O → Na2SO4 + 2 HI SO32‾ + H2O – 2ē→ SO42‾ + 2 H+ 1 I2 + 2 ē → 2 I‾ 1 SO32‾ + H2O + I2 → SO42‾ + 2 H+ + 2 I‾ Реакции тиосульфат-иона (s2o32‾) 1. Иодная вода обесцвечивается тиосульфат-ионом вследствие восстановления I2 до I‾: Na2S2O3 + I2 → Na2S4O6 + 2 NaI I2 + 2 ē → 2 I‾ 1 2 S2О32ˉ – 2 ē → S4О62ˉ 1 I2 + 2 S2О32ˉ → 2 I‾ + S4О62‾ 2. Серебра нитрат образует в растворах тиосульфатов белый осадок Ag2S2O3: Na2S2O3 + 2 AgNO3 → Ag2S2O3↓ + 2 NaNO3 S2O32‾ + 2 Ag+ → Ag2S2O3↓ Осадок постепенно буреет и в конце концов становится черным вследствие образования серебра сульфида Ag2S: Ag2S2O3 + H2O → Ag2S↓ + H2SO4 Ag2S2O3 + H2O → Ag2S↓ + 2H+ + SO42‾ 18 Вторая аналитическая группа анионов. Характерные и специфические реакции анионов Clˉ, Brˉ, iˉ, scn ˉ, s2ˉ.Ко II аналитической группе относятся анионы, образующие осадки с групповым реактивом – серебра нитратом в азотнокислой среде.С анионами второй аналитической группы серебра нитрат в азотнокислой среде образует осадки: KCl + AgNO3 → AgCl↓+ KNO3 KBr + AgNO3 → AgBr↓+ KNO3 Cl‾ + Ag+ → AgCl↓ Br‾+ Ag+ → AgBr↓ KI + AgNO3 → AgI↓+ KNO3 NH4CNS + AgNO3 → AgCNS↓+ NH4NO3 I‾ + Ag+ → AgI↓ CNS‾ + Ag+ → AgCNS↓ Отношение выпавших осадков к раствору NH4OH: Серебра хлорид хорошо растворяется в концентрированном аммиаке, серебра бромид и серебра роданид растворяются в избытке концентрированного аммиака: AgCl + 2 NH4OH → [Ag(NH3)2]Cl + 2 H2O AgCl + 2 NH4OH → [Ag(NH3)2]+ + Cl‾ + 2 H2O AgBr + 2 NH4OH → [Ag(NH3)2]Br + 2 H2O AgBr + 2 NH4OH → [Ag(NH3)2]+ + Br‾ + 2 H2O AgCNS + 2 NH4OH → [Ag(NH3)2]CNS + 2 H2O AgCNS + 2 NH4OH → [Ag(NH3)2]+ + CNS‾ + 2 H2O, а серебра иодид практически не растворяется, даже при большом избытке NH4OH. Специфические реакции анионов II аналитической группы Реакции хлорид-иона (Cl‾) AgNO3 + NaCl →AgCl↓ + NaNO3 Ag+ + Cl‾ →AgCl↓ AgCl + 2 NH4OH → [Ag(NH3)2]Cl + 2 H2O AgCl + 2 NH4OH → [Ag(NH3)2]+ + Cl‾ + 2 H2O [Ag(NH3)2]Cl + KI + 2 H2O → AgI↓ + 2 NH4OH + KCl [Ag(NH3)2]+ + I‾ + 2 H2O → AgI↓ + 2 NH4OH [Ag(NH3)2]Cl + 2 HNO3 → AgCl↓ + 2 NH4NO3 [Ag(NH3)2]+ + Cl‾+ 2 H+ → AgCl↓ + 2 NH4+ Реакции иодид-иона (I‾) Pb(NO3)2 + 2 KI → PbI2↓ + 2 KNO3 Pb2+ + 2 I‾ → PbI2↓ Осадок растворим в горячей воде в уксусной среде. После охлаждения выпадают красивые золотистые кристаллы свинца (II) иодида. Реакции роданид-иона (cns‾) FeCl3 + 3 KCNS ↔ Fe(CNS)3 + 3 KCl Fe3+ + CNS‾∙↔ Fe(CNS)3 При взаимодействии катионов меди (II) с аммония роданидом NH4CNS образуется черный осадок: CuSO4 + 2 NH4CNS → Cu(CNS)2↓ + (NH4)2SO4 Cu2+ + 2 CNS‾→ Cu(CNS)2↓ Осадок постепенно белеет вследствие его разложения: 2 Cu(CNS)2 → 2 CuCNS↓ + (CNS)2 (родан) 3. При взаимодействии катионов кобальта (II) с насыщенным раствором аммония роданида NH4CNS образуется комплексное соединение лилового цвета. При добавлении амилового спирта на поверхность раствора всплывает интенсивно-синий спиртовой слой, окраска которого обусловлена наличием недиссоциированных молекул (NH4)2[Co(CNS)4]: CoCl2 + 4 NH4CNS → (NH4)2[Co(CNS)4] + 2 NH4Cl Co2+ + 4 CNS‾ → [Co(CNS)4]2 19 Третья аналитическая группа анионов. Характерные и специфические реакции анионов no3ˉ, no2ˉ, ch3cooˉ. К III группе относятся те анионы, которые не имеют общего группового реактива и не осаждаются ни бария хлоридом, ни азотнокислым серебром. Реакция нитрат-иона (no3‾) Раствор дифениламина (C6H5)2NH в концентрированной серной кислоте образует с нитрат-ионами интенсивно-синее окрашивание, вследствие окисления дифениламина образующейся азотной кислотой. Реакции нитрит-иона (no2‾) 1. Разбавленные кислоты вытесняют из солей азотистую кислоту, которая разлагается при этом на воду и оксиды азота: 2 NaNO2 + H2SO4 → Na2SO4 + NO2↑ + NO↑ + H2O бурый NO NO2‾ + 2 Н+ + ē → NO + Н2О 1 2 2. Калия перманганат KMnO4 в присутствии разбавленной серной кислоты взаимодействует с солями азотистой кислоты: 5 KNO2 + 2 KMnO4 + 3 H2SO4 → 5 KNO3 + 2 MnSO4 + K2SO4 + 3 H2O NO MnO4ˉ + 8 H+ + 5 ē → Mn2+ + 4 H2O 2 5 3. Калия иодид в кислой среде окисляется азотистой кислотой до свободного иода: 2 NaNO2 + 2 KI + 2 H2SO4 → Na2SO4 + I2↓ + 2 NO ↑ +К2SO4+ 2 H2O NO 2 Iˉ – 2 ē → I2 1 2 Реакции ацетат-иона (ch3coo‾) 3 CH3COONa + FeCl3 → Fe(CH3COO)3 + 3 NaCl 3 CH3COO‾ + Fe3+ → Fe(CH3COO)3 20-23 Задачи и методы количественного анализа. Классификация методов количественного анализа. Сущность титриметрических методов анализа. Различают два вида анализа – качественный и количественный. Задача качественного анализа – обнаружить, какие элементы или их соединения входят в состав анализируемого материала. Качественный анализ обычно предшествует количественному. Цель количественного анализа – определение количественного состава изучаемого объекта. Основными методами количественного анализа являются гравиметрический (весовой) и титриметрический (объемный). Первый основан на точном измерении массы определяемого вещества, второй – на измерении объемов исследуемых растворов. Задачейколичественного анализа является определение количественного содержания элементов, ионов или химических соединений, входящих в состав исследуемых веществ и материалов. Все методы количественного анализа можно разделить на три основные группы. 1. Гравиметрический (весовой) анализ. Гравиметрическим анализом называют определение количества компонента (элемента или иона) по массе вещества, полученного в результате анализа. В методах этой группы определяемую часть анализируемого вещества выделяют в чистом виде или в виде соединения известного состава, массу которого определяют. Например, чтобы определить количество бария в его соединениях, ион Ва2+ осаждают при помощи разбавленной серной кислоты: BaCl2 + H2SO4 = BaSO4 + 2НСl. Осадок BaSO4 фильтруют, промывают, прокаливают и точно взвешивают. Зная массу осадка и его формулу, вычисляют, сколько в нем содержится бария. Гравиметрический метод дает результаты высокой точности, но он очень трудоемок. 2. Титриметрический (объемный) анализ. Титриметрический анализ основан на точном измерении количества реактива, затраченного на реакцию с определяемым компонентом. Реактив берется в виде раствора определенной концентрации — титрованный раствор. Момент, когда реактив будет прибавлен в количестве, эквивалентном содержанию определяемого компонента, т. е. момент окончания реакции определяется различными способами. При титровании приливают количество реактива, эквивалентное количеству определяемого вещества. Зная объем и точную концентрацию раствора, пошедшего на реакцию с определяемым веществом, рассчитывают количество определяемого вещества. Титриметрический анализ дает менее точные результаты, чем гравиметрический, но важным его преимуществом является большая скорость выполнения анализа. В зависимости от типа реакций, протекающих в процессе титрования, титриметрический анализ делят на три группы: методы кислотно-основного титрования, методы редоксиметрии и методы осаждения и комплексообразования. 3. Методы фотометрии. В этом методе количество вещества определяют по интенсивности окраски раствора. Для этого используют так называемые цветные реакции, т. е. реакции, сопровождающиеся изменением окраски раствора. Оценку интенсивности окраски раствора производят визуально или с помощью соответствующих приборов. Титриметрическим или объемным называют метод количественного анализа, основанный на измерении количества реагента, требующегося для завершения реакции с данным количеством определяемого вещества. Метод заключается в том, что к раствору определяемого вещества А постепенно прибавляют раствор реактива В известной концентрации. Добавление реактива продолжают до тех пор, пока его количество не станет эквивалентным количеству реагирующего с ним определяемого вещества А. Количественные определения с помощью объемного метода выполняются очень быстро. Время, требуемое для завершения анализа, измеряется минутами, что позволяет осуществлять экспресс-анализ. К реакциям, используемым в титриметрическом анализе, предъявляют определенные требования: 1) реакция должна быть практически необратимой (К > 108); 2) реакция должна протекать в строгом соответствии с уравнением химической реакции, без побочных продуктов; 3) реакция должна протекать достаточно быстро; 4) должен существовать надежный способ фиксирования точки эквивалентности. Фиксирование точки эквивалентности может осуществляться химическими (использование индикатора) и физико-химическими методами (потенциометрически, кондуктометрически, фотокалориметрически и т.д.). Методы анализа (общая х-ка): Химические (гравиметрические, титриметрические, кинетические, биохимические) Электрохимические (потенциометрия, кулонометрия, вольтамперометрия, кондуктометрия, электрогравиметрия) Спектроскопические (атомная и молекулярная спектрометрия, радиоспектроскопическая) Масс-спектрометрические Термические Биологические Методы анализа, основанные на радиоактивности 24 Способы выражения состава растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльная концентрация, молярная доля, объёмная доля, титр. Молярная концентрация равна количеству вещества (в молях), содержащегося в одном литре раствора. Она обозначается СМ и рассчитывается как отношение химического количества растворенного вещества (моль) Х к объему V раствора в литрах: где m (Х) – масса растворенного вещества, г М (Х) – молярная масса, г/моль V – объем раствора, л. Если объем V раствора измеряют в миллилитрах, то формула для расчета молярной концентрации имеет вид: Молярная концентрация эквивалента (нормальность или нормальная концентрация) равна количеству вещества эквивалента (моль), содержащегося в одном литре раствора. Она обозначается Сн рассчитывается как отношение химического количества эквивалента растворенного вещества Х к объему раствора в литрах: или, выразив в знаменателе молярную массу эквивалента через молярную массу вещества и фактор эквивалентности его в реакции по уравнению, получим: В современных методах анализа широко используется разновидность массовой концентрации – титр. Титр равен массе вещества (г), содержащейся в 1 мл раствора. Титр обозначается Т (Х) и рассчитывается, как отношение массы вещества Х к объему раствора V (мл): Можно установить связь между молярной концентрацией и титром: Взаимосвязь молярной концентрацией раствора и его массовой долей описывается уравнением: где ρ – плотность раствора, г/мл; w (Х) – массовая доля растворенного вещества, % Удобно использовать формулу, связывающую между собой молярную и нормальную концентрации: В тех случаях, когда речь идет об отношении массы (или объема, или химического количества вещества) компонента к массе (или объему, или количеству вещества) всей системы, термин "концентрация" не употребляют. А говорят о «доле» – массовой, объемной или молярной. И выражают эту долю либо дробью, либо в процентах, принимая систему за 1 или за 100%. Для обозначения доли компонента приняты следующие греческие буквы: массовая доля – ω (омега), объемная доля – φ (фи), молярная доля – χ (хи). где m (Х) и m – массы компонента и масса всей системы V (Х) и V – объемы компонента и объем всей системы ν (Х) и Σ ν – количества вещества компонента и сумма всех количеств веществ всей системы. Моляльность раствора – равна количеству вещества (моль) растворенного в 1 кг растворителя. Она обозначается Сm и рассчитывается по формуле: 42. Закон эквивалентов и его применение в количественном анализе. Способы определения точки эквивалентности. Способы приготовления рабочих растворов. Способы титрования: прямое, обратное, косвенное. Химическим эквивалентомназывается некая реальная или условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях. Важнейшей характеристикой химического эквивалента является молярная масса эквивалента вещества, выраженная в г/моль. Молярная масса эквивалента вещества (г/моль) – это масса 1 моль эквивалента вещества, рассчитываемая по формуле: где fэ − фактор эквивалентности, определяемый из уравнения химической реакции. Фактор эквивалентности fэ(Х) – число, показывающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Фактор эквивалентности рассчитывается по уравнению: Закон эквивалентов: вещества взаимодействуют друг с другом и образуются в результате химических реакций в количествах, пропорциональных их эквивалентам. Для условной химической реакции аА + bВ → сС + dD: νЭ (A) = νЭ (B) = νЭ (C) = νЭ (D), где νЭ – химическое количество эквивалента вещества, моль νЭ = Титрование – это процесс постепенного добавления титранта к анализируемой пробе, продолжающийся до точки эквивалентности. Точка эквивалентности (момент эквивалентности) – это момент, когда количество вещества эквивалента в добавленном растворе титранта становится равным количеству анализируемого вещества. Титрант – это раствор точно известной концентрации, применяемый для титрования. Существует два способа приготовления титрантов: 1. Взвешенную на аналитических весах точную навеску вещества растворяют в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (m) и объем полученного раствора (V), можно вычислить его титр: Т = m/V. Титранты, приготовленные таким образом, называются стандартнымирастворами и для их получения применимы только те вещества, которые удовлетворяют следующим требованиям: а) вещество должно быть химически чистым, т.е. должно содержать посторонних примесей не более 0,05-0,1%; б) состав вещества должен строго соответствовать формуле; в) вещество должно быть устойчивым при хранении и в твердом виде и в растворе; 2. Если вещества не удовлетворяют этим требованиям, то сначала готовят раствор приблизительно нужной концентрации, а затем устанавливают его точную концентрацию, титруя стандартным раствором. Такие титранты называются стандартизированными или рабочими растворами. Разнообразные методы титриметрического анализа можно классифицировать по типу используемых реакций и по способу проведения анализа. |
