база аналитика. analitika.docx вопросы. Перманганатометрия
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
25 Закон эквивалентов и его применение в количественном анализе. Способы определения точки эквивалентности. Способы приготовления рабочих растворов. Способы титрования: прямое, обратное, косвенное. Химическим эквивалентомназывается некая реальная или условная частица, которая может присоединять или высвобождать один ион водорода в кислотно-основных реакциях или один электрон в окислительно-восстановительных реакциях. Важнейшей характеристикой химического эквивалента является молярная масса эквивалента вещества, выраженная в г/моль. Молярная масса эквивалента вещества (г/моль) – это масса 1 моль эквивалента вещества, рассчитываемая по формуле: где fэ − фактор эквивалентности, определяемый из уравнения химической реакции. Фактор эквивалентности fэ(Х) – число, показывающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Фактор эквивалентности рассчитывается по уравнению: Закон эквивалентов: вещества взаимодействуют друг с другом и образуются в результате химических реакций в количествах, пропорциональных их эквивалентам. Для условной химической реакции аА + bВ → сС + dD: νЭ (A) = νЭ (B) = νЭ (C) = νЭ (D), где νЭ – химическое количество эквивалента вещества, моль νЭ = Титрование – это процесс постепенного добавления титранта к анализируемой пробе, продолжающийся до точки эквивалентности. Точка эквивалентности (момент эквивалентности) – это момент, когда количество вещества эквивалента в добавленном растворе титранта становится равным количеству анализируемого вещества. Титрант – это раствор точно известной концентрации, применяемый для титрования. Существует два способа приготовления титрантов: 1. Взвешенную на аналитических весах точную навеску вещества растворяют в мерной колбе и доводят объем раствора водой до метки. Зная массу растворенного вещества (m) и объем полученного раствора (V), можно вычислить его титр: Т = m/V. Титранты, приготовленные таким образом, называются стандартнымирастворами и для их получения применимы только те вещества, которые удовлетворяют следующим требованиям: а) вещество должно быть химически чистым, т.е. должно содержать посторонних примесей не более 0,05-0,1%; б) состав вещества должен строго соответствовать формуле; в) вещество должно быть устойчивым при хранении и в твердом виде и в растворе; 2. Если вещества не удовлетворяют этим требованиям, то сначала готовят раствор приблизительно нужной концентрации, а затем устанавливают его точную концентрацию, титруя стандартным раствором. Такие титранты называются стандартизированными или рабочими растворами. Разнообразные методы титриметрического анализа можно классифицировать по типу используемых реакций и по способу проведения анализа. 26 Сущность метода кислотно-основного титрования. Основные реакции и титранты метода. Ацидиметрия, алкалиметрия. Кислотно-основные индикаторы. В основе метода кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с ионами гидроксила, сопровождающаяся образованием слабодиссоциированных молекул воды (растворителя): Этот метод применяется для количественного определения кислот (H2SO4, НNО3, НСl, H3PO4, СН3СООН, Н2С2O4 и др.), гидроксидов (КОН, NaOH, Ba(OH)2 и др.), солей, способных гидролизоваться в водных растворах (Na2CО3, К2СО3), а также их смесей (смесь NH4Cl и NaOH) и т. п. Кислотно-основное титрование имеет два основных метода: ацидиметрия - определение оснований и алкалиметрия - определение кислот. В качестве рабочих растворов используют чаще всего растворы кислот соляной и серной, растворы гидроксидов NaOH и КОН. Чаще всего применяют 0,1—0,5 н. растворы. В качестве исходных веществ для установления титра растворов кислот используют тетраборат натрия или карбонат натрия безводный, а для установления титра растворов щелочей - щавелевую Н2С2O4 · 2H2O или янтарную Н2С2H4O4 кислоту. При данном методе точка эквивалентности может лежать в нейтральной (рН = 7), щелочной (рН > 7) и кислой среде (рН < 7). Различают следующие случаи титрования: Титрование сильной кислоты сильной щелочью: Образующаяся соль — хлорид натрия — не подвергается гидролизу, и раствор будет иметь нейтральную реакцию. Следовательно, и в растворе появляется избыток ионов ОН-. При титровании слабых кислот сильными основаниями точка эквивалентности не совпадает с точкой нейтральности и будет находиться в щелочной среде. Титрование слабого основания сильной кислотой: 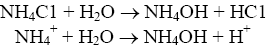 Образующаяся соль - хлорид аммония - также гидролизуется, и в растворе накапливаются ионы Н+, что смещает точку эквивалентности в кислую зону. Поэтому при титровании слабого основания сильной кислотой точка эквивалентности тоже не совпадает с точкой нейтральности. При титровании сильной кислоты сильной щелочью точка эквивалентности находится в нейтральной среде. 27 Кривые кислотно-основного титрования. Расчет, построение и анализ типичных кривых кислотно-основного титрования. Для того чтобы иметь возможность выбрать индикатор для титрования, кроме качественных показателей, необходимо использовать методы, дающие количественную характеристику этого процесса. К таким методам относятся метод построения “кривых титрования”, метод вычисления индикаторной ошибки, совершаемой при титровании. Метод “кривых титрования” При прибавлении к 0,1 н. раствору кислоты раствора щелочи такой же нормальности происходит изменение реакции среды из кислой в нейтральную, а затем в щелочную. Количество прилитого раствора щелочи будет соответствовать определенной величине рН и цвету индикатора. 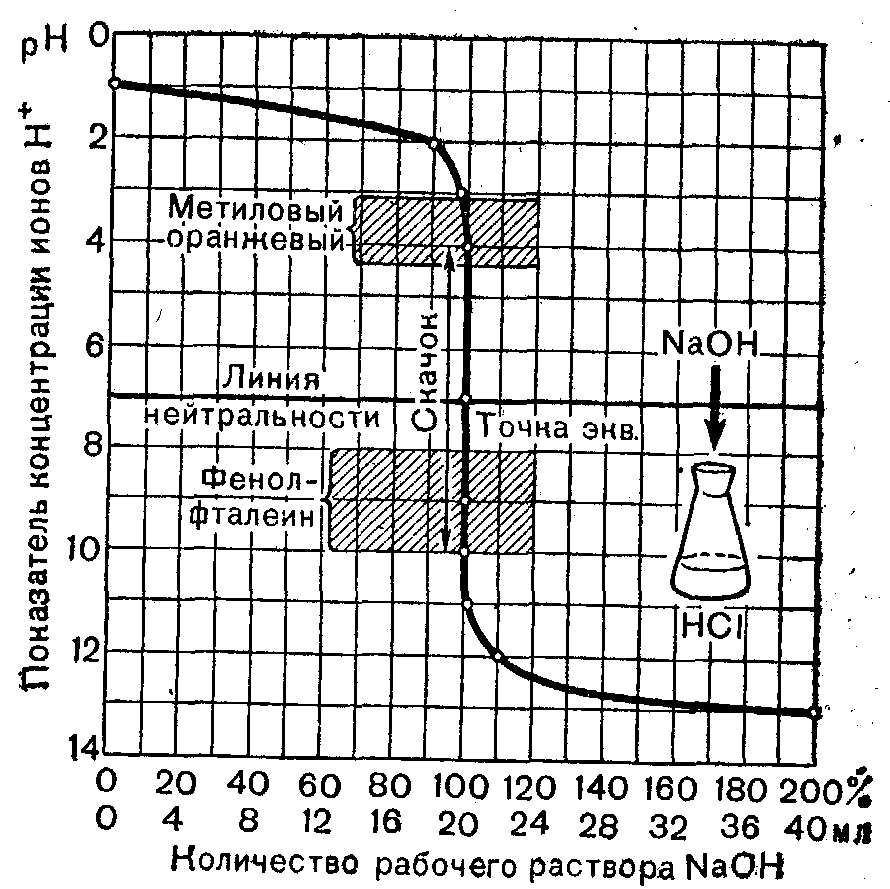 Чтобы иметь возможность точно изучить этот процесс и выбрать нужный индикатор, используют графический метод. Для этого на оси ординат откладывают величину рН, а на оси абсцисс – количество раствора NaOH (в мл). При этом образуется кривая, которая будет характеризовать изменение рН в зависимости от количества миллилитров прилитого рабочего раствора. Чтобы иметь возможность точно изучить этот процесс и выбрать нужный индикатор, используют графический метод. Для этого на оси ординат откладывают величину рН, а на оси абсцисс – количество раствора NaOH (в мл). При этом образуется кривая, которая будет характеризовать изменение рН в зависимости от количества миллилитров прилитого рабочего раствора.Кривая титрования сильной кислоты (НС1) сильным основанием Для построения кривой в коническую колбу наливают 20 мл 0,1 н. раствора соляной кислоты и из бюретки добавляют постепенно 20 мл 0,1 н. раствора натрия гидроксида. Рассчитывают величины рН, получающиеся в зависимости от прилитого количества миллилитров гидроксида, и по точкам строят кривую. Сначала находят начальную (исходную) точку кривой, затем определяют конечную точку кривой (точку эквивалентности). По кривой титрования (рис. 1) видно, что к концу этого титрования происходит сильное изменение величины рН раствора и наблюдается резкий скачок. Если за время нейтрализации 99,9% кислоты рН изменяется постепенно от 1,0 до 4,0, то при добавлении весьма небольшого количества раствора натрия гидроксида рН повышается с 4,0 до 10,0. Последняя капля добавленной щелочи вызывает изменение рН на 6 единиц, а [Н+] в 1.000.000 раз, поэтому кривая на этом отрезке занимает вертикальное положение – этот вертикальный участок кривой называют скачком рН на кривой титрования. Если после достижения точки эквивалентности продолжать добавлять раствор гидроксида NaOH, то [Н+] будет уменьшаться и кривая во второй половине будет такой же пологой, как и в первой. 30 Окислительно-восстановительные реакции, применяемые в объёмном анализе. Сущность методов оксидиметрии. Классификация редокс-методов, способы установления точки эквивалентности в оксидиметрии. Данная группа методов основана на окислительно-восстановительных реакциях, которые протекают между рабочим раствором и определяемым веществом. Обычно их классифицируют следующим образом. Классификация по характеру титранта. В этом случае методы ОВ титрования подразделяют на две группы: оксидиметрия — методы определения восстановителей с применением титранта-окислителя; редуктометрия — методы определения окислителей с применением титранта-восстановителя. Классификация по природе реагента, взаимодействующею с определяемым веществом. Ниже после названия соответствующего метода в скобках указано основное действующее вещество этого метода: броматометрия (бромат калия КВrО3), бромометрия (бром Вr2), дихроматометрия (дихромат калия K2Cr2О3), иодатометрия (иодат калия KIО3), иодиметрия (иод I2), иодометрия (иодид калия KI, тиосульфат натрия Na2S2О3), нитритометрия (нитрит натрия NaNO2), перманганатометрия (перманганат калия КМnО4), хлориодиметрия (хлорид иода ICl), периметрия (сульфат церия(IV)). При редоксиметрическом титровании изменяются концентрации участвующих в реакции веществ или ионов, а, следовательно, и окислительно-восстановительный потенциал раствора (Е). Если величины ОВП, соответствующие различным моментам титрования, то получаются кривые титрования, аналогичные кривым, получаемым по методу кислотно-основного титрования. Особенный интерес представляют те точки на кривой титрования, которые соответствуют 0,1 мл недостатка и 0,1 мл избытка КМnО4, так как они определяют собой величину скачка потенциала около точки эквивалентности. Вблизи точки эквивалентности здесь тоже наблюдается резкий скачок потенциалов. Наоборот, другие участки кривой идут полого, т. е. величина Е изменяется при титровании очень медленно. Наличием скачка на кривой титрования можно воспользоваться для точного фиксирования точки эквивалентности с помощью индикаторов. Окислительно-восстановительными называются реакции, протекающие с изменением степеней окисления атомов. Для составления уравнений ОВ реакций используют два метода: 1) метод электронного баланса; 2) электронно-ионный метод (метод полуреакций). Метод электронного баланса рекомендуется использовать для реакций, протекающих в газовой или твердой фазах. Электронно-ионный метод применяется для составления уравнений ОВ реакций, протекающих в водных растворах. Этот метод основан на составлении двух полуреакций: для окисления восстановителя и восстановления окислителя, а затем суммирование их в общее ионное уравнение. При использовании этого метода степени окисления атомов элементов в составе реагирующих веществ не определяют, а в полуреакциях записывают ионы или молекулы сопряженных окисленной и восстановленной форм в том виде, как они существуют в растворе в условиях проведения реакций. Метод полуреакций учитывает реально существующие ионы в растворе, а слабые электролиты, газы, малорастворимые вещества записывают в молекулярном виде. Метод полуреакций учитывает роль среды. Если реакция протекает в кислой среде, то в полуреакции могут быть включены только молекулы H2O и ионы водорода Н+. На каждый недостающий атом кислорода в одной из частей полуреакции нужно добавить по одной молекуле воды, тогда во вторую часть полуреакции пойдет удвоенное число ионов водорода. Составим уравнение реакции окисления сульфита натрия перманганатом калия в кислой среде: 5 Na2SO3 + 2 KМnO4 + 3 H2SO4 → 5 Na2SO4 + 2 MnSO4 + K2SO4 + 3 H2O SO MnO4ˉ + 8 H+ + 5 ē → Mn2+ + 4 H2O 2 5 После приведения подобных членов получим ионное уравнение реакции в сокращенной форме: 5 SO32ˉ + 2 MnO4ˉ + 6 H+ → 5 SO42ˉ + 2 Mn2+ + 3 H2O По ионному уравнению расставляют коэффициенты в молекулярном. Если реакция протекает в щелочной среде, то в полуреакции могут быть включены только молекулы воды и ионы ОНˉ. На каждый недостающий в одной из частей полуреакции атом кислорода нужно добавить по два иона ОНˉ, тогда во второй части реакции пойдет уменьшенное в два раза число молекул воды. Na2SO4 + 2 KМnO4 + 2 KOH → Na2SO4 + 2 K2MnO4 + H2O SO MnO4‾ + 1 ē → MnO42ˉ 2 S Таким образом, при составлении уравнений ОВ реакций методом полуреакций следует придерживаться такого порядка: 1) составить схемы полуреакций окисления и восстановления с указанием исходных и образующихся реально существующих в условиях реакции ионов и молекул; 2) уравнять число атомов каждого элемента в левой и правой частях полуреакций; 3) уравнять суммарное число зарядов в обеих частях каждой полуреакции, для этого прибавить к левой и правой частям полуреакций необходимое число электронов; 4) подобрать множители для полуреакций так, чтобы число электронов, отдаваемых при окислении, было равно числу электронов, принимаемых при восстановлении; 5) сложить уравнения полуреакций и написать сокращенное ионное уравнение; 6) расставить коэффициенты в молекулярном уравнении реакции. |
