Педиатрия ВУИ. Понятие об инфекционных эмбрио и фетопатиях. Понятие о внутриутробном (анте и интранатальном) инфицировании
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
|
Данные о поражениях плода в зависимости от сроков инфицирования матери:
 Классический синдром врожденной краснухи» (триада Грегга) включает: поражение органа зрения (50-55%) поражение органа слуха (60%) пороки сердца (52-80%) При поражении сердечно-сосудистой системы развивается хроническое воспаление сердечной мышцы, что приводит к дефектам перегородок и клапанов, изменению положения сердца и сосудов. Пороки сердца: Частые незаращение артериального (боталлова протока) стеноз легочной артерии незаращение межжелудочковой перегородки. Редкие стеноз аорты коарктация аорты дефект межжелудочковой и межпредсердной перегородок транспозиции крупных сосудов Поражение глаз является результатом прямого действия вируса, который может персистировать в хрусталике несколько лет. Сетчатка может быть вовлечена в патологический процесс. При этом наблюдают ее обширные изменения с многочисленными очагами, отложениями темного пигмента (ретинопатия «соль с перцем»). Наиболее частые поражения глаз: глаукома помутнение роговицы миопатия недоразвитие век Поражение органов слуха: Самым частым дефектом при краснухе является глухота, связанная с вестибулопатией. Для поражения органа слуха характерна также атрезия слуховых проходов. Помимо перечисленных классических проявлений, существует расширенный синдром краснухи, в который входит множество других аномалий развития, характерных для этой инфекции: - микроцефалия; - увеличенный родничок; - поражение головного мозга; - глаукoма; - расщелина нёба; - интерстициальная пневмония; - гепатит; - поражение вестибулярного аппарата; - пороки развития скелета; - поражение трубчатых костей; - гепатоспленомегалия; - пороки развития мочеполовой системы. Для больных детей типичны низкая масса тела и маленький рост при рождении, дальнейшее отставание в физическом развитии. Одни из наиболее характерных признаков врожденной краснухи - тромбоцитопеническая пурпура (может сохраняться в течение от 2 недель до 3 месяцев) и гемолитическая анемия. Частота тромбоцитопенической пурпуры составляет 15 – 20%. Тромбоцитопения обычно купируется спонтанно в течение 1-го месяца жизни. Летальный исход редко бывает обусловлен геморрагическим синдромом, несмотря на то, что тромбоцитопения может быть достаточно выражена. При врожденной краснухе могут наблюдаться разнообразные поражения центральной нервной системы, тяжелые гормональные изменения (сахарный диабет, болезнь Аддисона, недостаток гормона роста). У большинства инфицированных детей в период новорожденности отмечается бессимптомное течение болезни. У 70% из них впоследствии появляются признаки врожденной краснухи. Проявлениями врожденной краснухи в периоде новорожденности могут быть висцеральные симптомы, свидетельствующие о генерализованной инфекции. Синдром краснухи с висцеральными симптомами (летальность 30%): низкая масса тела при рождении гепатоспленомегалия желтуха экзантема тромбоцитопения гемолитическая анемия миокардит пневмония энцефалит остеопатия Отсроченные проявления синдрома краснухи (манифестируют в 4-6 месяцев): задержка роста задержка психо-моторного развития рецидивирующая пневмония хроническая экзантема, васкулит первичный ИДС с гипоиммуноглобулинемией летальность 70% В настоящее время показано, что краснуха может вести себя как медленная вирусная инфекция с неблагоприятными последствиями в юношеском возрасте. Поздние проявления: инсулин-зависимый сахарный диабет эндокринные нарушения (гипотиреоз, ожирение) судороги прогрессирующий краснушный панэнцефалит. ДИАГНОСТИКА Серологические методы (ИФА, РТГА) являются основными. Анти-Rub IgM обнаруживаются сразу после рождения, сохраняются до 6 мес. Выявляются менее, чем у 1/3 инфицированных. Если инфицирование произошло в I или II триместрах беременности специфические IgM могут не выявляться. Нарастание Анти-Rub IgG свидетельствует об инфицировании. Выделение возбудителя дополняет серодиагностику. Молекулярно-биологический метод включает выделение РНК вируса краснухи с помощью ПЦР. В первые месяцы жизни (до 4-7 мес.) исследуют секреты из носоглотки, мочи, крови, ликвора. Частота позитивных результатов тестов тканевых культур и ПЦР с первого по 6 месяц снижается с 85% до 20%. Вирусологический метод предполагает выделение вируса из клинического материала путем заражения культур клеток РК13, Vero, Sirk (клетки роговицы кролика, первичной культуры клеток человека). Дифференциальный диагноз Инфекция врожденной краснухи по своим клиническим проявлениям и их многобразию сходна с такими врожденными инфекциями, как токсоплазмоз, цитомегаловирус, вирус Эпштейна-Барр, вирус простого герпеса. Основным элементом дифференциальной диагностики являются лабораторные методы исследования. ЛЕЧЕНИЕ Лечение детей осуществляется в стационаре. Детей с врожденной краснухой следует изолировать от других новорожденных. Специфической химиотерапии не существует. Целесообразность использования для лечения краснухи у новорожденных младенцев препаратов иммуноглобулинов человека в настоящее время не доказана. У детей до 2 мес. используют виферон 150 тыс. МЕ по 1 супп. 2 р/сут. В 2-4 мес. – виферон 150 тыс. МЕ 2 супп. утром, 1 – вечером. В 4-6 мес. – виферон 150 тыс. МЕ по 2 супп. утром и вечером. У детей старше 6 мес. – виферон 500 тыс. МЕ по 1 супп. утром и вечером. Проводится патогенетическая и симптоматическая терапия. Лечение пороков проводят в профильных стационарах, где осуществляется их коррекция и реабилитационные мероприятия. ПРОФИЛАКТИКА В соответствии с национальным календарем прививок иммунизация против краснухи проводится в 12 месяцев и 6 лет. Однократно вакцинируют девочек в 13 лет и женщин детородного возраста ранее не прививавшихся и не болевших краснухой. В России зарегистрированы 4 вакцины для профилактики краснухи: 1. Живая аттенуированная моновакцина «Рудивакс» фирмы «Санофи Пастер», Франция 2. Живая аттенуированная моновакцина института сывороток Индии (SII) 3. Живая культуральная тривакцина М-М-Р II для профилактики кори, паротита и краснухи фирмы «Мерк, Шарп, Доум», США 4. Живая культуральная тривакцина против кори, паротита, краснухи фирмы «ГлаксоСмитКляйн», Бельгия 6. Врожденный хламидиоз. Эпидемиология. Патогенез. Клиника. Локальные и генерализованные формы.. Иммунологические методы диагностики. Лечение. Неонатальный хламидиоз - антропонозное инфекционное заболевание плода и новорожденного, вызываемое Chlamidia trachomatis - облигатным микроорганизмом, обладающим способностью к внутриклеточному паразитированию и имеюший тропизм кслизистому эпителию определенных органов, прежде всего мочевых путей, конъюнктивы, бронхолегочной системы и др. Распространенность C.trachomatis охватывает 700 млн. человек по всему миру. ЭТИОЛОГИЯ В патологии новорожденных детей имеет значение инфицирование Ch. trachomatis. Хламидии являются облигатными внутриклеточными паразитами. Хламидии имеют вид мелких грамм-отрицательных кокков, размером 0,25-1,5 мкм и занимают промежуточное положение между вирусами и бактериями. Хламидиям присущ выраженный тропизм к цилиндрическому эпителию. Имеются две формы существования хламидий: внеклеточная – элементарное тельце (ЭТ) и внутриклеточная – ретикулярное тельце (РТ). ЭПИДЕМИОЛОГИЯ Источником инфекции для новорожденного является инфицированная мать. Заражение плода хламидиями возможно по периодам: интранатально (контактный путь инфицирования и восходящий) антенатально (в результате аспирации околоплодных вод и попадиния возбудителя на слизистые оболочки конъюнктивы, дыхательных путей, вульвы и уретры, ЖКТ), Пути инфицирования: восходящий – при наличии у матери специфического кольпита и цервицита и локализации процесса в области придатков матки; нисходящий - при наличии инфекции в эндометрии и плодных оболочках (трансдецидуальный) предполагается возможность трансплацентарного внедрения хламидий. ПАТОГЕНЕЗ Хламидии тропны к цилиндрическому эпителию уретры, цервикального канала, конъюнктивы, прямой кишки, задней стенки глотки, бронхов, бронхиол, эпителию легких. Иммупатологические изменения в плаценте, напряжение гормональной функции фетоплацентарного комплекса, снижение плодо-плацентар В силу особенностей биологического цикла хламидий и морфофункциональной зрелости новорожденного ребенка развитие локальной воспалительной реакции происходит медленно и выявляется обычно лишь на 2-4 неделе жизни. Хламидийная инфекция осложняет адаптацию новорожденных и проявляется: неврологическими нарушениями, дыхательными расстройствами, отечным синдромом, геморрагическим синдромом, офтальмопатией, длительной и выраженной желтухой. Патогенез. Установлена способность C.trachomatis проникать через поврежденные плодные оболочки на ранних сроках беременности. Хламидийная инфекция матери может приводить к развитию хронической плацентарной недостаточности оказывать неблагоприятное на рост и развитие плода. Хламидии персистируют в эпителиальных клетках и фиброцитах инфицированных слизистых оболочек, а также в моноцитах и тканевых макрофагах, что способствует их системному распространению по организму. Размножение хламидий приводит в конечном счете к гибели клеток. Пренатальное поражение хламидийной инфекцией ведет к увеличение частоты рождения детей с низкой массой тела, отечным и геморрагическим синдромами, нарушениями гемодинамики, стойкой неврологической симптоматикой. Особенно тяжело протекает заболевание при трансплацентарном заражении. В результате генерализации процесса возникают глубокие нарушения в дифференцировке и созревании нервной и альвеолярной ткани. Цикличность размножения возбудителя, а также способность длительно (иногда несколько лет) сохраняться в клетках (особенно лимфоидной ткани) обусловливает рецидивирующее и хроническое течение болезни, что может сопровождаться развитием иммунопатологических реакций. При хламидиозе наблюдаются отклонения в уровне циркулирующих иммунных комплексов, снижение комплиментарной активности, и уровня компонентов комплемента С5, С4, С1, снижение уровня IgA и IgМ, повышение содержания рецепторных белков (Р-белков). Кроме того, отмечается угнетение клеточного иммунитета, снижение фагоцитарной активности полинуклеаров крови и макрофагов. При хронических формах хламидиоза отмечаются вторичные иммунодефицитные состояния комбинированного типа: снижение клеточного, гуморального и фагоцитарного звеньев иммунитета. Типично снижение В-клеточного звена, естественных киллеров, концентрации IgM и IgA, активности комплемента за счет уменьшения содержания его компонентов (С1,С2, С3), фагоцитарной активности лейкоцитов. Уровень циркулирующих иммунных комплексов повышен. Наиболее характерным считается нарушение продукции интерферонов. КЛИНИЧЕСКАЯ КАРТИНА В клинике внутриутробного хламидиоза принято различать локальные (конъюнктивит, гастроэнтероколит, атипичная пневмония) и генерализованные формы инфекции. Среди важнейших проявлений генерализованной хламидийной инфекции принято рассматривать менингоэнцефалит, кардиомиопатию, пневмонию, гастроэнтерит, гепатит, лимфаденит, нередко осложняющиеся развитием ДВС-синдрома. В гемограмме выявляется умеренная анемизация, длительно сохраняется относительный нейтрофилез, увеличение к концу 1–2-й недели жизни эозинофилов (7%) и моноцитов (10%), лимфопения имеет стойкий характер. Заподозрить хламидийную инфекцию у новорожденных можно при наличии в анамнезе указаний на 1) выявление хронических урогенитальных заболеваний у родителей; 2) наличии патологии беременности: самопроизвольный выкидыш, угроза прерываний, поздний токсикоз, многоводие, преждевременная отслойка плаценты, преждевременные роды, плацентарная недостаточность, задержка развития и гипотрофия плода; 3) развитие во время беременности острого вульвита и кольпита. При хламидийной инфекции в патологический процесс в той или иной степени оказываются вовлеченными все функциональные системы организма новорожденного ребенка. Симптомы поражения ЦНС проявляются рано, но носят неспецифический характер: повышенная возбудимость, тремор конечностей, гиперестезия, болезненный крик, срыгивание, реже - угнетение физиологических рефлексов. Рано (на 3-4 день жизни) появляются изменения со стороны сердечно-сосудистой системы. Отмечается приглушение тонов сердца, систолический шум. На ЭКГ определяются признаки перегрузки правых отделов. На ренгенограмме органов грудной клетки - усиление прикорневого сосудистого рисунка, увеличение размеров сердца за счет правых его отделов («шаровидное сердце»). Эхокардиографическое исследование выявляет нарушение гемодинамики, повышение давления в малом круге кровообращения, а у ряда детей - признаки изменения эндокарда и клапанного аппарата сердца в виде повышения акустической плотности створок, пролапса митрального клапана. Хламидийный конъюнктивит у новорожденных обычно начинается сразу после рождения или на 2-й неделе жизни, но иногда спустя 5-6 недель. Наблюдаются припухлость век, гиперемия конъюнктивы и гноетечение из глаз. При осмотре конъюнктивы выявляются псевдомембранозные образования (фолликулы). Спустя 2-3 недели острый конъюнктивит заканчивается иногда даже без соответствующего лечения. При хроническом течении клинические проявления сохраняются на протяжении нескольких месяцев. Редко в процесс вовлекается роговица и околоушные железы, лимфатические узлы (лимфаденит). Возможно сочетание конъюнктивита с ринитом, в отделяемом из носа выявляется Chlamidia trachomatis, что можно отнести к первым признакам респираторного хламидиоза. Однако, инфицирование эпителия носоглотки не всегда сопровождается клиническими проявлениями, что связано либо с персистенцией хламидий, либо с развитием латентной формы заболевания. Респираторный хламидиоз является наиболее тяжелой формой хламидийной инфекции у детей раннего возраста. Изолированное поражение легких может быть первым проявлением внутриутробной хламидийной инфекции у новорожденных. Признаки внутриутробной хламидийной пневмонии проявляются в различные сроки после рождения - от 4-5-го дня жизни до нескольких месяцев. Для неонатального хламидиоза характерно наличие синдрома дыхательных расстройств. Одышка с участием вспомогательной мускулатуры, появление мелкопузырчатых влажных хрипов в легких. Заболевание нередко протекает тяжело и может закончиться летальным исходом. Однако чаще хламидийная пневмония у детей развивается постепенно и приобретает затяжное течение. Сначала возникает ринит, затем у больных появляется учащенное дыхание, сухой приступообразный, отрывистый (коклюшеподобный) кашель,но без реприз, сопровождающийся цианозом. Температура тела, как правил, не повышается. При аускультации в легких определяются рассеянные крепитирующие хрипы с обеих сторон, иногда разнокалиберные влажные хрипы. Дыхательная недостаточность исимптомы интоксикации мало выражены, лишь у некоторых больных наблюдаются нарушения легочной вентиляции и снижение показателей pО2 в крови. Рецидивы обструктивного синдрома отмечаются у больных, не получающих этиотропного лечения. При рентгенологическом исследовании легких у больных выявляются изменения, характерные для диффузной интерстициальной пневмонии. Возможно появление мелкоочаговых альвеолярных инфильтратов на фоне эмфиземы. У глубоко недоношенных детей с массой тела менее 1500 г заболевание протекает по типу синдрома дыхательных расстройств. В наиболее тяжелых случаях присоединяется ДВС синдром. Генерализованная форма протекает тяжело с вовлечением в патологический процесс различных органов (печень, сердце, легкие, ЦНС, ЖКТ) и нередко заканчивается летальным исходом. Выявлено при хламидийной инфекции вовлечение в патологический процесс печени и желчевыводящих путей, поджелудочной железы, кишечника. У большинства детей с заболеванием органов ЖКТ холецистит и панкреатит имели хроническое течение. Установлено, что клинические формы заболеваний ЖКТ имеют различия в возрастном аспекте. У детей грудного возраста преобладал дисбактериоз (100%). Роль хламидийной инфекции в генезе дисбактериоза подтверждалась исследованием мазков из ануса на определение антигена или ДНК хламидии, при этом получены положительные результаты у 96,4% больных. С возрастом увеличивается роль локализованных форм (холецистит, реактивный панкреатит, дискинезия желчевыводящих путей и гастрит ) -от года до 3 лет - у 50%, старше 3 лет- у 75%. ДИАГНОСТИКА -Цитоскопические методы обнаружения хламидий -Культуральный метод Выделение возбудителя из организма в культуре клеток или на куриных эмбрионах - так называемый "золотой стандарт". - Иммунохимические методы. В РИФ исследуются соскобы с конъюнктивы, задней стенки глотки. -Молекулярно – биологические методы. Метод ПЦР (полимеразная цепная реакция) – основаны на выявлении хламидийной ДНК (РНК) в образцах путем гибридизации. -Серологические методы. Определение АТ к Chlamydia trachomatis является вспомогательным исследованием, т.к. из-за низкой иммуногенности возбудителя антитела образуются у 50% больных хламидийной инфекцией. Выявление антител к хламидиям проводится методом непрямой иммунофлюоресценции (НИФ), иммуноферментного анализа (ИФА). ИФА позволяет выявлять антихламидийные антитела класса М, G, А. При острой инфекции диагностическое значение имеет обнаружение хламидийных IgM антител, либо конверсия IgG антител при их нарастании в 2 и более раз. Отсутствие у новорожденныхантихламидийных АТ не исключает врожденную инфекцию.Полная элиминация антител к Сh.trachomatis из организма происходит через 4–12 месяцев после этиологического излечения. Определение после этого срока даже низких титров антител указывает на латентное течение процесса или реинфекцию. ЛЕЧЕНИЕ Этиотропная терапия: В неонатальном периоде используют макролиды (эритромицин в/в 40-50 мг/кг/сут в 3 введения, спирамицин 150 тыс. МЕ/кг в 2 приема, рокситромицин 5–8 мг/кг в 2 приема, азитромицин 10 мг/кг в 1 прием) в течение ≥3 нед. При пневмонии эритромицин вводится внутривенно, при конъюнктивите – внутрь или в свечах 40-50 мг/кг в сутки. Курс - 21 день. У новорожденных детей можно использовать вильпрафен (джозамицин) 30-50 мг/кг в сутки в 3 приема. Курс 10-14 дней. У новорожденных детей для лечения хламидийного конъюнктивита местно применяют 1% эритромициновую мазь 4-5 раз в день или 0,05% раствор пиклоксидина. Виферон 2 раза в сутки ректально 5 дней, 5 дней перерыв, затем повторный курс. Детям до 1 мес. – виферон 150 тыс. МЕ по 1 суппозиторию 2 р/сут 2-3 мес. – виферон 150 тыс. МЕ 2 суппозитория утром, 1 вечером 3-5 мес. – виферон 150 тыс. МЕ по 2 суппозитория утром и вечером 5-9 мес. – виферон 500 тыс. МЕ по 1 суппозиторию утром и вечером старше 9 мес. – виферон 100000 МЕ 1 суппозиторий утром и виферон 500 тыс. 1 суппозиторий вечером. Применяется патогенетическая, симптоматическая и иммунокорригирующая терапия. Критерии излеченности – сочетание клинического выздоровления с полной гибелью возбудителя. В течение 3-4 месяцев не менее 3 раз с интервалом в месяц проводится лабораторный контроль методом РИФ, ПЦР. Врожденный токсоплазмоз. Особенности заражения. Патогенез. Клиника. Течение. Современные схемы лечения Врожденный токсоплазмоз – это практически пожизненная инфекция с хронически – рецидивирующим течением. Врожденный токсоплазмоз нередко является причиной всего спектра антенатальной патологии. У женщин, инфицированных токсоплазмами, внутриутробная гибель плода и мертворождения встречаются в 3 раза чаще, преждевременные роды - в 10 раз чаще, чем у неинфицированных. Согласно проведенным исследованиям в США и странах Европы на 1000 новорожденных приходится от 1 до 5-7 детей с врожденным токсоплазмозом, в России 5- 7. В Венгрии ежегодно рождается 300 детей с врожденным токсоплазмозом, в США – 3300, во Франции – 2400, в Германии - 2000-3000. Частота токсоплазмоза у детей по материалам вскрытий составляет 3,2%. ЭПИДЕМИОЛОГИЯ. Заражение плода от матери наиболее вероятно при первичном инфицировании женщины во время беременности. Риск первичной инфекции составляет 0,3-1%. В среднем у 50% зараженных матерей возбудитель во время беременности переносится на плод, в том числе в первом триместре влияет - в 17% случаев, во 2 – в 24%, в третьем – в 62%. При заражении в последнюю неделю беременности частота увеличивается до 90%. Опасность развития тяжелой инфекции у плода, напротив, уменьшается с гестационным возрастом. Риск инфицирования плода не зависит от того, в клинически выраженной или бессимптомной форме протекает токсоплазмоз у матери в период гестации. ПАТОГЕНЕЗ. Врожденный токсоплазмоз – результат трансплацентарной передачи инфекции плоду. Заражение происходит от женщин, инфицированных токсоплазмами во время данной беременности или непосредственно перед зачатием, когда имеется паразитемия. У ВИЧ инфицированных может происходить обострение хронического токсоплазмоза и заражение плода. При врожденном токсоплазмозе первичный очаг инфекции формируется в плаценте, откуда трофозоиды гематогенно проникают в плод, диссеминируя по всему организму. До 16 недель беременности очаги токсоплазмоза поражают трофобласты настолько сильно, что следствием этого являются выкидыши. Эмбриопатий ожидать не следует, поскольку возбудитель в силу длительной внутриклеточной латенции переходит к плоду после окончания эмбрионального периода. Если плод не гибнет в острой фазе инфекции, то процесс постепенно стихает. Угасание очагов воспаления происходит, прежде всего, во внутренних органах и намного позднее в головном мозге и глазах вследствие защитного действия гематоэнцефалического и гемофтальмического барьеров. Поэтому в подострой стадии инфекции ведущими становятся поражения ЦНС и глаз. Эти поражения проявляются грубыми органическими изменениями тканей мозга и глаз. В ЦНС, тканях глаза, в скелетной мускулатуре формируются цисты. КЛИНИЧЕСКАЯ КАРТИНА. Около 30% детей, заразившихся внутриутробно, имеют при рождении клинически выраженный токсоплазмоз. В остальных случаях - это асимптомные и стертые формы, которые дают поздние клинические проявления с любого момента после рождения, как правило, через месяцы и годы. Последствия токсоплазмозного вялотекущего энцефалита становятся очевидными в начальных классах школы. Дети жалуются на повышенную утомляемость, головные боли, возможны судороги. Часто первичной манифестацией врожденного токсоплазмоза является хориоретинит. При обследовании выявляются признаки олигофрении. Болезнь может продолжаться долгие годы, приводя в ряде случаев к инвалидности ребенка - односторонней слепоте, неврологическим нарушениям. При заражении в 1 триместре беременности может произойти самопроизвольный аборт. При сохранении беременности острая и подострая стадии проходят внутриутробно т.е. ребенок рождается с постэнцефалическими дефектами: необратимыми поражениями ЦНС, глаз. При заражении во 2 триместре беременности органогенез проходит нормально, но воспалительные процессы в организме плода могут вызвать дефекты развития (фетопатии) головного мозга и глаз: гидроцефалия микроцефалия, кальцификаты в ткани головного мозга, микрофтальм, анофтальм, хориоретинит, увеит, катаракта, помутнение, фиброз стекловидного тела При этом острая фаза токсоплазмоза проходит внутриутробно и ребенок рождается в подострой фазе. При заражении женщины в 3 триместре ребенок рождается без дефектов, но с признаками генерализованного токсоплазмоза, к которым относятся: лихорадка, желтуха длительностью 1,5-2 недели, гепато- и спленомегалия, пневмония, миокардит, экзантемы, отеки, кровоизлияния, диспептические явления Поздние проявления врожденного токсоплазмоза в 5-7 лет включают поражения ЦНС и глаз и их последствия: внутричерепную гипертензию, олигофрению, судорожный синдром, нейроэндокринные нарушения, кальцификаты в ткани головного мозга, хориоретинит, увеит, арофия зрительного нерва, колобома 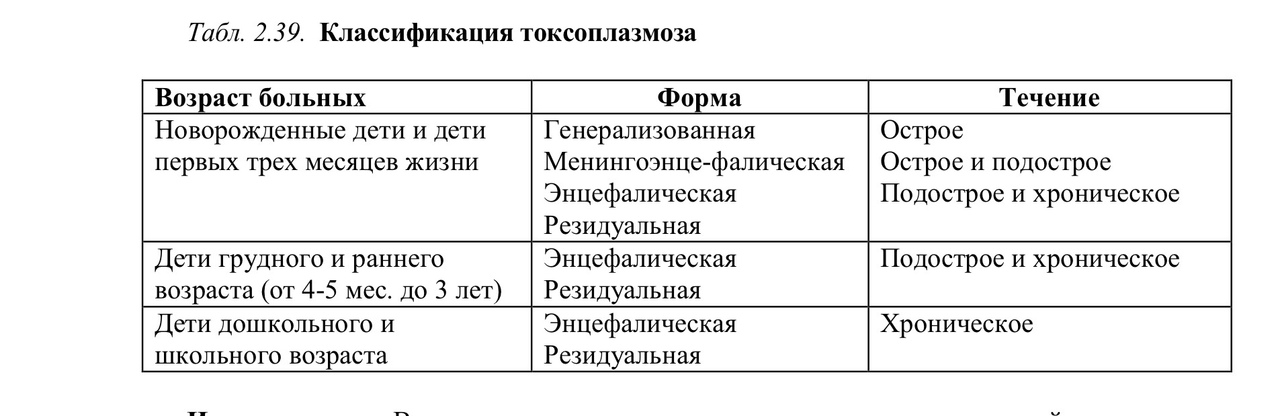 Генерализованная форма Наблюдается у новорожденных и детей первых месяцев жизни. Состояние ребенка тяжелое. Выражены симптомы интоксикации. Частым симптомом является экзантема. Сыпь обычно имеет пятнисто-папулезный характер. Возможны кровотечения в слизистые оболочки и склеры. Характерным является отечный синдром. Часто отмечается желтуха, которая бывает различной по интенсивности и нередко носит затяжной характер. Характерно увеличение печени и селезенки, всех групп лимфатических узлов. Реже в процесс вовлекаются и другие органы. Развиваются пневмонии, преимущественно интерстициальные, реже миокардиты, энтероколиты. В моче обнаруживаются белок, цилиндры, эритроциты. В крови - повышенный нейтрофильный лейкоцитоз и эозинофилия. Поражение ЦНС в этом периоде отмечаются не резко выраженные симптомы. . Изменения со стороны глаз в этом периоде уже возникают, но чаще не обнаруживаются. Заболевание протекает тяжело и может закончиться летально. Возможен переход в подострое и хроническое течение. дострое и хроническое течение. Менингоэнцефалическая форма Наблюдается в периоде новорожденности или у детей первых месяцев жизни. Ведущими синдромами являются неврологические, отмечается поражение глаз, гепатоспленомегалия. Клиническими проявлениями болезни могут быть рвота или частые срыгивания, беспокойство или вялость и сонливость. При более тяжелом течении уже в периоде новорожденности могут наблюдаться припадки клонико-тонических судорог, тремор, иногда параличи и парезы конечностей, поражение черепно-мозговых нервов. Очень характерна прогрессирующая гидроцефалия. Выявляются менингеальные знаки - напряжение большого родничка, ригидность мышц затылка, гиперестезия. На рентгенограмме черепа обычно выявляются кальцификаты, иногда они слишком мелки, и их удается обнаружить на компьютерной томографии мозга или только при патогистологических исследованиях. Поражение глаз характеризуется наличием иридоциклита, хориоретинита, помутнением стекловидного тела, атрофией зрительного нерва. Энцефалическая форма Наблюдается у детей всех возрастных групп. Процесс характеризуется сочетанием уже сформированных изменений с продолжающимся хроническим или подострым воспалением в ЦНС. Для этой формы особенно характерна триада симптомов – гидроцефалия, внутримозговые кальцификаты, хориоренитит. Голова у ребенка принимает долихоцефалическую или шаровидную форму, лобные и теменные бугры выдаются, на висках и на лбу выступают расширенные вены, ребенок не удерживает голову. Признаки гидроцефалии выявляются также рентгенологически в виде изменения формы и размеров черепа, преждевременного обызвествления швов, истончения костей свода черепа. Частым симптомом хронически текущего процесса является поражение глаз в виде хориоретинита и увеита. Необратимые изменения со стороны глаз могут проявиться развитием атрофии зрительного нерва, катаракты, колобомы, обызвествлением хрусталика. Характерными проявлениями энцефалической формы у детей раннего возраста являются отставание в физическом и нервно-психическом развитии: нарушение развития речи и двигательных функций, церебральные спастические параличи или парезы, олигофрения, развитие гидроцефалии или микроцефалии, формирование полиморфных эпилептических припадков. Наблюдается также поражение глаз в виде хориоретинита и иридоциклита, гепатолиенальный синдром. Энцефалическая форма с хроническим течением в дошкольном и школьном возрасте характеризуется неврологическими синдромами, поражением глаз, нейроэндокринными расстройствами. Со стороны нервной системы наблюдается недоразвитие психики и речи, олигофрения. Нарушение статокинетических функций и моторики проявляется развитием церебральных параличей (пирамидных, экстрапирамидных, мозжечковых и смешанных). Особенностью являются эпилептические припадки. При токсоплазмозной эпилепсии наблюдаются полиморфные психотические состояния – психомоторное возбуждение с нарушением ориентировки различной длительности, шизофреноподобный синдром с галлюцинациями и кататоническими расстройствами, аффективные вспышки, астеническая депрессия. Поражение гипоталамо-гипофизарной области проявляется болезнью ИценкоКушинга, гипоталамическим синдромом пубертатного периода, адипозо-генитальным ожирением, гипофизарным нанизмом. Резидуальная форма у новорожденных и детей первых месяцев жизни отмечается в тех случаях, когда ребенок рождается с дефектами развития, но без явлений продолжающегося патологического процесса. Дети могут иметь аномалии развития, являющиеся следствием эмбриопатии - врожденный порок сердца, расщепление твердого неба и верхней губы, недоразвитие конечностей, микрофтальмию или даже полное отсутствие глазного яблока, катаракту, микроцефалию. Если заболевание приостанавливается на более поздних этапах развития в связи с гибелью токсоплазм, то наряду с эмбриональными пороками (или без них) обнаруживаются фетопатии - остаточные явления воспалительного процесса со стороны ЦНС и глаз ЛЕЧЕНИЕ Для лечения врожденного токсоплазмоза в неонатальном периоде наиболее эффективны препараты пириметамина в комбинации с сульфаниламидами. Используют две схемы: 1–я схема – пириметамин (хлоридин) 1 мг/кг/сут (в 2 приема) в комбинации с сульфаниламидом короткого действия 0,1 мг/кг/сут (в 3-4 приема), курсами пириметамин — 5 дней, сульфаниламид — 7 дней, с повторением трижды с интервалом 7–14 дней. По показаниям (хроническая форма при иммунодефицитном состоянии, обострение хориоретинита и др.) курс терапии повторяют через 1-2 мес., при непереносимости сульфаниламидов возможна терапия пириметамином в комбинации с клиндамицином по 10-40 мг/(кг х сут) в 3 введения. 2–я схема – пириметамин 1 мг/кг/сут в сочетании с ко–тримоксазолом (бисептол, бактрим, септрин) 6 мг/кг/сут по триметоприму или с макролидами (спирамицин l50–300 тыс. ЕД/кг/сут в 2 приема в течение 10 дней, рокситромицин 5-8 мг/кг/сут, азитромицин 5 мг/кг/сут в течение 7-10 дней). Побочные действия всех антифолатов устраняют назначением производного фолиевой кислоты. Официнальный препарат кальция фолинат назначают по 1-5 мг 1 раз в 3 дня в течение всего курса терапии. Учитывая высокий процент хронизации врожденного токсоплазмоза отечественные и зарубежные педиатры как в случае болезни, так и в случае субклинической инфекции рекомендуют проводить лечение в течение целого года. 8. Врожденный микоплазмоз. Эпидемиология. Клиника. Локальные и генерализованные формы. Течение. Методы диагностики. Дифференциальный диагноз. Лечение. Микоплазменные инфекции (МИ) - острые инфекционные заболевания человека и животных, вызываемые микоплазмами. У женщин с микоплазменной инфекцией внутриутробное инфицирование плода происходит в 96% случаев. Этиология. Большинство микоплазм являются условно-патогенными микроорганизмами. В настоящее время их принято относить к бактериям. Микоплазмы способны как к внутриклеточному, так и внеклеточному размножению. Патогенность микоплазм определяется большой их подвижностью и способностью прикрепляться к различным клеткам хозяина, оказывая токсическое и деструктивное действие. Патогенез. Уникальные биологические свойства микоплазм позволяют им персистировать в организме хозяина, вызывая хронические воспалительные процессы и аутоиммунные патологические состояния. В зависимости от периода внутриутробного развития плода под воздействием микоплазм могут возникать эмбриопатии, фетопатии и генерализованный инфекционный процесс. Эмбриопатии приводят к формированию пороков развития и нередко являются причиной спонтанных абортов. При фетопатиях микоплазменной этиологии возможно возникновение пороков развития, которые являются результатом пролиферативных и альтеративных процессов, приводящих к сужению каналов и отверстий. Инфицированные околоплодные воды вызывают спазм сосудов плаценты, что приводит к уменьшению кровоснабжения плода, развитию внутриутробной гипоксии, задержке развития и гибели плода. При заражении плода после 27 недель гестационного периода плод приобретает способность к специфической реакции на внедрение возбудителя инфекции в виде лейкоцитарной инфильтрации, тканевых и гуморальных изменений. Для гематогенного (трансплацентарного) пути инфицирования характерна полиорганность поражения (печени, легких, ЦНС, перикарда, кожи), которая обусловлена как вегетацией самого возбудителя, так и воздействием продуцируемого экзотоксина. Развитие генерализованного инфекционного процесса происходит под влиянием таких провоцирующих факторов, как внутриутробная гипоксия, асфиксия, родовая травма и т.д. Инфицирование плода может возникать и во время прохождения плода по родовым путям. Входными воротами инфекции чаще всего является слизистая глаз, половых органов (у девочек) и дыхательных путей. Наиболее выраженные изменения отмечаются в органах дыхания. При инфицировании микоплазмой вначале наблюдается интенсивное размножение микоплазмы, без поражения клеток организма. В дальнейшем происходит внедрение микоплазмы в клетку, что ведет к ее деструкции и гибели. |
