Методичка ОХТ. Практикум для студентов специальностей 148 01 01 Химическая технология производства и переработки неорганических материалов
 Скачать 0.72 Mb. Скачать 0.72 Mb.
|
|
3.1.4. Задание к лабораторной работе по восстановлению диоксида углерода
3.2. Разложение карбонатов и синтез силикатов Цель работы – исследование гетерогенного эндотермического процесса в системе твердое – газ на примере высокотемпературного разложения карбонатов и изучение влияния технологических параметров (температуры, дисперсности) на показатели процесса (степень и скорость превращения). 3.2.1. Общие положения Обжиг карбонатного сырья – крупнотоннажный процесс, который используется в различных отраслях народного хозяйства: в производстве строительных материалов, металлургии, химии, сахарной промышленности и др. Обычно обжиг известняка и мела проводят в шахтных печах, иногда в барабанных вращающихся печах или в печах с кипящим слоем. Разложение карбоната кальция протекает по реакции СаСО3 СаО + СО2; Н298 = 178,43 кДж/моль и сопровождается значительным поглощением тепла. Тепловой эффект реакции в интервале температур 1173–1473 К равен в среднем 158,7 кДж/моль. Поскольку СаСО3 и СаО твердые вещества, то выражение для константы равновесия можно записать следующим образом: КР = Данные о зависимости равновесного парциального давления от температуры приведены в табл. 4. Табл. 4. Равновесное парциальное давление СО2 над СаСО3
Равновесное давление СО2, равное атмосферному, достигается при температуре 1171 К, следовательно, это наименьшая температура, при которой обеспечивается необходимая скорость разложения карбоната кальция. Равновесное давление зависит также от размеров кристаллов карбоната, поэтому реальная величина равновесного парциального давления для известняка различных месторождений, мрамора и мела может отличаться от приведенных в табл. 4. Скорость разложения СаСО3 выражается уравнением v = v1 – v2, (29) где v1 и v2 – скорость прямой и обратной реакций. Учитывая, что скорость обратной реакции незначительна, уравнение скорости можно представить следующим образом: v = dG / dt = K где К – константа скорости реакции; Из уравнения следует, что скорость разложения известняка пропорциональна парциальному давлению диоксида углерода и с повышением температуры обжига скорость процесса увеличивается. Оптимальная температура обжига – 1172–1273 К. Кроме температуры обжига, на скорость разложения оказывает влияние размер частиц, наличие примесей и другие факторы. Примеси легкоплавких соединений, как правило, увеличивают скорость разложения. Например, высокотемпературный синтез силикатов осуществляется по суммарному уравнению nMеCO3 + mSiO2 nMеO mSiO2 + nCO2; Н > 0. Значение константы равновесия будет определяться парциальным давлением СО2 согласно формуле 28. В случае присутствия легкоплавких веществ или эвтектик константа равновесия будет зависеть от концентрации компонентов в жидкой фазе КР = P n Давление диоксида углерода над реакционной смесью будет значительно зависеть от растворимости исходных и конечных веществ в расплаве. В начале процесса обжига шихты разлагаются карбонаты с образованием оксидов и СО2. Затем оксиды взаимодействуют с диоксидом кремния с образованием соответствующих силикатов 2МеО + SiO2 2МеО SiO2. 3.2.2. Описание лабораторной установки и порядок выполнения работы К 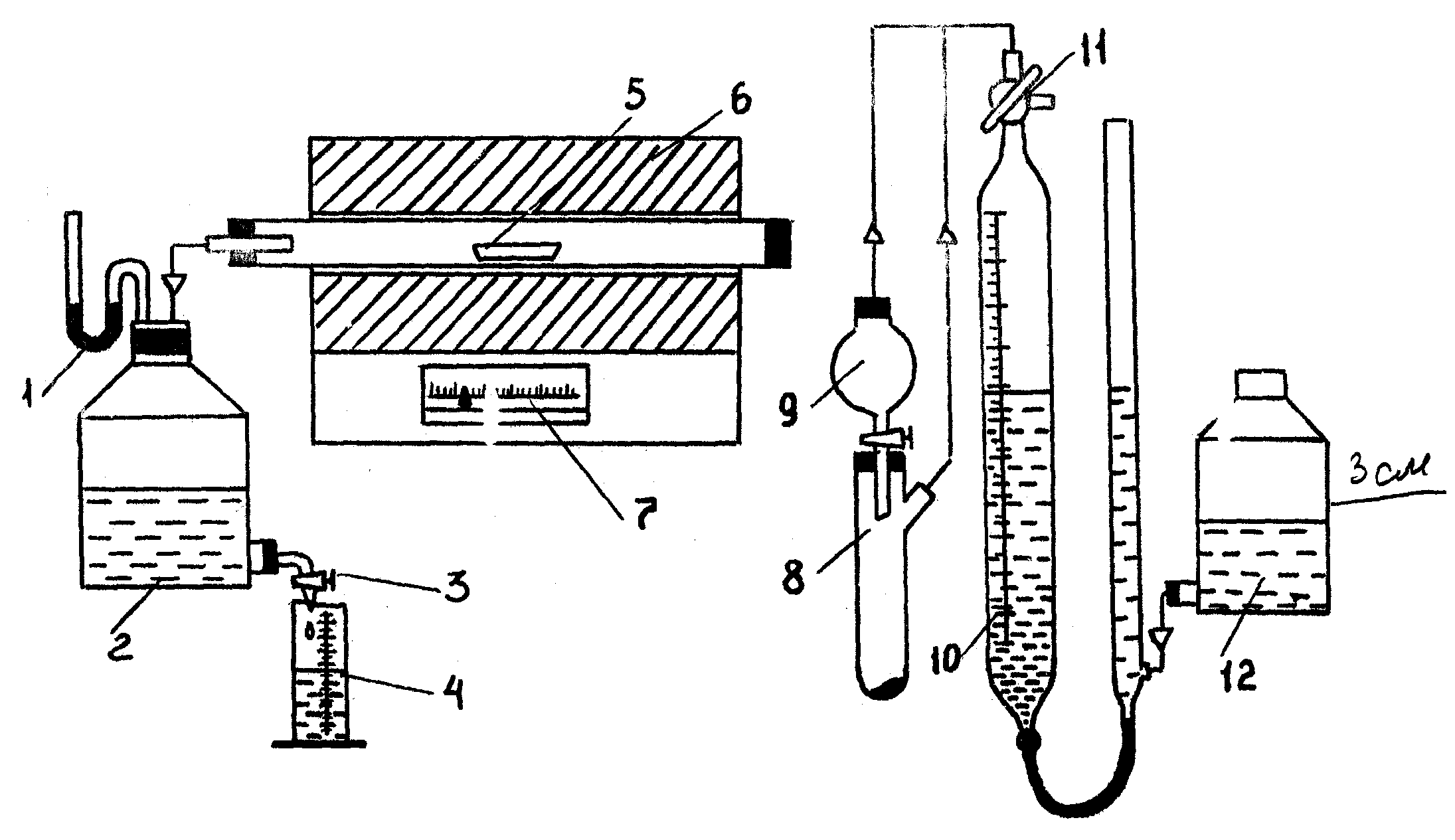 инетику разложения карбоната кальция и синтеза силикатов исследуют на лабораторной установке, схема которой приведена на рис. 4. Рис. 4. Схема лабораторной установки: 1 − манометр; 2 − аспиратор; 3 − кран; 4 − мерный цилиндр; 5 − фарфоровая лодочка; 6 − печь; 7 − регулирующий потенциометр; 8 − пробирка; 9 − воронка с краном; 10 − мерная бюретка; 11 − трехходовой кран; 12 − уравнительная емкость Для нагревания используется горизонтальная трубчатая печь 6 с электрообогревом. В фарфоровую или кварцевую трубку печи помещается лодочка 5 с образцом исследуемой смеси. Температура в печи измеряется с помощью термопары и регулируется автоматически регулирующим потенциометром 7. Газ, который выделяется при разложении карбонатов, поступает в аспиратор 2. При этом уровень воды в манометре 1, который соединен с аспиратором 2, начинает изменяться. Для того чтобы измерить объем газа, который образуется при разложении карбонатов, необходимо выпускать через кран воду из аспиратора 2 до уравновешивания уровней жидкости в U-образной трубке манометра 1 и замерять объем вытесненной воды при помощи мерного цилиндра. Об окончании процесса разложения свидетельствует завершение выделения газа в аспиратор (при закрытом кране уровень воды не изменяется). Порядок выполнения работы 1) Включите печь 6 и установите регулирующим потенциометром 7 заданную температуру. 2) Приготовьте образцы смесей заданного состава и навески массой приблизительно 2 г и поместите в фарфоровые лодочки 5. Взвешивание проводите на технических весах. Лодочку с образцом смеси поместите в трубчатую печь на расстоянии 2–3 см от края печи для начального нагрева до 573–872 К (если сразу поместить лодочку в зону высоких температур, то она может разрушиться из-за высоких температурных напряжений). Аспиратор 2 заполните водой. Под кран аспиратора поместите цилиндр емкостью 100 или 250 мл. 3) После достижения заданной температуры железным прутом продвиньте лодочку в середину печи и плотно закройте трубку пробкой, с которой соединен аспиратор 2. Зафиксируйте этот момент как начало исследования. Когда уровень воды в манометре начнет изменяться, откройте кран таким образом, чтобы уровень воды в манометре был неизменным. Фиксируйте время, в течение которого из аспиратора будет выделяться 25 мл воды. Если же через минуту уровень воды в манометре не изменится, то это свидетельствует о негерметичности установки. В этом случае необходимо проверить все соединения на герметичность и более плотно закрыть трубку пробкой. 4) После завершения исследования (уровень воды в манометре при закрытом кране не изменяется) с помощью металлического захвата достаньте лодочку 5 из печи и поместите ее на фарфоровую подставку охлаждаться. Повторите исследование при другой температуре или с другим составом смеси (по заданию преподавателя). 5) После окончания исследований выключите печь и проведите анализы образцов исходной смеси и конечных продуктов (по заданию преподавателя) на содержание в них СО2. 6) Полученные экспериментальные и расчетные данные представьте в табл. 5. Табл. 5. Условия опытов, экспериментальные и расчетные данные
3.2.3. Методы анализа Определение концентрации диоксида углерода в карбонатах Анализ основан на разложении карбонатов соляной кислотой и измерении выделившегося объема диоксида углерода: МеСО3 + 2HCl = MeCl2 + H2O + CO2. Анализ проводят на установке, схема которой приведена на рис. 4. Запорной жидкостью служит 20%-ный раствор хлорида натрия, подкисленный соляной кислотой, в который добавлено несколько капель метилового оранжевого с целью получения окрашенного раствора. Ход анализа В пробирку 8 поместите навеску исследуемой смеси (взвешивание проводят на аналитических весах) или точный объем исследуемого раствора (с помощью пипетки) и смойте дистиллированной водой частички, которые остались на стенках пробирки. Количество исследуемого вещества должно быть таким, чтобы образовалось не более 180 мл газа (в пределах 100–160 мл). Закрепите пробирку в штативе, соедините ее с бюреткой резиновой трубкой и закройте пробирку пробкой, с которой соединена воронка. При закрытом кране залейте в воронку 10%-ный раствор НСl и закройте воронку пробкой, с которой соединена бюретка. Проверьте установку на герметичность. Для этого соедините краном 11 бюретку 10 с атмосферой. Уравнивающей склянкой 12 установите уровень жидкости в бюретке 10 на верхней метке, затем краном 11 соедините бюретку 10 с воронкой 9 и поставьте уравнивающую склянку на стол. Через 5 мин выровняйте уровни в бюретке 10 и в склянке 12. Если эти уровни находятся на верхней метке, то установка герметична. В противном случае необходимо проверить все соединения на герметичность и снова провести проверку. Кран на воронке 9 открывайте постепенно, для того чтобы кислота вытекала в пробирку (большое количество кислоты приводит к образованию пены, которая переносит часть исследуемого образца в верхнюю часть пробирки, в таком случае эта часть образца не подвергается разложению и исследование следует повторить). Если при добавлении кислоты не наблюдается выделения газа, то пробирку необходимо немного подогреть для завершения реакции. После завершения реакции поднимите уравнивающую склянку 12, чтобы выровнять уровни в ней и в бюретке, и измерьте объем выделившегося газа. 3.2.4. Расчет показателей процесса разложения карбонатов по экспериментальным данным Объем СО2, выделившегося при разложении исходной навески соляной кислотой, приведенный к нормальным условиям, где Vв – объем вылитой из аспиратора воды, мл; Ра – атмосферное давление в момент исследования, кПа; Рв – парциальное давление водяного пара, кПа; Т – температура воды в аспираторе, К. Массовая доля СО2 в навеске рассчитывают по формуле 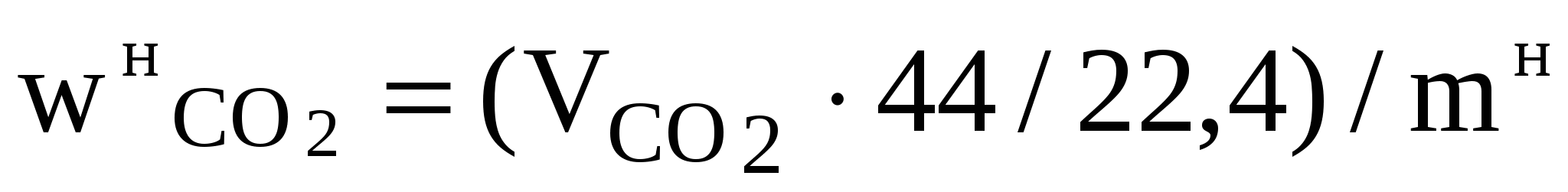 , (33) , (33)где Массовую долю карбоната в исходной навеске определяют по формуле wкарб = 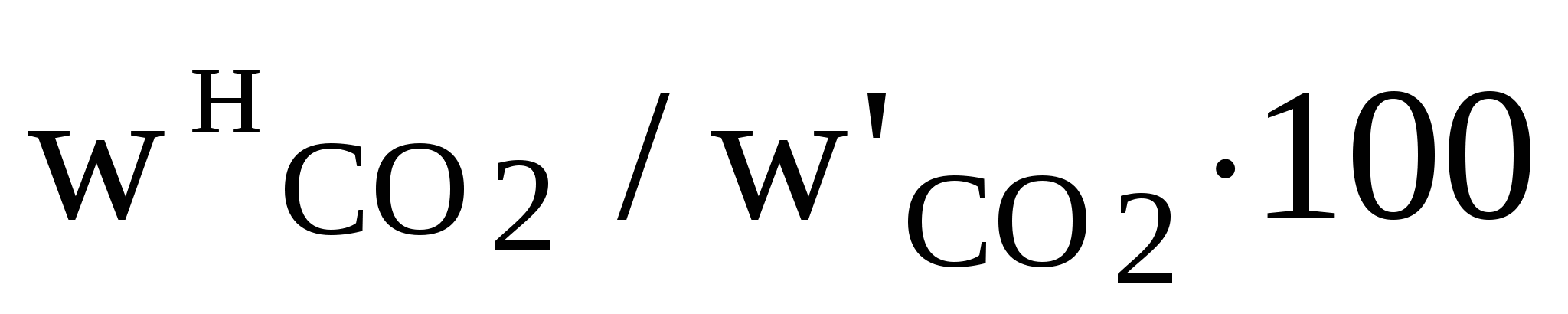 , (34) , (34)где Степень разложения карбоната рассчитывают по формулеХ = где Выход СО2 определяют по формуле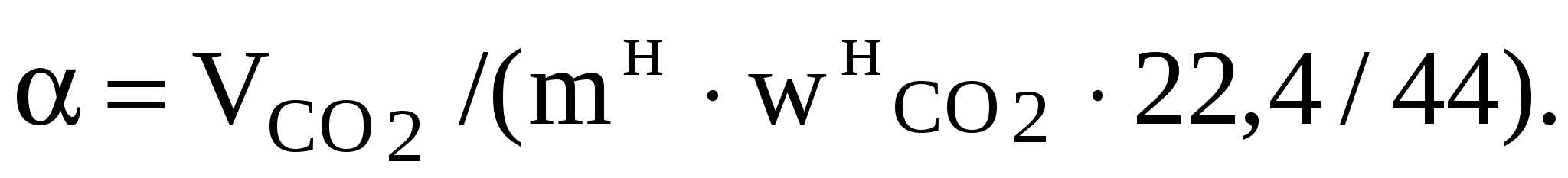 (36) (36)Скорость разложения карбонатов находим по формулеv = V / t, (37) где V – объем СО2, выделившегося за промежуток времени t. 3.2.5. Задание к лабораторной работе
3.3. Обжиг сульфидных руд Цель работы исследовать влияние технологических параметров (температуры обжига, избытка воздуха, состава и дисперсности колчедана) на основные показатели гетерогенного процесса (степень и скорость выгорания серы). | ||||||||||||||||||||||||||||||||||||||||||||||||
