Методичка ОХТ. Практикум для студентов специальностей 148 01 01 Химическая технология производства и переработки неорганических материалов
 Скачать 0.72 Mb. Скачать 0.72 Mb.
|
Выход феррита натрия рассчитывается по формулеВ = 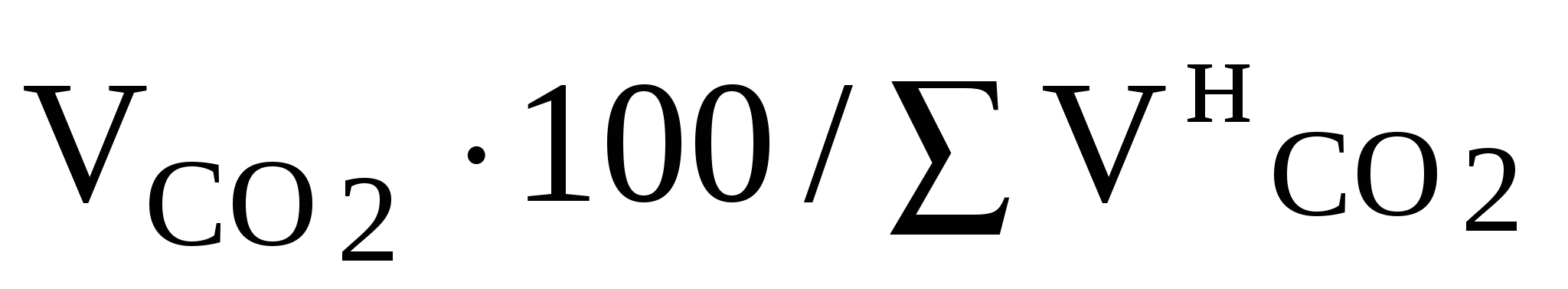 , (45) , (45)где В – выход феррита натрия, %; Скорость каустификации v, см3/с, рассчитывается по формулеv = V / t, (46) где V – объем СО2, который выделился за промежуток времени t. Выход NaOH , %, рассчитывается по формуле В = NNaOH 100 / NNaOH(т), (47) где NNaOH – количество фактически полученного NaOH, моль; NNaOH(т) – количество теоретически возможного NaOH, которое могло бы образоваться из взятой навески, моль. Полученные экспериментальные и расчетные данные следует оформить в виде табл. 7. Табл. 7. Условия опыта, экспериментальные и расчетные данные
3.4.5. Задание к лабораторной работе
4. Гетерогенные процессы в системегаз – жидкость4.1. Общие положения Газожидкостные реакции – это гетерогенные процессы, включающие химическое взаимодействие между реагентами, один из которых находится в газовой фазе, а другой – в жидкой. Жидкость может представлять собой раствор вещества, химически взаимодействующего с газообразным реагентом; в ряде случаев происходит взаимодействие растворяющегося газа с самим растворителем. Газожидкостные реакции широко используют в химической технологии. Примеры их применения:
Газожидкостные реакции принято рассматривать как процессы абсорбции, сопровождающиеся химическим взаимодействием. Такой подход позволяет применить к этой группе химических процессов закономерности массопередачи. При этом считают, что протекание химической реакции на границе раздела газовой и жидкой фаз или в глубине жидкой фазы приводит к ускорению процесса абсорбции. Возможность таким образом ускорить процесс массопередачи широко используется в практике. При добавлении к растворителю реагентов, вступающих в быстрые химические реакции с компонентами, извлекаемыми из газовой фазы, удается существенно интенсифицировать процесс абсорбции. Например, диоксид углерода СО2 можно извлечь из газовой смеси путем абсорбции водой под давлением. Применение вместо воды растворов этаноламинов или карбонатов, вступающих в химическое взаимодействие с СО2, позволяет во много раз повысить интенсивность абсорбции. Равновесие в системе газ – жидкость, как и для других гетерогенных систем, определяется с помощью правила фаз, закона распределения и константы равновесия химических реакций в жидкой фазе. Равновесие между фазами определяется термодинамическими свойствами компонента и поглотителя и зависит от состава одной из фаз, температуры и давления. При абсорбции равновесие можно сместить в сторону увеличения растворимости газа, уменьшая температуру, что снижает равновесное давление газа над раствором (рг* или сг*), увеличивая начальную концентрацию поглощаемого компонента в газе (сгн) или общее давление Р, что также увеличивает сгн. Для понижения температуры охлаждают исходные газ и жидкость, отводят теплоту абсорбции с помощью встроенных или наружных теплообменников. Иногда отвод теплоты абсорбции осуществляют без охлаждения, используя эту теплоту для концентрирования раствора в самом абсорбере. При десорбции газов из жидкостей равновесие смещают обратными приемами, т. е. повышением температуры и понижением давления; для этого обогревают десорбер с помощью теплообменников или острого пара. Кинетика абсорбции (т. е. скорость процессов массопереноса) определяется движущей силой процесса (т. е. степенью отклонения системы от равновесного состояния), свойствами поглотителя и поглощаемых компонентов, устройством абсорбционного аппарата и гидродинамическим режимом его работы, а также способом контакта фаз:
4.2. Абсорбция диоксида серыЦель работы – исследование процесса абсорбции SO2 и установление влияния параметров (концентрации SO2, концентрации поглотителя и его химического состава) на степень абсорбции SO2. Отходящие газы тепловых электростанций, котельных, металлургических заводов, сернокислотных цехов и ряда других производств содержат 0,2–1,0 об. % SO2. Выброс таких газов в атмосферу недопустим из-за вредного воздействия SO2 на окружающую среду. Разработано большое количество методов очистки газов от SO2, наиболее распространенным из которых является абсорбция SO2 жидкими поглотителями (растворы соды, аммиака, гидроксида натрия, сульфата аммония, а также вода). Абсорбция SO2 указанными растворами сопровождается следующими химическими реакциями: Na2CO3 + SO2 = Na2SO3 + CO2; Na2CO3 + 2SO2 + H2O = 2NaHSO3 + CO2; 2NaOH + SO2 = Na2SO3 + H2O; NaOH + SO2 = NaHSO3; 2NН4OH + SO2 = (NH4)2SO3 + H2O; (NH4)2SO3 + SO2 + H2O = 2NH4НSO3; H2O + SO2 = H2SO3. Абсорбция SO2 раствором соды используется как промышленный способ получения сульфита натрия. Эту реакцию при температурах до 95С можно считать необратимой. | |||||||||||||||||||||||||||||||||||||||||||||||
