Методичка ОХТ. Практикум для студентов специальностей 148 01 01 Химическая технология производства и переработки неорганических материалов
 Скачать 0.72 Mb. Скачать 0.72 Mb.
|
4.2.1. Описание лабораторной установки и порядок выполнения работыДиоксид серы, абсорбируемый жидкими поглотителями, получают путем сжигания колчедана согласно уравнению реакции 4FeS2 + 11O2 2Fe2O3 + 8SO2. Для этого используется горизонтальная трубчатая печь с электрообогревом 6 (рис. 7), в фарфоровую трубку которой помещается лодочка с навеской колчедана. Температура в печи измеряется термопарой и регулируется автоматически потенциометром. Воздух в трубчатую печь подается с помощью компрессора 8, объемный расход воздуха измеряется реометром 7 и регулируется краном 9. Выходящий из печи газ, содержащий SO2 и воздух, подается в абсорбер 4, который представляет собой стеклянную трубку, заполненную насадкой. Орошающую жидкость подают из емкости 1 с расходом 10–30 мл/мин. Расход орошающей жидкости регулируют краном 2. Раствор, вытекающий из абсорбера, поступает в сборник 5, а отходящий газ – в склянку с раствором йода 10 и далее в аспиратор 11. Рис. 7. Схема лабораторной установки: 1 − емкость; 2 − кран; 3 − трехходовой кран; 4 − абсорбер; 5 − сборник; 6 − трубчатая печь; 7 − реометр; 8 − компрессор; 9 − кран; 10 − дрексель; 11 − аспиратор; 12 − мерный цилиндр Порядок выполнения работы
4.2.2. Расчет показателей процесса абсорбции диоксида серы По полученным экспериментальным данным рассчитывают степень абсорбции и концентрацию SO2 на выходе из абсорбера. Степень абсорбции SO2 (Х), %, находят по формуле где Массу SO2, поступившего в абсорбционную колонку, рассчитывают исходя из уравнения S + O2 = SO2. Массу выгоревшей серы определяют согласно соотношению ms = m /К, (49) где m = m1 – m2; m1 – масса лодочки с колчеданом до обжига; m2 – масса лодочки с колчеданом после обжига; К – коэффициент, учитывающий прирост массы за счет образования Fe2O3. Коэффициент К рассчитывается исходя из уравнения 4FeS2 + 11O2 = 8SO2 + 2Fe2O3 и равен 0,63. Массу сернистого ангидрида SO2 + I2 + 2H2O = H2SO4 + 2HI. Массу йода, вступившего во взаимодействие с SO2, находят по разности где Объемную долю SO2 в отходящем газе после абсорбции где Vвозд = Vводы 273,15 (Ра – Рв)/ (Т Р0), (52) где Vводы – объем воды, которая вытекла из аспиратора, мл; Ра – атмосферное давление в момент опыта, кПа; Рв – парциальное давление паров воды согласно табл. 8, кПа; Т – температура воды в аспираторе, К; Р0 – стандартное давление, Р0 = 101,325 кПа. Табл. 8. Равновесное давление паров воды
Результаты исследования процесса абсорбции SO2 жидкими поглотителями представьте в виде табл. 9. 4.2.3. Задание к лабораторной работе
Табл. 9. Условия опыта, экспериментальные и расчетные данные
5. ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ 5.1. Общие положения В химической промышленности каталитические процессы приобрели очень широкое распространение. В настоящее время большинство важнейших химических продуктов (свыше 70%) получают с использованием катализаторов. В общем случае под катализом понимают изменение скорости химической реакции под действием химических веществ (катализаторов), которые участвуют в образовании промежуточных активных комплексов при этом не изменяют свой химический и фазовый состав. В случае, если в результате каталитического процесса скорость реакции возрастает, катализ называют положительным, в случае снижения скорости реакции катализ называют отрицательным. Катализаторы, которые замедляют скорость реакции, называют ингибиторами. Ускоряющее действие катализаторов состоит в понижении энергии активации реакции за счет изменения механизма реакции. В присутствии катализатора реакция протекает через ряд промежуточных стадий, требующих меньшей энергии активации. При снижении энергии активации скорость реакции возрастает в соответствии с уравнением Аррениуса: k = k0 e – E / RT, (53) где k0 предэкспоненциальный множитель; Е энергия активации, Дж/моль; R универсальная газовая постоянная, Дж/моль К; Т температура, К. Одновременно со снижением энергии активации в ряде случаев наблюдается уменьшение порядка реакции, так как порядок элементарных стадий каталитических реакций может быть меньше порядка некаталитической реакции. Использование катализатора не влияет на равновесие химической реакции, поскольку начальное и конечное состояния реагирующей системы, в том числе и свободной энергии Гиббса, одинаковы как с катализатором, так и без него. Изменяя в равной степени скорость прямой и обратной реакций, катализатор способствует повышению скорости достижения равновесия при данных условиях. Классификация каталитических процессов и реакций производится по ряду признаков. По фазовому состоянию реагентов и катализатора каталитические процессы разделяют на две основные группы гомогенные и гетерогенные. При гомогенном катализе катализаторы и реагенты находятся в одной фазе газе или растворе, а при гетерогенном – в разных фазах. По типу взаимодействия катализатора с реагирующими веществами все каталитические реакции делятся на два класса окислительно-восстановительные (гомолитические) и кислотно-основные (гетеролитические). В промышленности наиболее распространен гетерогенный катализ на твердых катализаторах. На скорость гетерогенно катализа влияют как массообменные процессы, так и химическая реакция. В общем случае процесс катализа на твердых пористых катализаторах состоит из следующих элементарных стадий: 1) диффузии реагирующих веществ из ядра потока к поверхности зерен катализатора; 2) внутренней диффузии реагентов в порах зерна катализатора; 3) активированной адсорбции (хемосорбции) на поверхности катализатора с образованием промежуточных поверхностно-активных комплексов; 4) перегруппировки атомов с образованием продуктов реакции; 5) десорбции продукта с поверхности катализатора; 6) внутренней диффузии продуктов в порах зерна катализатора; 7) диффузии продукта от поверхности зерна катализатора в ядро потока. Общая скорость гетерогенно-каталитического процесса определяется наиболее медленной (лимитирующей) стадией. В зависимости от лимитирующей стадии каталитический процесс на твердом пористом зерне катализатора может проходить в кинетической, внешнедиффузионной или внутридиффузионной областях. Качество катализаторов характеризуется следующими основными показателями: активностью, температурой зажигания, селективностью (избирательностью), устойчивостью к контактным ядам, термостойкостью, механической прочностью, доступностью и невысокой стоимостью и др. Одной из важнейших характеристик катализатора является активность, т. е. мера ускоряющего действия катализатора по отношению к данной реакции. Активность определяется из соотношения А = kк / k = e E / RT, (54) где kк, k константы скорости реакции в присутствии катализатора и без катализатора; E снижение энергии активации под действием катализатора. E = Е – Ек, (55) где Ек, Е энергия активации реакции в присутствии катализатора и без катализатора. Температурой зажигания катализатора называют минимальную температуру, при которой процесс протекает с достаточной для практических целей скоростью. Чем активнее катализатор, тем ниже температура зажигания, что особенно важно при проведении обратимых экзотермических реакций, так как при этом можно достигнуть большую степень превращения. Промышленные катализаторы изготавливают в виде зерен, таблеток, колец или цилиндров. С учетом перечисленных характеристик происходит выбор катализаторов для каждого конкретного химико-технологического процесса. 5.2. Каталитическое окисление диоксида серы Цель работы изучение влияния технологических параметров (температуры, состава реакционной смеси, объемной скорости газового потока) на основные показатели каталитического процесса (степени превращения и производительности катализатора). Типичным примером гетерогенного каталитического процесса является процесс каталитического окисления диоксида серы. Этот процесс широко используется в промышленности основного неорганического синтеза, в частности для получения серной кислоты и описывается следующим уравнением реакции: SO2 + 1/2O2 SO3; Н = 96,7 кДж. Как видно из уравнения, реакция окисления диоксида серы является обратимой, экзотермической. Основными параметрами, влияющими на равновесие химических реакций, являются температура, давление и концентрация реагирующих веществ. Равновесное состояние характеризуется константой равновесия, выраженной через равновесные парциальные давления компонентов следующим образом: КР = | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T, С | Хр, % | t, С | Хр, % |
| 400 420 440 460 480 500 | 99,2 98,7 97,9 96,9 95,4 93,4 | 520 540 560 580 600 620 | 90,7 87,4 83,4 78,7 73,4 67,6 |
Знание равновесных параметров позволяет определить верхний предел максимально возможной при данных условиях степени превращения. Поскольку равновесное состояние характеризует реакционную систему через бесконечное время после начала реакции, то для характеристики реальных процессов и установления оптимальных технологических параметров необходимо кроме термодинамических факторов учитывать и кинетические. При этом следует вести процесс так, чтобы достичь высоких технологических показателей за более короткое время, т. е. скорость процесса должна быть максимальной. Проанализируем влияние технологических параметров на скорость окисления SO2.
Известно, что скорость практически всех реакций с увеличением температуры возрастает в соответствии с уравнением Аррениуса. Изучаемый процесс не представляет исключения, однако влияние температуры на фактическую степень превращения имеет более сложный характер. Это связано с тем, что процесс окисления SO2 в SO3 является обратимым и экзотермическим, поэтому с увеличением температуры возрастает скорость как прямой, так и обратной реакции. В области низких степеней контактирования скорость прямой реакции превосходит скорость обратной вследствие высокой концентрации исходных реагентов и низкой продуктов реакции. В этих условиях фактическая степень превращения Xф с ростом температуры увеличивается. Но при достижении некоторых величин степени превращения и температуры скорости прямой и обратной реакций выравниваются, и при дальнейшем увеличении температуры Xфуменьшается.
На рис. 8 показана зависимость равновесной и фактической степени превращения от температуры при различном времени контактирования (соприкосновения) реагирующих веществ с катализатором. Время контактирования является важной технологической характеристикой каталитического процесса, зная которое можно производить расчет реакционных аппаратов. На практике чаще всего пользуются условным временем контактирования
= Vк / V, (60)
где Vк объем катализатора, м3; V объем газа, проходящий через катализатор в единицу времени при нормальных условиях м3/ч.
Рис. 8. Зависимость равновесной и фактической степени превращения от
температуры при различном времени контактирования
Как видно из рис. 8, с увеличением времени контактирования (4 > 3 > 2 > 1) фактическая степень превращения увеличивается и положение максимума на кривых смещается в сторону более низких температур. Соединяя на этом рисунке точки, соответствующие максимальной степени превращения X, получают линию оптимальных температур (ЛОТ), или оптимальную температурную последовательность, показывающую, что по мере протекания процесса следует увеличивать время соприкосновения газа с катализатором и понижать температуру. Таким образом, оптимальным является осуществление процесса окисления SO2 в SO3 в политропном режиме (по линии оптимальных температур), позволяющем поддерживать максимальную скорость достижения заданной конечной степени превращения.
Для практического осуществления данного режима в настоящее время наиболее широко используется пятислойный контактный аппарат с неподвижным слоем катализатора. Регулирование температуры на входе в каждый слой осуществляется путем частичного отвода тепла во встроенных или выносных теплообменниках, а также путем подвода холодной реакционной газовой смеси. Слои катализатора отличаются лишь толщиной, которая возрастает от первого слоя к последнему. Это обеспечивает увеличение времени пребывания реагентов на каждом последующем слое и компенсирует снижение скорости химической реакции, вызванное уменьшением концентрации исходных реагентов в газовой смеси и понижением температуры от первого слоя к последующим. Подробнее работа контактных аппаратов рассматривается при изучении темы «Реакторы для осуществления гетерогенных каталитических процессов».
Энергия активации гомогенного окисления диоксида серы составляет свыше 250 кДж/моль, поэтому в отсутствие катализатора взаимодействие SO2 с кислородом протекает очень медленно. Каталитической активностью по отношению к данной реакции обладают многие вещества (платина, оксиды ванадия, железа, хрома и др.). Наиболее активным катализатором является платина, однако она чрезвычайно чувствительна к каталитическим ядам, имеет высокую стоимость и поэтому не применяется. В настоящее время в промышленности для окисления SO2 применяются исключительно ванадиевые катализаторы.
В производстве серной кислоты для окисления SO2 используются различные марки ванадиевых катализаторов (СВД, СВС, ИК и др.), отличающиеся составом и свойствами. Данные катализаторы содержат в своем составе 6–8% пентаоксида ванадия, а также другие вспомогательные вещества (носители, активаторы и др.). Носители служат для создания высокой удельной поверхности, на которую наносят катализатор. Применение носителей улучшает свойства катализаторов и удешевляет их. В качестве носителей при получении ванадиевых катализаторов используют термостойкие и инертные вещества, в частности диатомит и силикагель. Активаторы (промоторы) вводят в состав контактной массы для повышения ее активности.
Промышленные твердые катализаторы обычно не являются индивидуальными веществами. Они представляют собой сложную смесь, называемую контактной массой.
5.2.1. Описание лабораторной установки и порядок выполнения работы
Схема установки представлена на рис. 9.
Рис. 9. Схема лабораторной установки:
1 – баллон с SO2; 2 – сухой фильтр; 3 – расходомер SO2; 4 – компрессор; 5 – осушитель воздуха (склянка Тищенко с раствором серной кислоты); 6 – фильтр; 7 – расходомер воздуха; 8 – смеситель; 9 – газоанализатор; 10 – регистрирующий блок анализатора; 11 – автоматический потенциометр; 12 – контактный аппарат; 13 – трехходовой кран; 14 – дрексель с раствором йода; 15 – аспиратор; 16 – мерный цилиндр; 17 – водяной манометр; 18 – поглотительный дрексель с раствором соды
Основным элементом установки является контактный аппарат, состоящий из трубчатой электрической печи и кварцевой трубки, в которую помещен слой ванадиевого катализатора. Регулировка температуры газовой смеси на входе в слой катализатора производится с помощью автоматического потенциометра 11. Исходную газовую смесь с содержанием SO2 5–10 об. % (по заданию преподавателя) получают смешением воздуха с диоксидом серы, подаваемым из баллона 1 через фильтр 2 в смеситель 8. Воздух, подаваемый компрессором 4, последовательно проходит склянку Тищенко 5, заполненную серной кислотой (для удаления из воздуха паров воды), фильтр 6 в смеситель 8. Расход контролируют реометром 7. Газовая смесь из смесителя 8 направляется в газоанализатор 9, с помощью которого непрерывно контролируется концентрация диоксида серы, и далее поступает в контактный аппарат 12. Окисление диоксида серы происходит на ванадиевом катализаторе в фильтрующем слое. Из контактного аппарата газ выходит в атмосферу через поглотительную склянку с раствором соды. Объемную долю SO2 в газе до контактного аппарата определяют с помощью газоанализатора 9 автоматически, а после контактирования определяют йодометрическим методом. Для этого газ, выходящий из контактного аппарата, направляется в дрексель 14, заполненный раствором йода. Объем газа, прошедшего через дрексель 14, определяют с помощью аспиратора 15. Подачу газа на анализ осуществляют краном 13. Для непрерывного контроля концентрации SO2 до подачи его в контактный аппарат служит газоанализатор, состоящий из датчика с преобразователем 9 и показывающего прибора 10.
Порядок выполнения работы
Опыт начинают с разогрева контактного аппарата до заданной преподавателем температуры, предварительно установив требуемый расход воздуха, а температуру с помощью автоматического потенциометра 11.
Подачу SO2 для получения газовой смеси определенной концентрации начинают при достижении заданной температуры. Объемную долю SO2 в исходной газовой смеси, подаваемой в контактный аппарат, определяют с помощью автоматического газоанализатора. Температуру на входе в слой катализатора поддерживают в интервале 380–500С в зависимости от задания.
Основным контролируемым параметром, служащим для последующего расчета показателей процесса, является объемная доля диоксида серы в отходящем газе после контактного аппарата. К анализу содержания диоксида серы в газе после контактного аппарата приступают через 5 мин после начала работы установки (для выхода системы на установившийся режим).
После снятия показаний изменяются параметры проведения процесса (по заданию преподавателя) и опыт повторяют.
По окончании всех опытов выключают подачу SO2 и продувают установку воздухом до исчезновения белого тумана Н2SO4 на выходе из аппарата (стадия отдувки установки). После этого выключают электрообогрев и воздуходувку, закрывают все краны на подводящих и отводящих линиях.
5.2.2. Методика определения содержания SO2 в газовой смеси
Определение концентрации сернистого ангидрида основано на реакции окисления его йодом:
SO2 + I2 + 2H2O = H2SO4 + 2HI.
Для определения концентрации SO2 в газе после контактирования в дрексель 14 наливают 2 мл 0,1 н раствора йода, разбавляют его до половины водой и прибавляют 5–10 капель крахмала. Газовая смесь после контактного аппарата путем переключения трехходового крана 13 пропускается последовательно через дрексель 14 до полного обесцвечивания йода, далее направляется в аспиратор 15. Продолжительность обесцвечивания раствора йода фиксируется по секундомеру. Объем газа, прошедшего через дрексель за это время, равен объему воды, вытекшей из аспиратора 15 в мерный цилиндр 16 плюс объем сернистого газа, поглощенного 2 мл 0,1 н раствора йода (приведенного к условиям опыта). Просасывание газа через аспиратор ведут таким образом, чтобы давление в аспираторе равнялось атмосферному, что контролируется по положению уровня жидкости в U-образной трубке водяного манометра, установленного на крышке аспиратора и регулируется путем изменения скорости вытекания воды из аспиратора. При этом 1 мл 0,1 н раствора йода соответствует 0,003 203 г SO2, который при 0С и 760 мм рт. ст. занимает объем, равный 1,095 мл.
Для определения объемной доли SO2 в газе в условиях проведения анализа необходимо его объем привести к нормальным условиям.
Объем SO2, поглощенный 0,1 н раствором йода и приведенный к нормальным условиям, вычисляется по формуле
V0 = V
где V
Температура газа в аспираторе принимается равной температуре окружающего воздуха.
Объемная доля SO2 в газе, выходящем из контактного аппарата без учета объема SO3 в процентах, рассчитывается по уравнению
где Vв объем вошедшего в аспиратор газа, соответствующий объему вытекшей из аспиратора за это время воды, мл.
5.2.3. Расчет показателей процесса каталитического окисления диоксида серы
Основными показателями, которые необходимо рассчитать по результатам эксперимента, являются фактическая степень превращения XФ и удельная производительность катализатора Пк, а также фиктивное время контактирования .
Степень превращения (контактирования), выраженная в долях единицы, рассчитывают по формуле
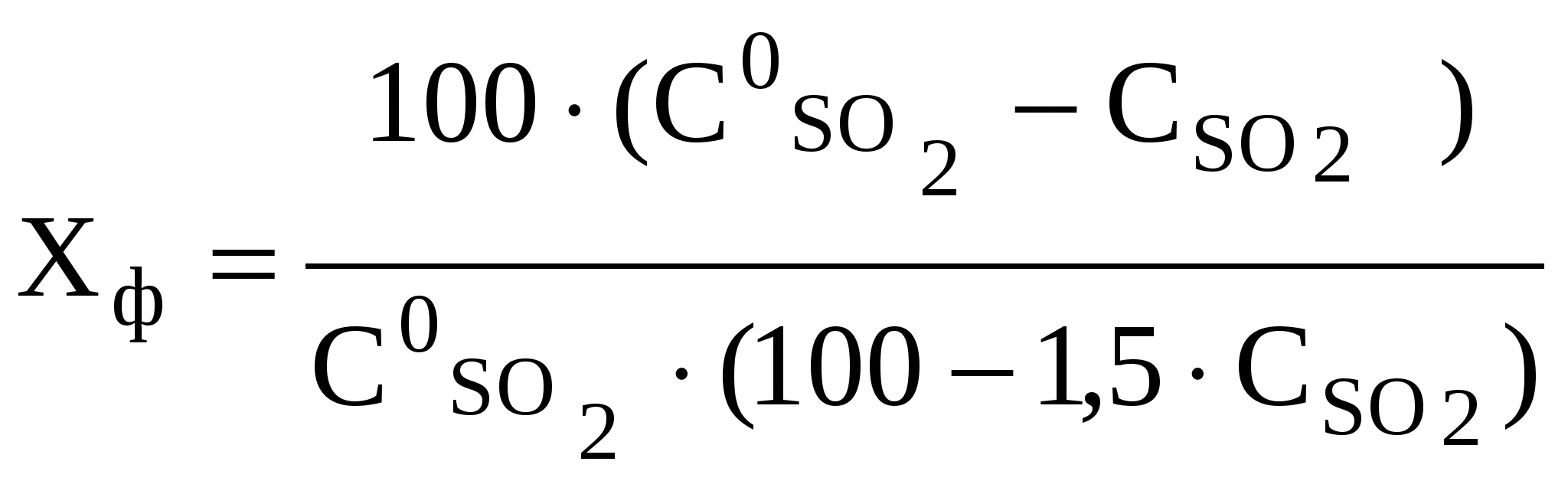 , (63)
, (63)где
Удельную производительность катализатора, кг / (м3 с), вычисляют по формуле
Пк = G
где G
Условное время контактирования определяют по формуле
= Vк / V, (65)
где Vк объем катализатора, м3; V объем газа, проходящий через катализатор в единицу времени при нормальных условиях, м3/с.
5.2.4. Задание к лабораторной работе
Изучить влияние на технологические показатели процесса окисления диоксида серы следующих параметров: расхода газовой смеси; концентрации SO2; температуры окисления.
Рассчитать равновесную степень превращения SO2 для заданных параметров с помощью программы, приведенной в прил. 2. Распечатать диаграмму Х – Т.
На полученную диаграмму нанести экспериментальные значения степени превращения для температуры на выходе из слоя катализатора. Проанализировать результаты и сделать вывод о характере влияния варьируемых входных технологических параметров на степень окисления.
Вычислить удельную производительность катализатора в контактном аппарате, а также условное время контактирования.
6. Химические реакторы
Цель работы – изучение зависимости степени и скорости превращения реагентов от условий проведения процесса в реакторе смешения периодического действия.
6.1. Общие положения
Химическим реактором называется аппарат, в котором осуществляются химические процессы, сочетающие химические реакции с массо- и теплопереносом. Химический реактор является одним из основных элементов любой химико-технологической схемы (ХТС). От правильности выбора реактора и его совершенства зависит эффективность всего технологического процесса.
Многообразие химических процессов обуславливает разнообразие химических реакторов. В соответствии с этим и классификация реакторов может быть осуществлена по разным признакам, наиболее существенными из которых являются:
характер протекания процесса во времени;
гидродинамический режим;
тепловой режим;
фазовое состояние реагентов.
По первому признаку реакторы делят на периодические, непрерывные и полунепрерывные (полупериодические); по гидродинамическому режиму (т. е. по характеру движения реакционной среды) их подразделяют на реакторы вытеснения и реакторы смешения. По тепловому режиму различают реакторы, работающие в адиабатическом, изотермическом и политропическом (политермическом) режиме. По агрегатному состоянию исходных реагентов и продуктов выделяют реакторы для проведения гомогенных, гетерогенных и гетерогенно-каталитических процессов.
В связи со сложностью моделирования работы реальных реакторов, обусловленной влиянием большого числа внешних факторов, для расчета реакторов используют их идеализированные модели. Обычно выделяют следующие типы реакторов:
а) идеального смешения периодический (РИС-П);
б) идеального смешения непрерывный (РИС-Н);
в) идеального вытеснения (РИВ);
г) каскад реакторов идеального смешения (К-РИС).
Одним из важнейших показателей, отражающих совершенство химического реактора, является его интенсивность, которая характеризуется количеством целевого продукта, получаемого в единицу времени при заданных условиях с единицы объема (площади) аппарата. Эта величина не зависит от геометрических размеров и характеристик аппарата, поэтому ее широко используют для сравнения работы однотипных аппаратов, имеющих различные размеры и производительность. Интенсивность тем выше, чем меньше времени затрачивается на получение заданного количества продукта.
Поэтому главной задачей при изучении процессов, протекающих в реакторах любого типа, является установление функциональной зависимости времени пребывания реагентов в реакторе от различных факторов:
= f [х, с, v], (66)
где х – заданная степень превращения реагента; с – начальная концентрация реагента; v – скорость химической реакции.
Уравнение, связывающее четыре названные величины, называется характеристическим уравнением реактора.
Исходным уравнением для получения характеристического уравнения реактора любого типа является материальный баланс, составленный по одному из компонентов реакционной смеси.
При проведении простой необратимой реакции
А R
уравнение материального баланса в общем виде записывается так:
GA прихода = GA расхода; (67)
GA прихода = GА х.р+ GА ст+ GА нак. (68)
Разность между количеством вещества А, поступающим в единицу времени в реактор (GА прихода) и выходящим из него (GА ст) – это количество вещества А, переносимое конвективным потоком (GА конв);
GА конв = GА прихода – GА ст, (69)
тогда
GА нак = GА конв – GА х.р. (70)
В каждом конкретном случае уравнение материального баланса принимает различную форму. Оно может составляться для единицы объема реакционной массы, либо для бесконечного малого (элементарного) объема, либо для реактора в целом. При этом можно рассчитать материальные потоки, проходящие через объем за единицу времени, а можно относить эти потоки к определенной массе одного из исходных расчетов.
В общем случае, когда состав, температура и другие параметры непостоянны во времени (нестационарный режим), материальный баланс составляют в дифференциальной форме для элементарного объема реактора. В результате получают уравнение конвективного массообмена, дополненное членом vА, учитывающим протекание химической реакции. Составленное по исходному реагенту А оно имеет вид
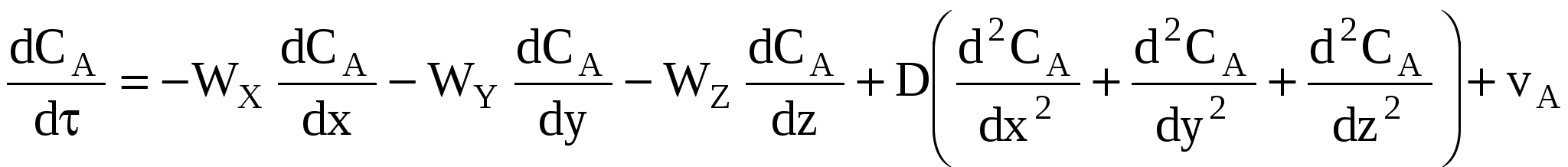 , (71)
, (71)где СА – концентрация вещества А в реакционной смеси; х, у, z – пространственные координаты; Wх, Wу, Wz – составляющие скорости потока; D – коэффициент молекулярной и конвективной диффузии; vА – скорость химической реакции.
Член в левой части уравнения (71) отражает накопление вещества А. Этому члену соответствует величина GА нак в уравнении баланса (70).
Первая группа членов правой части уравнения (71) – произведение составляющих скорости потока вдоль осей координат на градиенты концентраций – отражает изменение концентрации реагента А в элементарном объеме вследствие переноса его вместе с самой средой в направлении, совпадающем с направлением общего потока.
Вторая группа членов правой части уравнения (71) отражает изменение концентрации реагента А в элементарном объеме в результате переноса его путем диффузии.
Указанные выше две группы правой части уравнения (71) характеризуют суммарный перенос вещества в движущейся среде путем конвенции и диффузии (конвективная диффузия); в уравнении (70) им соответствует величина GА конв.
Член vА показывает изменение концентрации реагента А в элементарном объеме за счет химической реакции. Ему в уравнении (70) соответствует величина GА х.р.
В зависимости от типа реактора и режима его работы дифференциальное уравнение материального баланса упрощается и решение его значительно облегчается.
В том случае, когда параметры процесса постоянны по всему объему реактора и во времени (стационарный режим), нет необходимости составлять баланс в дифференциальной форме. Баланс составляют в конечных величинах, учитывая разность значений материальных потоков на входе в реактор и выходе из него.
6.2. Периодический реактор идеального смешения
Периодический реактор идеального смешения (РИС-П) наиболее широко используется в химической промышленности для осуществления различных химико-технологических процессов. Для него характерна единовременная загрузка реагентов в аппарат. Концентрация реагентов меняется во времени, однако благодаря интенсивному перемешиванию она одинакова во всех точках реактора в данный момент времени. Реагенты находятся в реакторе до тех пор, пока не будет достигнута заданная степень превращения, после чего аппарат разгружается, затем вновь заполняется реагентами, и цикл процесса повторяется.
В периодическом реакторе продолжительность реакции можно изменить непосредственно.
Время одного цикла определяется по уравнению
п = + всп, (72)
где п – полное время цикла; – рабочее время, затрачиваемое на проведение химической реакции; всп – вспомогательное время, затрачиваемое на загрузку реагентов и выгрузку продуктов.
Исходным уравнением для получения характеристического уравнения реактора является уравнение материального баланса (71).
В РИС-П все параметры (в том числе и концентрация реагента А) одинаковы по всему объему реактора в любой момент времени (так как реакционная смесь интенсивно перемешивается).
Производная любого порядка от концентрации реагента А по осям x, y и z равна нулю, поэтому можно записать:
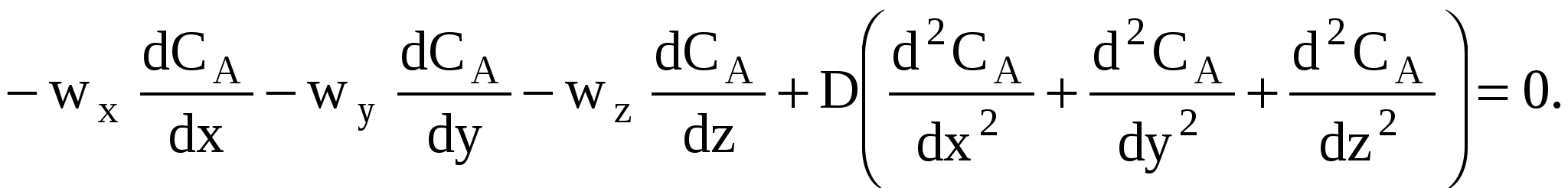 (73)
(73)Тогда уравнение (71) упрощается и может быть записано в виде следующего дифференциального уравнения:
dCA / d = vA. (74)
Текущую концентрацию реагента А можно рассчитать по формуле
где V – объём реакционной смеси; XA – степень превращения,
Поскольку начальную концентрацию реагента А можно записать (если реакция протекает без изменения объема реакционной смеси) как
то
Подставив это выражение в уравнение (74), получим
или
Знак минус перед величиной
После интегрирования полученного уравнения в пределах изменения времени от 0 до и степени превращения от 0 до x, получим характеристическое уравнение РИС-П
Рассмотрим некоторые частные случаи решения этого уравнения. Для необратимой реакции n-го порядка скорость реакции выражается уравнением
тогда для необратимой реакции нулевого порядка, когда n = 0, получим
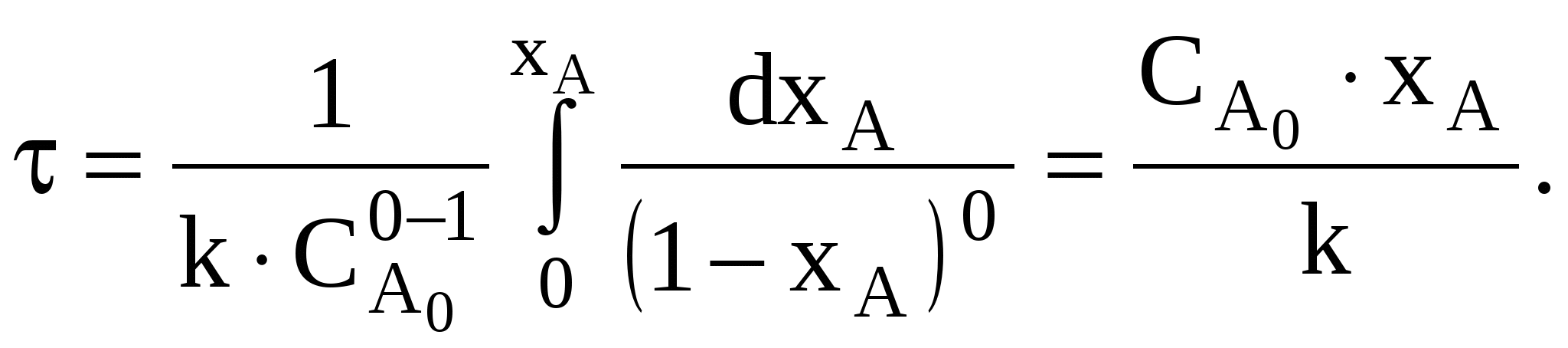 (80)
(80)Для необратимой реакции первого порядка, когда n = 1,
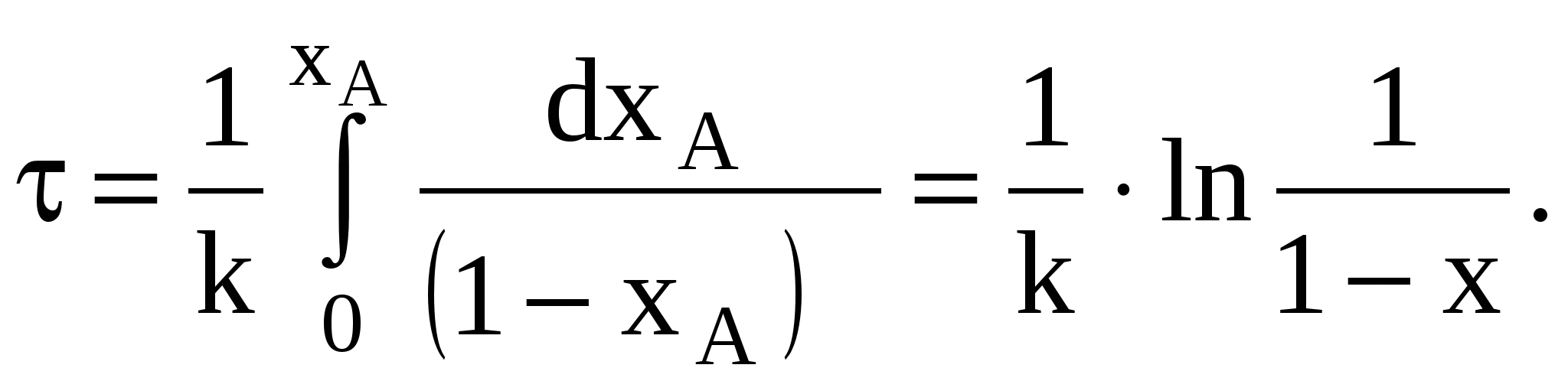 (82)
(82)Зная или задаваясь тремя величинами, входящими в характеристическое уравнение, всегда можно рассчитать четвертую.
Сведения о других типах реакторов и их характеристические уравнения приведены в табл. 11.
В настоящей работе проводится изучение кинетических характеристик работы периодического реактора смешения на примере реакции второго порядка омыления этилового эфира уксусной кислоты (или другого эфира по заданию) щелочью
СН3СООС2Н5 + NaOH CH3COONa + C2H5OH + Q.
Описание лабораторной установки и порядок выполнения работы
Лабораторная установка для моделирования работы периодического реактора смешивания представляет собой термостатируемый цилиндрический сосуд, снабженный мешалкой. Объем реактора составляет 330 мл. Реагенты 0,1 М раствор эфира и 0,1 М раствор NaOH заливаются в реактор через отверстие в крышке.
В процессе реакции концентрация NaOH снижается. Изменение ее во времени контролируется с помощью кондуктометра по изменению электропроводимости реакционной массы. С уменьшением концентрации щелочи электропроводимость раствора снижается, а следовательно, растет сопротивление. По измеренному сопротивлению по таблице (или по калибровочному графику) определяется концентрация щелочи в различные моменты времени. На основании полученных данных производится расчет основных характеристик работы реактора.

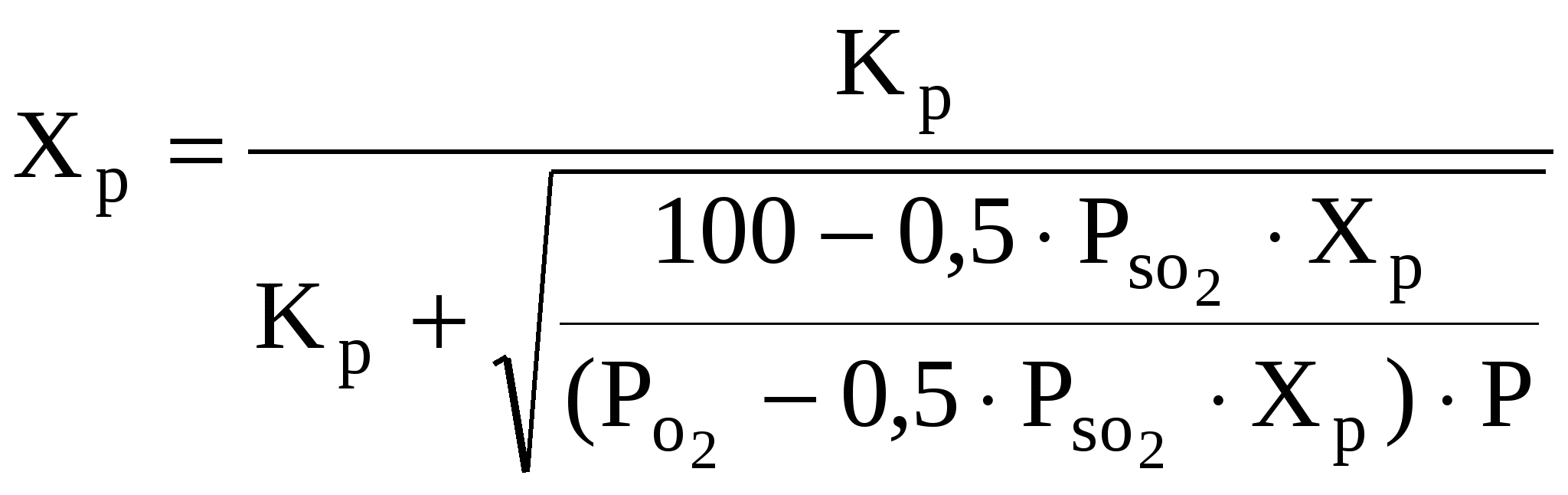 , (59)
, (59)