Практикум по бх. Практикум по биологической химии Для студентов лечебного и педиатрического
 Скачать 5.3 Mb. Скачать 5.3 Mb.
|
Тема 8.2. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| | Опыт 1, мл | Опыт 2, мл | Стандарт, мл |
| Сыворотка крови | 0,02 | –– | –– |
| Моча | –– | 0,02 | –– |
| Стандартный раствор глюкозы | –– | –– | 0,02 |
| Рабочий реагент | 2,0 | 2,0 | 2,0 |
| | Инкубируют в течение 25 минут при 37°С. Измеряют оптическую плотность против воды при длине волны 540 нм (зеленый светофильтр) | ||
Расчет
Концентрация глюкозы, ммоль/л =
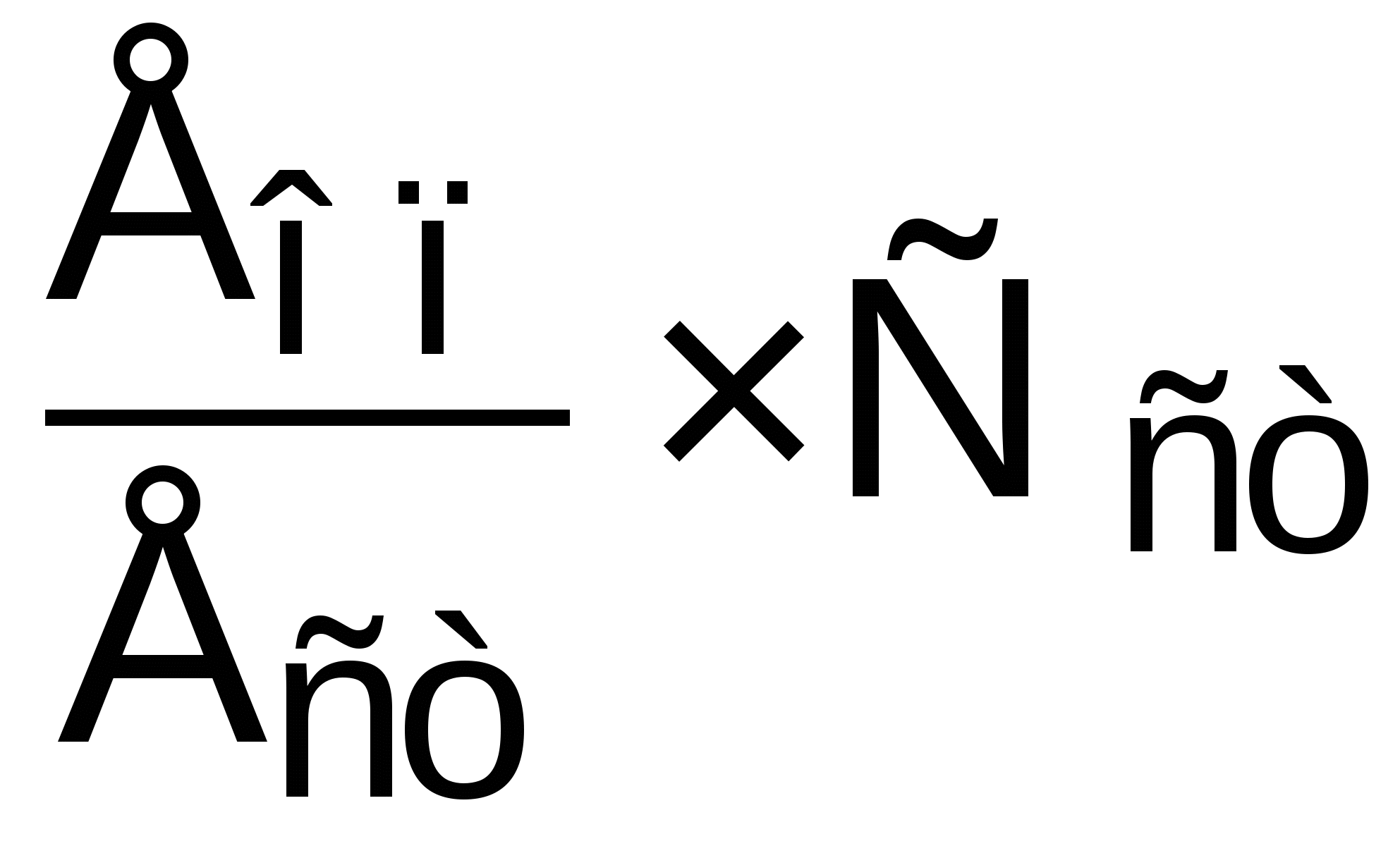 , где
, гдеЕоп и Ест – оптическая плотность опытных и стандартной проб,
Сст – концентрация стандартного раствора
Нормальные величины
| Сыворотка крови | взрослые | 3,3-5,8 ммоль/л | |
| Моча | | 0,06 0,83 ммоль/л | |
Клинико-диагностическое значение
Сыворотка крови
Увеличение содержания глюкозы в крови наблюдается как при физиологических, так и при патологических состояниях.
Физиологические гипергликемии
К физиологическим гипергликемиям относится алиментарная, возникающая при одномоментном приеме больших количеств легкоусвояемых углеводов – моно- и дисахаридов, и нейрогенная, например, при стрессовых ситуациях в результате выброса в кровь больших количеств катехоламинов. Физиологические гипергликемии носят транзиторный характер и быстро проходят.
Патологические гипергликемии
Патологические гипергликемии, как правило, обусловлены нейроэндокринными расстройствами:
сахарный диабет, связанный с абсолютной или относительной инсулиновой недостаточностью,
заболевания гипофиза, сопровождающиеся повышенной секрецией в кровь соматотропина и кортикотропина (акромегалия, болезнь Иценко-Кушинга, опухоли гипофиза и др.),
опухоли мозгового слоя надпочечников, когда усилено образование катехоламинов (феохромоцитома),
опухоли коркового слоя надпочечников с усиленной продукцией глюкокортикоидов,
гиперфункция щитовидной железы, некоторые болезни печени (инфекционный гепатит, цирроз печени).
Снижение концентрации глюкозы в крови также может быть физиологическое и патологическое.
Физиологические гипогликемии
К физиологической гипогликемии относят избыточную секрецию в кровь инсулина в ответ на алиментарную гипергликемию; гипогликемию после тяжелой и длительной мышечной работы, при полном или частичном голодании. Гипогликемия может возникать у женщин в период лактации в результате усиленного поглощения глюкозы молочной железой. У новорожденных часто наблюдается гипогликемия, обусловленная резким прекращением поступления "материнской" глюкозы, незрелостью структуры печени и повышенной чувствительностью клеток к инсулину.
Патологические гипогликемии
Наблюдаются при гиперинсулинизме при гиперплазии клеток островков Лангерганса (инсулинома, аденома и рак поджелудочной железы). Самая распространенная причина гипогликемий – передозировка инсулина. Кроме того гипогликемию вызывает недостаток гормона кортизола при гипофункции коры надпочечников (Аддисонова болезнь, опухоли надпочечников), гипофункции передней доли гипофиза (болезнь Симмондса), гипофункции щитовидной железы. Гипогликемия может возникать при токсических поражениях печени, гликогенозах, при заболеваниях почек вследствие глюкозурии.
Моча
См. ниже.
Оформление работы
Указывают принцип метода, ход работы, нормальные величины и результаты исследования, отмечают клинико-диагностическое значение показателя и делают выводы о возможной патологии.
Лабораторная работа 2
Полуколичественное определение концентрации глюкозы
в моче по Альтгаузену
Реактивы
1) 0,5%, 1%, 2%, 3% р-ры глюкозы, 2) 10% р-р NaOH.
Принцип
Глюкоза при кипячении в щелочной среде превращается в окрашенные продукты окисления (от желтого до темно-коричневого цвета). Интенсивность окраски прямо пропорциональна содержанию глюкозы.
Материал исследования
Моча нормальная и моча с глюкозой.
Проведение анализа
| | Контроль, мл | Опыт 1, мл | Опыт 2, мл |
| Дистил. вода Моча нормальная Моча с глюкозой 10% р-р NaOH | 4,0 –– –– 1,0 | –– 4,0 –– 1,0 | –– –– 4,0 1,0 |
| | Помещают в кипящую водяную баню одновременно с калибровочными пробами (см. ниже) и прогревают до появления желтого или бурого окрашивания | ||
Получение калибровочных проб
| | Проба 1, мл | Проба 2, мл | Проба 3, мл | Проба 4, мл |
| 0,5% р-р глюкозы 1% р-р глюкозы 2% р-р глюкозы 3% р-р глюкозы 10% р-р NaOH | 4,0 –– –– –– 1,0 | –– 4,0 –– –– 1,0 | –– –– 4,0 –– 1,0 | –– –– –– 4,0 1,0 |
| | Прогревают все пробы (одновременно с опытными пробами) на кипящей водяной бане до появления интенсивного бурого окрашивания в пробе 4 | |||
Сравнивают окраску опытных пробирок и окраску калибровочных пробирок. Визуально определяют содержание глюкозы в моче (в %) по наиболее совпадающему цвету растворов.
Нормальные величины
Моча до 0,5%
Клинико-диагностическое значение
Моча
При нормогликемии глюкозурия может выявляться при повреждениях почечных канальцев – пиело- и гломерулонефриты, токсические поражения, почечный диабет (семейная почечная глюкозурия), нефропатии.
Однако чаще глюкозурия сопровождает гипергликемию, когда содержание глюкозы в крови превышает величину почечного порога (9,0-10,0 ммоль/л).
Глюкозурии могут быть физиологическими и патологическими.
Физиологические глюкозурии
К физиологическим относятся алиментарная глюкозурия, глюкозурия беременных и нейрогенная глюкозурия стрессовых состояний.
Патологические глюкозурии
Возникают чаще всего в результате нарушений обмена углеводов при патологических изменениях в поджелудочной железе (острый панкреатит, сахарный диабет), надпочечниках ("бронзовый" или стероидный диабет), также при тиреотоксикозе, акромегалии, инфаркте миокарда, кровоизлияниях во внутренние органы, отравлениях морфином, фосфором, при острых инфекциях и нервных заболеваниях.
Оформление работы
Указывают принцип метода, ход работы, нормальные величины и результаты исследования, отмечают клинико-диагностическое значение показателя и делают выводы о возможной патологии.
Лабораторная работа 3
Обнаружение молочной кислоты в мышечной ткани
с помощью реакции Уффельмана
Принцип
Метод основан на взаимодействии комплексного соединения фенолята железа фиолетового цвета с молочной кислотой с образованием лактата железа желто-зеленого цвета.
Материал исследования
Мышечная ткань.
Реактивы
1) Фосфатный буфер, рН 7,2; 2) 1% р-р фенола; 3) 1% р-р FeCl3.
Проведение анализа
1. Приготовление экстракта мышечной ткани.
Кусочек мышечной ткани тщательно растирают в ступке с 5,0 мл фосфатного буферного раствора, перемешивают. Полученную мышечную кашицу фильтруют через 2 слоя марли или центрифугируют при 1500 об/мин.
2. Цветная реакция на молочную кислоту.
В пробирке к 10 каплям 1% раствора фенола добавляют 1% раствор FeCl3 до появления фиолетовой окраски. Затем к содержимому пробирки добавляют 3 капли экстракта мышц и наблюдают за изменением окраски. В присутствии молочной кислоты фиолетовая окраска раствора переходит в желто-зеленую вследствие образования лактата железа.
Практическое значение
Молочная кислота является конечным продуктом катаболизма глюкозы в анаэробных условиях, небольшое количество лактата в мышце образуется и при аэробных условиях. Наработка лактата активируется при мышечной нагрузке как физиологического (физическая работа), так и патологического характера (нарушение кровообращения и гипоксия мышцы, приступ эпилепсии, столбняк, тетания).
При гипоксических состояниях, связанных с сердечной и легочной недостаточностью, при анемиях и нарушениях реологии крови производство молочной кислоты активируется в большинстве тканей.
Оформление работы
Указывают принцип метода, ход работы и результаты исследования, отмечают практическое значение показателя и делают выводы о возможной патологии.
