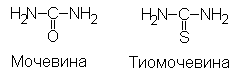|
|
Практикум по бх. Практикум по биологической химии Для студентов лечебного и педиатрического
Тема 3.1.
Строение и свойства ферментов.
Регуляция активности ферментов Актуальность
Ферменты – белковые молекулы, выполняющие в живой клетке функции биокатализаторов. Значительное количество лекарственных средств влияет на активность ферментов организма и знание роли тех или иных ферментов позволяет грамотно использовать медицинские препараты.
Ряд патологических состояний связан с изменением активности ферментов, что приводит к нарушению деятельности органов и организма в целом (например, наследственные энзимопатии).
Изучение строения и функционирования ферментов необходимо для понимания обмена веществ и его регуляции, а также патогенеза заболеваний, связанных с нарушением работы ферментов.
Цель
Знакомство со строением и свойствами ферментов, особенностями ферментативного катализа.
Изучение влияния некоторых факторов на активность ферментов in vitro. Изучение регуляции активности ферментов в клетке.
Приобретение практических навыков по исследованию специфичности ферментов, по изучению влияния на активность ферментов температуры, активаторов и инактиваторов.
Вопросы для самоподготовки
Строение простых и сложных белков.
Коферментные формы витаминов В1 (ТДФ), В2 (ФМН и ФАД), РР (НАД+ и НАДФ+), В6 (ПФ).
Биологическая роль ферментов. Понятие энергетического барьера реакции и энергии активации.
Этапы ферментативного катализа.
Характеристика структурно-функциональной организации ферментов по плану:
простые ферменты;
сложные ферменты: понятие холофермента, апофермента, кофактора, кофермента, простетической группы;
активный центр (контактный и каталитический участки);
аллостерический центр.
Кислотно-основной и ковалентный механизмы катализа.
Сходство и различие в действии ферментов и неорганических катализаторов.
Общие принципы количественного определения активности ферментов. Единицы активности ферментов.
Мультиферментный комплекс, строение, принципы самосборки, роль. Примеры.
Изоферменты, особенности их строения на примере лактатдегидрогеназы и креатинкиназы.
Основные свойства ферментов. Графики зависимости скорости ферментативной реакции:
от температуры;
от pH среды;
от концентрации субстрата;
от концентрации фермента.
Специфичность, виды специфичности. Механизмы специфичности – теория Фишера и теория Кошланда.
Способы регуляции скорости ферментативных реакций в клетке (invivo):
компартментализация;
изменение количества фермента – на примере влияния глюкокортикоидов на глюконеогенез;
изменение доступности субстрата на примере оксалоацетата и цикла трикарбоновых кислот;
проферменты и их ограниченный протеолиз на примере ферментов желудочно-кишечного тракта;
белок-белковое взаимодействие на примере активации аденилатциклазы (присоединение регуляторных белков) и на примере протеинкиназы А (диссоциация белка на протомеры). Схемы процессов;
аллостерические механизмы регуляции ферментов: а) схема изменения активности фермента при воздействии эффектора, б) роль аллостерической регуляции метаболизма на примере фосфофруктокиназы;
ковалентная модификация ферментов на примере ферментов гликогенсинтазы и гликогенфосфорилазы. Схема механизма регуляции.
Характеристика ингибирования ферментов. Конкурентное и неконкурентное ингибирование. Обратимое и необратимое ингибирование. Примеры.
Исследование восстановления пероксида водорода ферментом каталазой. Принцип метода.
Исследование специфичности действия ферментов на примере амилазы и уреазы. Принцип метода.
Влияние активаторов и инактиваторов ферментов на скорость реакции на примере амилазы. Принцип метода.
Зависимость скорости ферментативной реакции от температуры на примере амилазы слюны и дегидрогеназ дрожжей. Принцип методов.
ТЕМЫ ДЛЯ РЕФЕРАТИВНЫХ СООБЩЕНИЙ
Роль эссенциальных микроэлементов в функционировании и регуляции активности ферментов.
Лабораторная работа 1 Оценка скорости реакции спонтанного и ферментативного
восстановления пероксида водорода Реактивы
3% р-р H2O2.
Материал исследования
Свежая кровь животных – источник фермента каталазы.
Принцип
Каталаза (КФ 1.11.1.6.) ускоряет реакцию восстановления пероксида водорода:
2H2O2 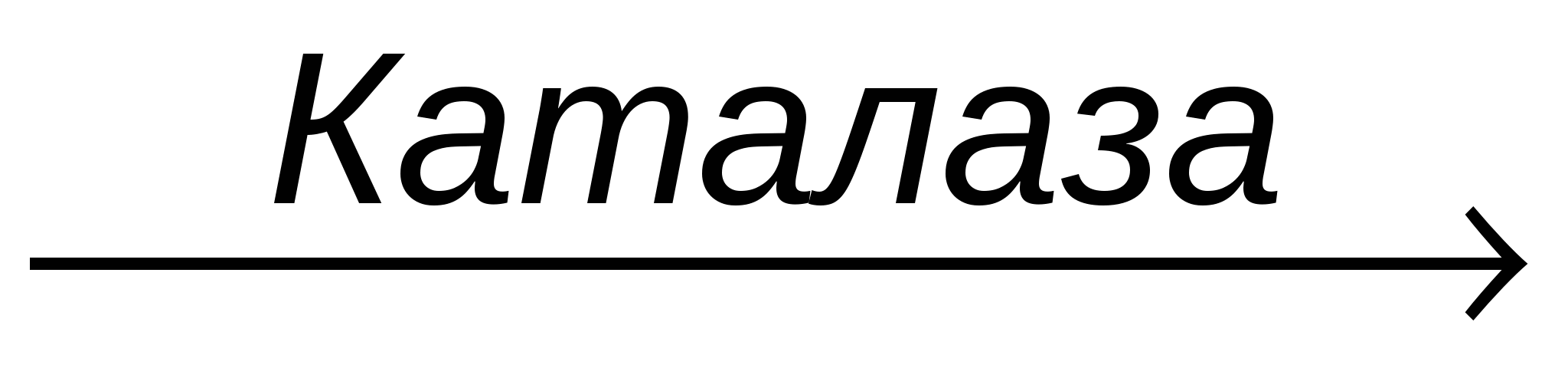 2Н2О + О2 2Н2О + О2
В этой реакции одна молекула пероксида водорода окисляется и служит донором электронов, а другая восстанавливается и является акцептором электронов. Образуемый кислород выделяется в виде пузырьков.
Проведение анализа
В 2 пробирки вносят по 10 капель пероксида водорода. В одну из пробирок добавляют 1 каплю крови. Активность фермента выявляется по появлению пузырьков кислорода.
Оформление работы
Отмечают принцип метода, ход работы, сравнивают полученные результаты и объясняют их.
Лабораторная работа 2 Зависимость скорости ферментативной реакции
от температуры
Исследование влияния температуры на
активность амилазы слюны
Реактивы
1) 1% р-р крахмала, 2) р-р Люголя.
Материал исследования
Слюна, разведенная 1:10 (источник амилазы).
Принцип
Для исследования зависимости скорости ферментативной реакции от температуры в работе используется гидролиз крахмала амилазой (диастаза, 1,4 D глюкангидролаза, КФ 3.2.1.1.) слюны. При инкубации смеси субстрата (крахмал) и фермента (амилаза слюны) в разных температурных условиях фермент будет гидролизовать неодинаковое количество субстрата.
Гидролиз крахмала под действием амилазы проходит через стадии образования декстринов до дисахарида мальтозы.
Крахмал + Н2О 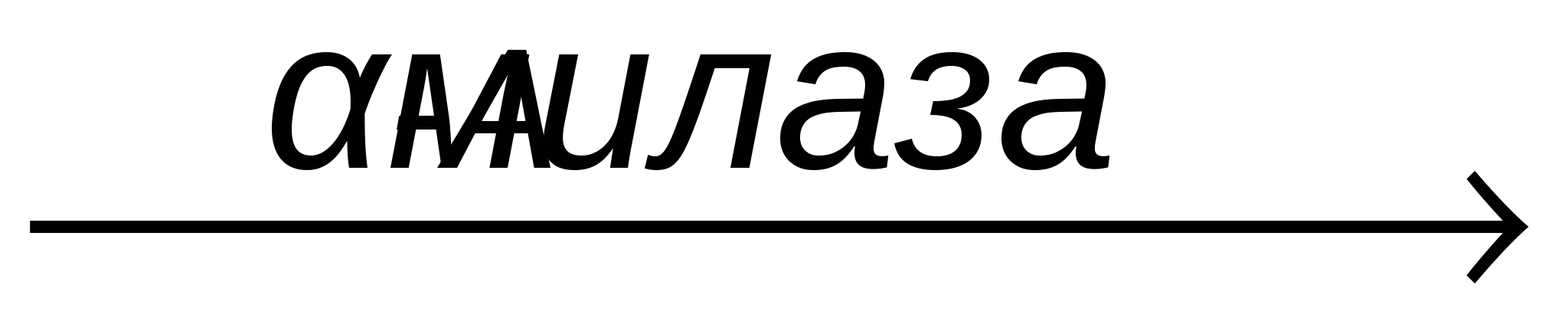 Мальтоза + Декстрины Мальтоза + Декстрины
Количество расщепленного крахмала оценивают по цветной реакции с йодом. Нерасщепленный крахмал с йодом дает синее окрашивание. Продукты гидролиза крахмала (декстрины) в зависимости от размера молекул дают с йодом окрашивание: ● амилодекстрины – фиолетовое, ● эритродекстрины – красно-бурое, ● ахродекстрины и мальтоза – цветная реакция отсутствует, желтый цвет соответствует цвету водного раствора йода.
Проведение реакции.
Приготовление препарата слюны (выполняет дежурный для всей группы).
Собирают 1 мл слюны в мерную пробирку и доводят дистиллированной водой до метки 10 мл, хорошо перемешивают (не встряхивая!).
Чтобы исключить ферментативную реакцию до достижения необходимой температуры, растворы слюны и крахмала сначала прогревают по отдельности.
1. В 4 пробирки (1, 2, 3, 4) вносят по 10 капель крахмала. Флакон с раствором крахмала предварительно взболтать! В следующие 4 пробирки (5, 6, 7, 8) вносят по 10 капель разведенной слюны (раствор амилазы). Пробирки делят по парам – 1-5, 2-6, 3 7, 4 8.
2. 1-ю пару пробирок помещают в баню со льдом (0°С). 2-ю пару оставляют при комнатной температуре (20°С). 3-ю пару выдерживают при температуре 38-40°С. 4-ю пару пробирок помещают в кипящую водяную баню (100°С).
3. Через 3 минуты содержимое каждой пары пробирок объединяют, перемешивают и немедленно помещают на 10 минут в те же условия.
4. Проверяют ход реакции. Для этого из 3-й пробирки (38-40°С) отбирают на предметное стекло 3 капли смеси и добавляют 1 каплю реактива Люголя:
если окраска синяя, то это указывает на низкую скорость гидролиза крахмала. В этом случае необходимо продлить время инкубации.
появление красного или желтого окрашивания указывает на завершение гидролиза крахмала амилазой (можно переходить к п.6).
6. По завершении гидролиза крахмала в 3-й пробе во все пробирки одновременно добавляют по 2 капли реактива Люголя и сравнивают цвет раствора в пробах.
Оформление работы
Отмечают принцип метода, ход работы. Результаты работы оформляют в виде таблицы. В выводах отмечают оптимальную температуру действия фермента.
N
пробы
|
Температура
инкубации
|
Окраска
|
Относительная скорость реакции
|
1
2
3
4
|
0°С
20°С
38°С
100°С
|
|
|
Исследование влияния температуры на
активность дегидрогеназ дрожжей
Реактивы
1) 10% р-р глюкозы, 2) 0,01% р-р метиленового синего.
Материал исследования
Суспензия пекарских дрожжей.
Принцип
При окислении глюкозы анаэробные дегидрогеназы дрожжей катализируют реакции переноса атомов водорода от продуктов окисления на промежуточный акцептор (восстановление акцептора). Обнаружение активности дегидрогеназ проводится по изменению окраски добавленного к суспензии дрожжей метиленового синего (акцептора), который при восстановлении обесцвечивается.
Проведение анализа
|
Опыт 1,
капли
|
Опыт 2,
капли
|
Суспензия дрожжей
|
10
|
10
|
|
Выдерживают при 100°С в течение 10 минут
|
––
|
10% р-р глюкозы
|
10
|
10
|
0,01% р-р метиленового синего
|
1
|
1
|
|
Пробирки закрывают пробками и помещают на
10 минут в водяную баню при 38С.
Наблюдают за изменением окраски в пробирках.
| Оформление работы
Отмечают принцип метода и ход работы. Результаты работы оформляют в виде таблицы. В выводах отмечают причину изменения скорости реакции.
Пробы__Окраска__Относительная_скорость_реакции'>Пробы
|
Окраска
|
Относительная
скорость реакции
|
Опыт 1
Опыт 2
|
|
| Лабораторная работа 3 Исследование специфичности действия ферментов Реактивы
1) 1% р-р мочевины, 2) 1% р-р тиомочевины, 3) 0,5% спиртовый р-р фенолфталеина, 4) 1% р-р крахмала, 5) 1% р-р сахарозы, 6) реактивы Фелинга: Фелинг I и Фелинг II.
Материал исследования
Приготовленный из семечек арбуза препарат уреазы.
Слюна, разведение 1:10 (источник амилазы).
Обнаружение абсолютной специфичности действия
фермента уреазы
Принцип
Метод основан на сравнении возможности гидролиза уреазой (КФ 3.5.1.5.), сходных по строению субстратов – мочевины и тиомочевины.
Действие фермента обнаруживается по изменению окраски индикатора фенолфталеина в щелочной среде, которая создается при выделении аммиака при гидролизе мочевины ферментом уреазой.
Мочевина + Н2О  2NH3 + CO2 2NH3 + CO2
Проведение реакции
Приготовление препарата уреазы:
Очистить 3-4 семечка арбуза, зерна растереть в ступке в 1 мл дистиллированной воды, затем довести объем до 10 мл. Полученную эмульсию фильтруют и используют как препарат фермента уреазы.
|
Опыт 1,
капли
|
Опыт 2,
капли
|
1% р-р мочевины
1 % р-р тиомочевины
Препарат уреазы
Р-р фенолфталеина
|
10
––
10
1-2
|
––
10
10
1-2
|
|
Перемешивают. Выдерживают 3-5 минут.
Наблюдают за появлением розовой окраски в одной из пробирок.
| Оформление работы
Отмечают принцип метода и ход работы. Результаты работы оформляют в виде таблицы. В выводах отмечают причину отсутствия окраски в одной из проб и специфичность фермента.
Пробы
|
Субстрат
реакции
|
Окраска
|
Наличие
реакции
|
Опыт 1
Опыт 2
|
|
|
|
Обнаружение специфичности действия
амилазы слюны
Принцип
Метод основан на сравнительном изучении способности фермента амилазы (КФ 3.2.1.1.) гидролизовать разные углеводные субстраты – полисахарид крахмал и дисахарид сахарозу.
Субстрат + Н2О 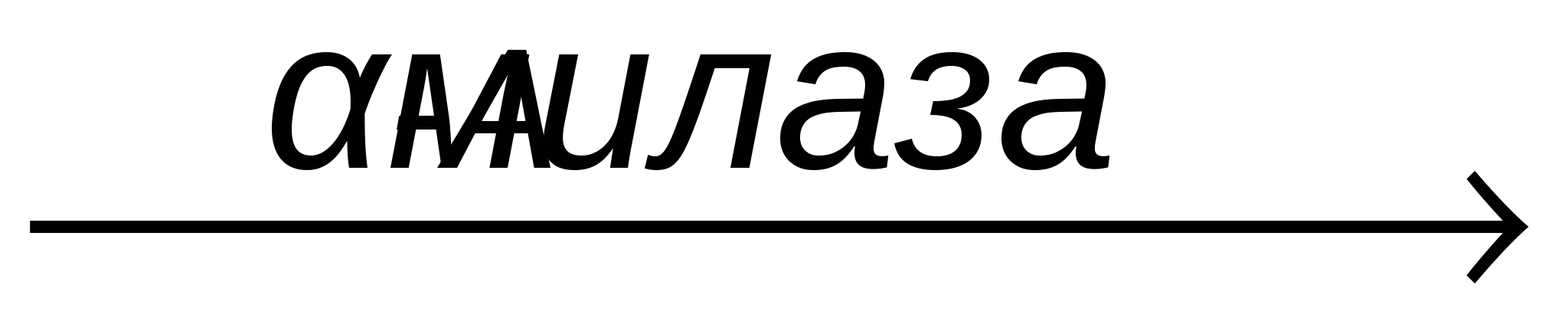 Продукт (мальтоза, декстрины) Продукт (мальтоза, декстрины)
Действие фермента на субстрат выявляют при помощи качественной реакции на свободную альдегидную группу углеводов (реакция Троммера).
Реакция Троммера может быть положительной (красно-оранжевая окраска) только в случае расщепления субстратов до восстанавливающих сахаров (мальтоза, глюкоза и другие), которые имеют свободную альдегидную группу и обладают восстанавливающими свойствами. Субстраты реакции (крахмал и сахароза) не имеют свободной альдегидной группы, поэтому не дают положительной реакции Троммера.
Проведение реакции
Приготовление раствора слюны (выполняет дежурный для всей группы).
Собирают 1 мл слюны в мерную пробирку и доводят дистиллированной водой до метки 10 мл, хорошо перемешивают.
|
Опыт 1,
капли
|
Опыт 2,
капли
|
1% р-р крахмала
1 % р-р сахарозы
Р-р слюны
|
––
10
5
|
10
––
5
|
|
Перемешивают.
Инкубируют при температуре 37°С в течение 10 минут
|
Реактив Феллинга I
Реактив Феллинга II
|
3
3
|
3
3
|
|
Перемешивают.
Выдерживают в кипящей водяной бане при температуре 100°С до появления желтого или красно-оранжевого окрашивания в одной из пробирок
| Оформление работы
Отмечают принцип метода и ход работы. Результаты работы оформляют в виде таблицы. В выводах отмечают причину отсутствия реакции в одной из проб и специфичность фермента.
Пробы
|
Субстрат
реакции
|
Окраска
|
Наличие
реакции
|
Опыт 1
Опыт 2
|
|
|
| Лабораторная работа 4 Влияние активаторов и инактиваторов
на активность амилазы Принцип
Метод основан на сравнении скорости гидролиза крахмала под действием амилазы (диастаза, 1,4 D глюкангидролаза, КФ 3.2.1.1.) слюны без добавления каких-либо веществ и после добавления ионов Cl– и Cu2+. Активность фермента выявляется по степени гидролиза крахмала при помощи цветной реакции с йодом.
Нерасщепленный крахмал с йодом дает синее окрашивание. Гидролиз крахмала под действием амилазы проходит через стадии образования декстринов до дисахарида мальтозы.
Крахмал + Н2О 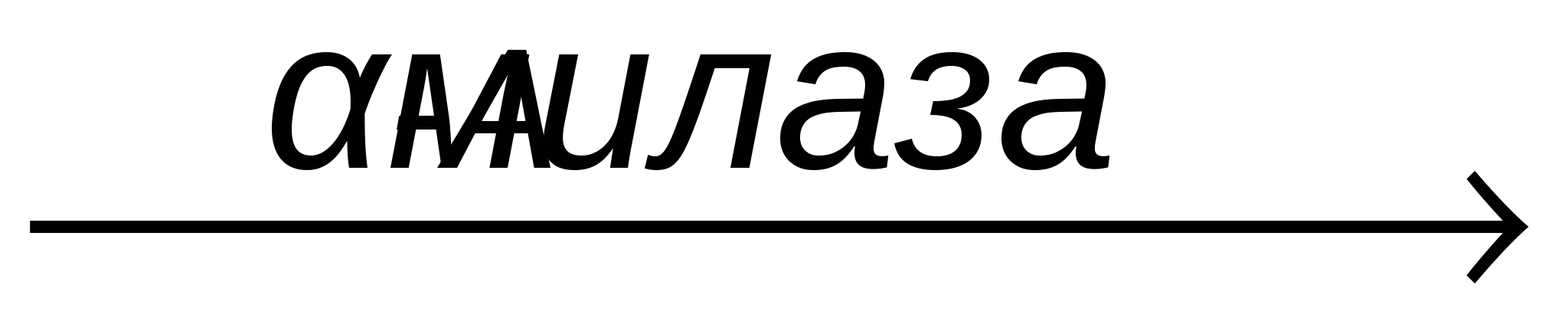 Мальтоза + Декстрины Мальтоза + Декстрины
Декстрины в зависимости от размера молекул дают с йодом окрашивание: ● амилодекстрины – фиолетовое, ● эритродекстрины – красно-бурое, ● ахродекстрины и мальтоза – цветная реакция отсутствует, желтый цвет соответствует цвету водного раствора йода.
Реактивы
1) 1% р-р CuSО4, 2) р-р Люголя, 3) 0,9% р-р NaCl.
Материал исследования
Слюна, разведенная 1:10 (источник амилазы).
Проведение реакции
Приготовление препарата слюны (выполняет дежурный для всей группы).
Собирают 1 мл слюны в мерную пробирку и доводят дистиллированной водой до метки 10 мл, хорошо перемешивают.
Чтобы исключить протекание ферментативной реакции без влияющих факторов, их необходимо вносить в пробирки в первую очередь.
|
Опыт 1,
капли
|
Опыт 2,
капли
|
Контроль,
капли
|
Дистиллир. вода
0,9% раствор NaCl
1% раствор CuSО4
Препарат слюны
1% раствор крахмала
|
––
10
––
10
10
|
––
––
10
10
10
|
10
––
––
10
10
|
|
Перемешивают.
Инкубируют при температуре 37°С в течение 10 мин
|
Проверка хода гидролиза крахмала:
По истечении рекомендуемого времени инкубации готовят 3 дополнительные пробирки с водой по 1 мл в каждой, добавляют 1 2 капли реактива Люголя и прибавляют по 5 капель содержимого опытных пробирок. Сравнивают окраску раствора в дополнительных пробирках:
если существенной разницы в окраске нет, то инкубацию опытных проб продлевают на 5 15 минут, после этого вновь проверяют ход гидролиза крахмала,
если имеются видимые отличия в окраске, то работа закончена.
После окончания работы сравнивают интенсивность окраски раствора в пробах, отмечают, как изменилась скорость реакции при воздействии веществ. Проба с добавлением воды является контрольной.
Оформление работы
Отмечают принцип метода и ход работы. Результаты работы оформляют в виде таблицы. В выводах сравнивают скорость реакции в пробах и отмечают причину различий.
Пробы
|
Влияющий фактор
|
Окраска
|
Относительная скорость
реакции
|
Опыт 1
Опыт 2
Контроль
|
|
|
| |
|
|
 Скачать 5.3 Mb.
Скачать 5.3 Mb.