|
|
Практикум по бх. Практикум по биологической химии Для студентов лечебного и педиатрического
Актуальность
Белки выполняют ряд уникальных функций, свойственных живой материи, поддерживая в значительной мере динамичное состояние между организмом и внешней средой. Свыше 20 природных аминокислот, часть из которых являются незаменимыми, включаются в общие и специфические пути превращения, что объясняет разнообразие и разветвленность метаболизма аминокислот.
В медицине описаны многочисленные случаи нарушения этапов обмена аминокислот.
Цель
Изучить главные пути превращений аминокислот и транспортную систему их проникновения через клеточные мембраны.
Изучить основные реакции внутриклеточного обмена аминокислот (дезаминирование, трансаминирование, декарбоксилирование).
Научиться определять активность аминотрансфераз в сыворотке крови.
Вопросы для самоподготовки
Транспорт аминокислот через клеточные мембраны.
Источники и пути превращений аминокислот в тканях. В чем особенность метаболизма глюкогенных и кетогенных аминокислот?
Виды дезаминирования аминокислот (восстановительное, гидролитическое, внутримолекулярное, окислительное).
Окислительное дезаминирование. Отличие прямого и непрямого окислительного дезаминирования.
Реакция прямого окислительного дезаминирования глутаминовой кислоты.
Непрямое окислительное дезаминирование – трансдезаминирование.
Механизм реакций трансаминирования. Роль витамина В6. Строение витамина В6 и его коферментных форм.
Значение реакций трансаминирования. Характеристика аспартатаминотрансферазы (АсАТ) и аланинаминотрансферазы (АлАТ). Реакции, катализируемые этими ферментами.
Особенности непрямого дезаминирования в мышечной ткани – цикл ИМФ-АМФ.
Судьба -кетокислот, образовавшихся в процессах дезаминирования, на примере пирувата, оксалоацетата, кетоглутарата.
Реакции синтеза биогенных аминов (на примере аминомасляной кислоты, гистамина, серотонина, дофамина). Роль этих биогенных аминов.
Способы обезвреживания биогенных аминов. Реакции дезаминирования с участием моноаминооксидазы (МАО) и реакции метилирования.
Анаболическая роль аминокислот на примере креатина. Строение креатина и креатинфосфата, реакции их синтеза, локализация процесса. Биологическая роль креатинфосфата. В чем причина физиологической креатинурии у детей?
Определение активности АсАТ и АлАТ в сыворотке крови. Принцип метода, его клинико-диагностическое значение. Нормальные показатели.
ТЕМЫ ДЛЯ РЕФЕРАТИВНЫХ СООБЩЕНИЙ
Анаболические процессы, в которых принимают участие аминокислоты. Использование аминокислот в медицинской практике.
Аминоацидурии, виды, этиология и патогенез, клинические проявления, основы лечения.
Лабораторная работа 1 Определение активности аминотрансфераз
сыворотки крови Принцип
В результате реакций трансаминирования, происходящих под действием аспартатаминотрансферазы (АсАТ, L аспартат:2 оксоглутарат аминотрансфераза, КФ 2.6.1.1.) и аланинаминотрансферазы (АлАТ, L аланин:2 оксоглутарат аминотранфераза, КФ 2.6.1.2.), из аспарагиновой кислоты и аланина образуются, соответственно, оксалоацетат и пируват. Оксалоацетат, подвергаясь самопроизвольному декарбоксилированию, превращается в пируват. При добавлении кислого 2,4 динитрофенилгидразина ферментативная реакция останавливается и образуется гидразон пировиноградной кислоты. Последний в щелочной среде дает бурое окрашивание, интенсивность которого пропорциональна количеству образовавшейся пировиноградной кислоты.
Реактивы
1) Р-р субстрата АсАТ: смесь кетоглутаровой кислоты и аспарагиновой кислоты, 2) р-р субстрата АлАТ: смесь кетоглутаровой кислоты и аланина, 3) р-р 2,4 динитрофенилгидразина в 1,0 М HCl, 4) 0,4 М р-р NaOH.
Стандартный р-р пировиноградной кислоты, 0,1 ммоль/л.
Материал исследования
Сыворотка крови.
Проведение анализа
|
Проба 1,
стандартная,
мл
|
Проба 2,
опытная для АлАТ, мл
|
Проба 3,
опытная для АсАТ, мл
|
Субстратный р р АлАТ
|
0,25
|
0,25
|
––
|
Субстратный р р АсАТ
|
––
|
––
|
0,25
|
Стандартный раствор пировиноградной кислоты
|
0,05
|
––
|
––
|
Сыворотка крови
|
––
|
0,05
|
0,05
|
|
Инкубируют 30 минут при 37°С
|
2,4 ДНФГ
|
0,25
|
0,25
|
0,25
|
|
Инкубируют при комнатной температуре
в течение 20 минут
|
NaOH
|
2,5
|
2,5
|
2,5
|
|
Инкубируют при комнатной температуре в течение
10 минут.
Колориметрируют опытные и стандартную пробы против воды при 540 нм (зеленый светофильтр)
| Расчет
Активность АлАТ, ммоль/л·ч = 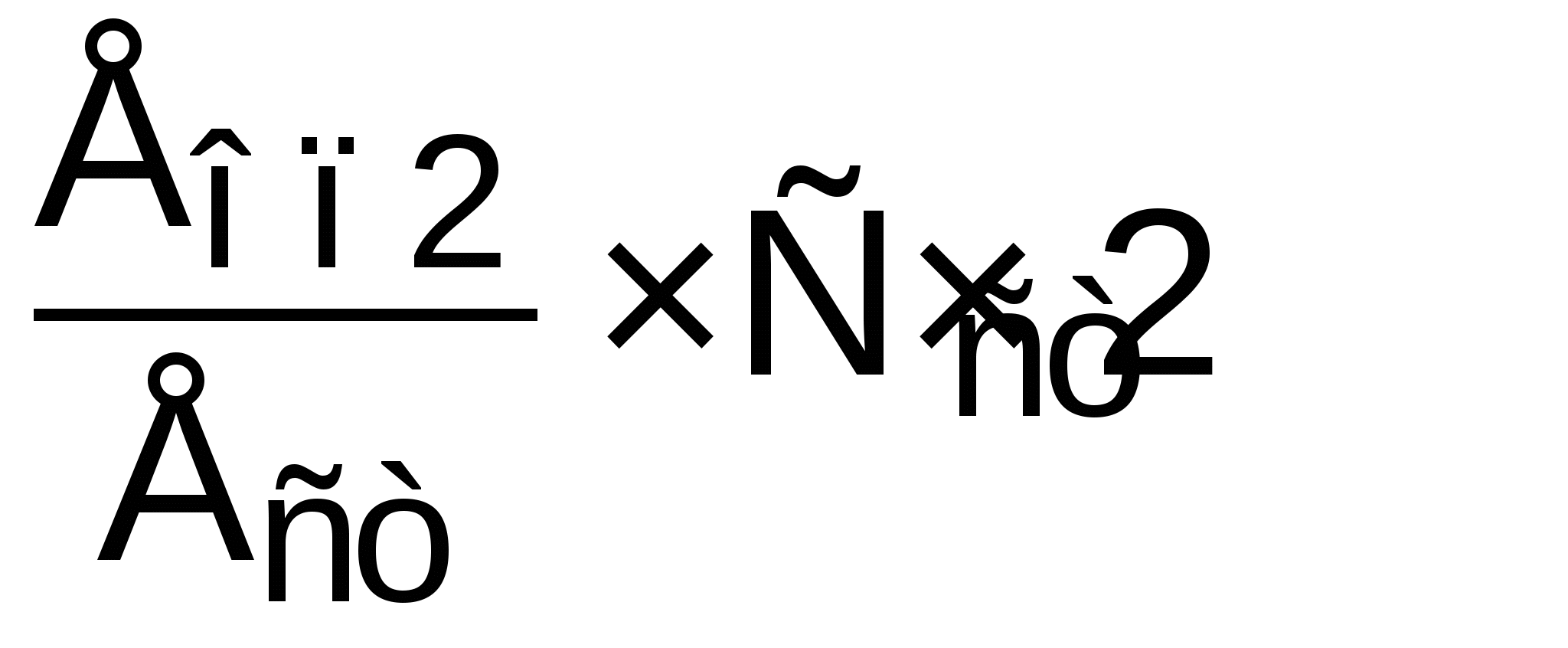
Активность АсАТ, ммоль/л·ч = 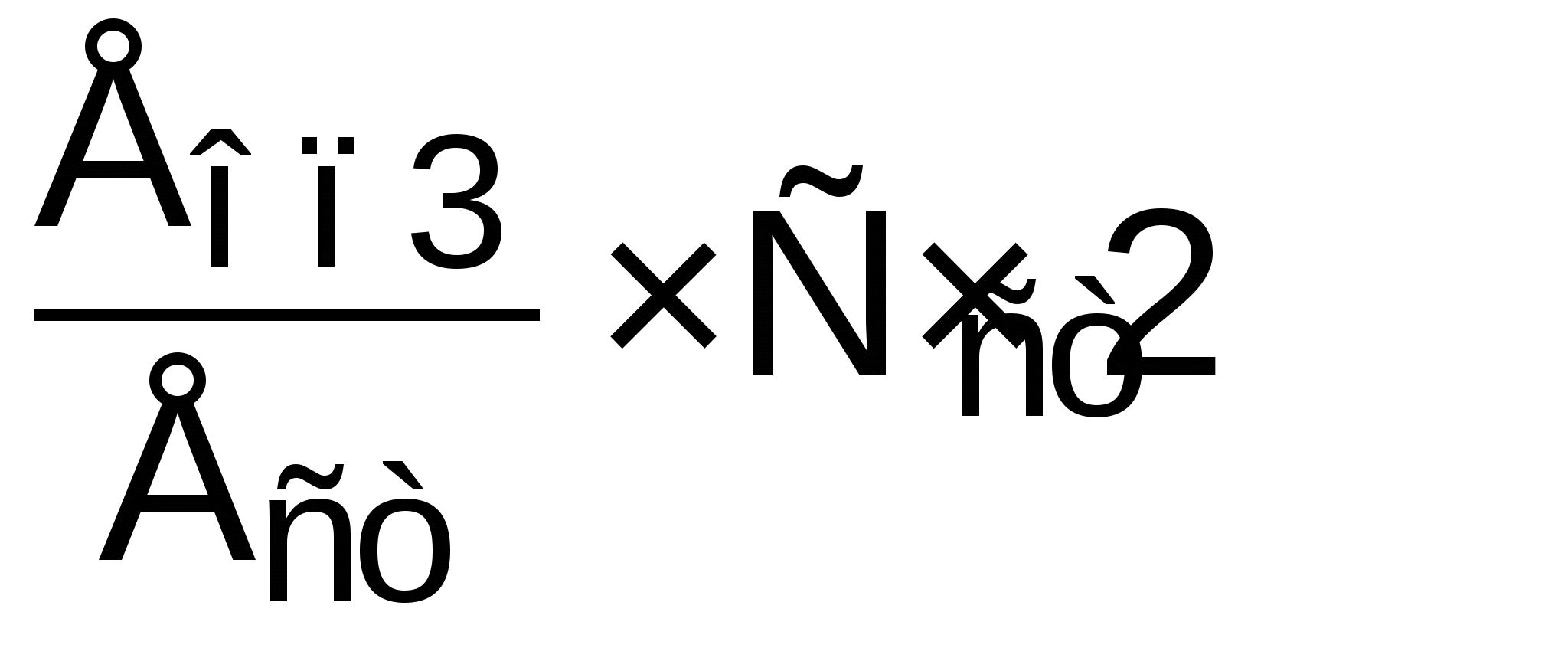 , где , где
Ест, Еоп2, Еоп3 – соответственно оптическая плотность стандартной и опытных проб для АлАТ и АсАТ, Сст – концентрация стандартного раствора, 2 – коэффициент перевода 30 минут в 1 час.
Нормальные величины
Сыворотка крови
|
Активность АлАТ
|
0,10-0,68 ммоль/л·ч
|
|
Активность АсАТ
|
0,10-0,45 ммоль/л·ч
|
Коэффициент де Ритиса (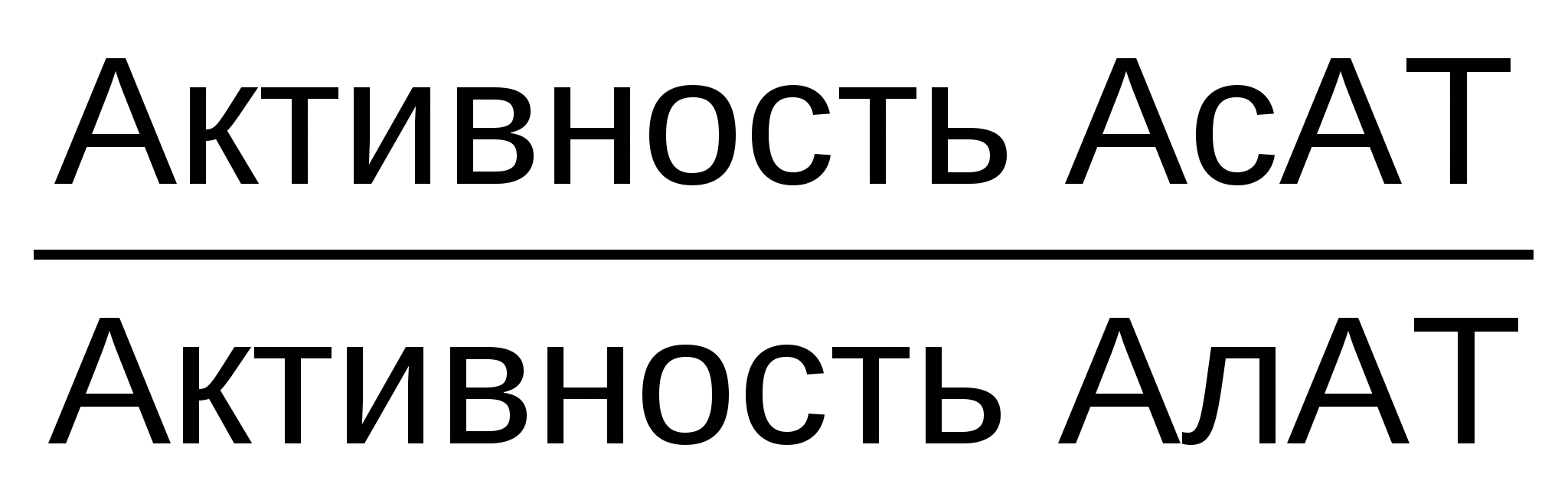 ) )
|
1,330,40
| Клинико-диагностическое значение
Наиболее часто определение активности АсАТ и АлАТ используется в клинической практике для выявления патологических процессов в миокарде и печени.
В миокарде гораздо более высокая активность АсАТ, чем АлАТ. Повышение в крови активности обоих ферментов, особенно АсАТ, в остром периоде инфаркта миокарда является достоверным диагностическим тестом и имеется в 95% случаев. Активность АсАТ достигает максимума через 24-36 часов (обычно повышена в 4-5 раз) и при адекватном лечении снижается к 3 7 м суткам. При стенокардии активность ферментов в крови изменяется незначительно.
При поражении печени (токсический, сывороточный и инфекционный гепатит) в сыворотке крови высока активность также обоих ферментов, однако более выражено повышается активность АлАТ, чем АсАТ. При инфекционном гепатите активность ферментов повышается еще до появления желтухи. В половине случаев цирроза печени, однако, наблюдается более высокая активность АсАТ, чем АлАТ.
Коэффициент де Ритиса (отношение АсАТ/АлАТ) при инфаркте миокарда значительно увеличивается, при гепатитах снижается.
Оформление работы
Указывают принцип метода, ход работы, нормальные величины и результаты исследования, отмечают клинико-диагностическое значение показателя и делают выводы о возможной патологии.
|
|
|
 Скачать 5.3 Mb.
Скачать 5.3 Mb.
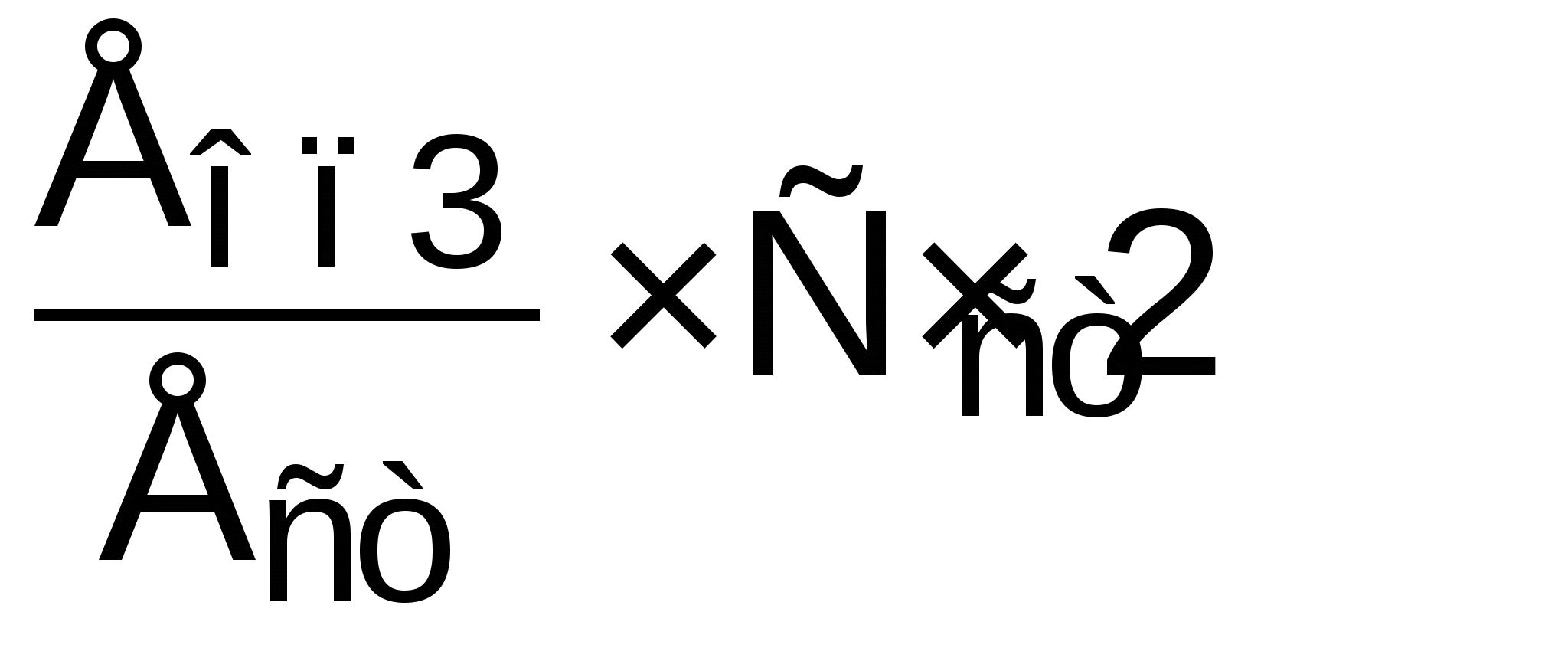 , где
, где