Тема 5.4.
Особенности и нарушения обмена
некоторых аминокислот Актуальность
Помимо превращений, свойственных всем аминокислотам, имеются еще реакции, характерные для каждой аминокислоты. Образовавшиеся продукты могут играть важную, а иногда и решающую роль в процессах обмена веществ и определять физиологическое состояние организма. Известно более 100 болезней, обусловленных наследственными дефектами метаболизма аминокислот.
Цель
Изучить основные пути превращений отдельных аминокислот: глицина, серина, цистеина, метионина, фенилаланина, тирозина, триптофана и дикарбоновых аминокислот и их нарушения.
Практическое знакомство с разделением аминокислот методом хроматографии.
Знакомство с экспресс-методом диагностики фенилкетонурии.
Вопросы для самоподготовки
Строение протеиногенных аминокислот.
Источники и общие пути превращений аминокислот в тканях.
Пути использования дикарбоновых аминокислот (глутаминовой и аспарагиновой) и их амидов в реакциях метаболизма. Связь обмена дикарбоновых аминокислот с циклом трикарбоновых кислот.
Синтез глюкозы из серина, аланина, глутаминовой и аспарагиновой кислот.
Пути использования цистеина и его серы. Реакции синтеза таурина. Характеристика заболевания "цистиноз", его причина, клинические проявления. Цистинурия и ее причины.
Использование глицина и серина в организме. Реакции взаимопревращения глицина и серина, роль тетрагидрофолиевой кислоты.
Взаимосвязь обмена глицина, серина, метионина и цистеина:
реакция синтеза S аденозилметионина из S аденозилгомоцистеина, его роль в процессах трансметилирования при синтезе ряда веществ;
реакция образования гомоцистеина и пути его дальнейших превращений;
участие витамина В9 (фолиевой кислоты), витаминов В6 (пиридоксина) и В12 (цианкобаламина).
Причины гомоцистеинемии и гомоцистинурии. Каковы сопутствующие заболевания и основы лечения?
Пути использования фенилаланина и тирозина. Анаболические и катаболические пути превращений тирозина. Реакция превращения фенилаланина в тирозин.
Характеристика заболеваний фенилкетонурия I типа (классическая) и фенилкетонурия II типа (вариантная). Дефектные ферменты, клинические проявления, основы лечения.
Реакции катаболизма тирозина. Ферменты, дефект которых приводит к тирозинемии I типа (гепаторенальная), II типа (глазокожная), III типа (новорожденных), к алкаптонурии. Характерные особенности заболеваний и основы лечения.
Нарушения анаболической функции тирозина – альбинизм и паркинсонизм. Молекулярные причины, характерные особенности заболеваний, основы лечения.
Разделение аминокислот методом хроматографии на бумаге. Принцип метода. Практическое значение определения количества аминокислот в крови и моче.
ТЕМЫ ДЛЯ РЕФЕРАТИВНЫХ СООБЩЕНИЙ
Способы разделения веществ. Хроматография, ее виды. Применение разделения веществ в исследовательских и медицинских целях.
Искусственная почка. Гемодиализ. Принцип очищения крови и его использование при коррекции патологических состояний.
Фенилкетонурия, ее типы (классическая I типа, вариантная II и III типов). Материнская фенилкетонурия. Молекулярные причины, патогенез заболеваний, клинические проявления, основы лечения.
Катаболизм глицина до аммиака, углекислого газа или низкомолекулярных органических кислот (муравьиной, щавелевой). Глиоксилатный цикл. Нарушения катаболизма – гиперглицинемия, гипероксалатурия.
Катаболизм аминокислот с разветвленным радикалом (лейцин, изолейцин, валин). Болезни "моча с запахом кленового сиропа" и изовалератацидемия. Клинические проявления, основы лечения.
Метаболизм триптофана. Причины пеллагры при нарушении обмена триптофана. Болезнь Хартнупа. Клинические проявления, основы лечения.
Лабораторная работа 1 Определение аминокислот методом
распределительной хроматографии на бумаге
Хроматографические методы применяют для сорбционно-динамического разделения смесей аминокислот, белков, углеводов, липидов и их метаболитов. Существует множество видов хроматографии, каждый из которых имеет свои биохимические основы.
Достаточно точным и доступным является метод распределительной хроматографии (модификация адсорбционной хроматографии). В данной работе в качестве адсорбента используется специальная фильтровальная бумага.
Принцип
В основе распределительной хроматографии лежит различная растворимость аминокислот в полярных и неполярных растворителях. При использовании двух жидкостей, одна из которых полярна, а другая неполярна, гидрофобные аминокислоты будут переходить в неполярную жидкость, гидрофильные аминокислоты – в полярную. Если какая-либо из этих жидкостей движется, то вместе с ней будут передвигаться соответствующие аминокислоты.
При хроматографии на бумаге вода (полярная жидкость) находится между целлюлозных волокон и является неподвижной полярной фазой. В качестве подвижной неполярной фазы используется органический растворитель бутанол.
При проведении анализа более гидрофобная аминокислота, лучше растворяющаяся в подвижном неполярном растворителе, движется с большей скоростью от линии старта, чем гидрофильная аминокислота, которая переходит в неподвижный водный слой. В результате этого отдельные аминокислоты по окончании хроматографического разделения оказываются на разном расстоянии от линии старта.
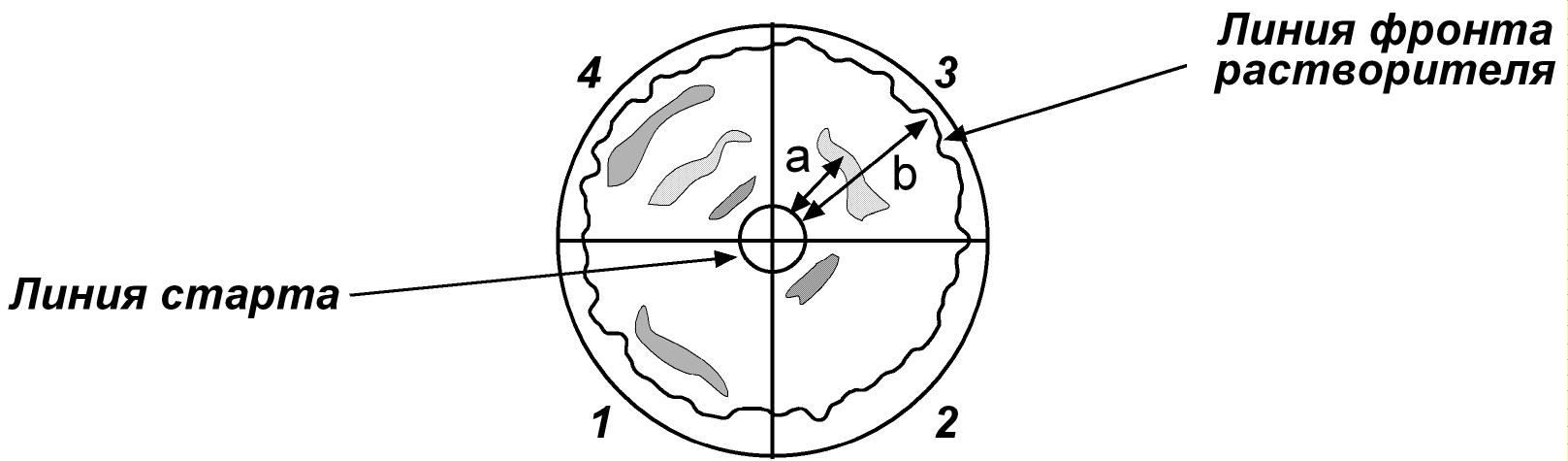
Радиальную хроматографию проводят на бумаге в чашке Петри. Растворитель перемещается от центра к периферии и захватывает аминокислоты, которые распределяются концентрическими кругами и обнаруживаются после высушивания бумаги и проведения нингидриновой реакции.
Реактивы
Хроматографическая смесь (бутанол : уксусная кислота : вода, 1,5:1,5:1,0); 2) 0,2% спиртовый р-р нингидрина.
Материал исследования
Растворы аминокислот-свидетелей – глицина, аланина, лейцина (40 ммоль/л); исследуемые растворы 1, 2, 3, содержащие аминокислоты в различном сочетании.
Проведение анализа
Диск бумаги следует держать за края, чтобы избежать появления отпечатков пальцев на хроматограмме.
Диск специальной хроматографической бумаги карандашом делят на 4 сектора и обозначают их согласно исходным растворам. На расстоянии 1,0 см от центра карандашом отмечают круговую линию старта. В центре листа хроматографической бумаги делают отверстие диаметром около 0,2 см и вставляют фитиль из скрученной полоски бумаги. Высота фитиля должна быть равна высоте чашки Петри.
Стеклянными капиллярами на линию старта в секторах 1, 2, 3 наносят соответствующие растворы аминокислот-свидетелей и в сектор 4 – исследуемую смесь аминокислот.
Просушивают хроматограммы на воздухе до исчезновения влажных пятен.
Хроматограмму помещают в заранее приготовленную чашку Петри (хроматографическую камеру), на 1/3 заполненную хроматографической смесью. Разделение проводят в закрытой чашке Петри, чтобы избежать испарения растворителя, при комнатной температуре под визуальным контролем (в течение 15 30 минут).
Когда фронт растворителя достигнет границ бумажного диска, разделение прекращают. Немедленно (!) карандашом обводят по всей окружности линию фронта растворителя.
Хроматограмму высушивают при температуре 90 100С с целью устранения растворителей и фиксации аминокислот.
Далее хроматограмму опрыскивают раствором нингидрина, вновь выдерживают при 100С. На бумаге проявляются красноватые, пурпурно-красные, в большинстве случаев сине-фиолетовые пятна, соответствующие расположению различных аминокислот.
Рассчитывают коэффициент распределения Rf для каждой аминокислоты:
Rf = 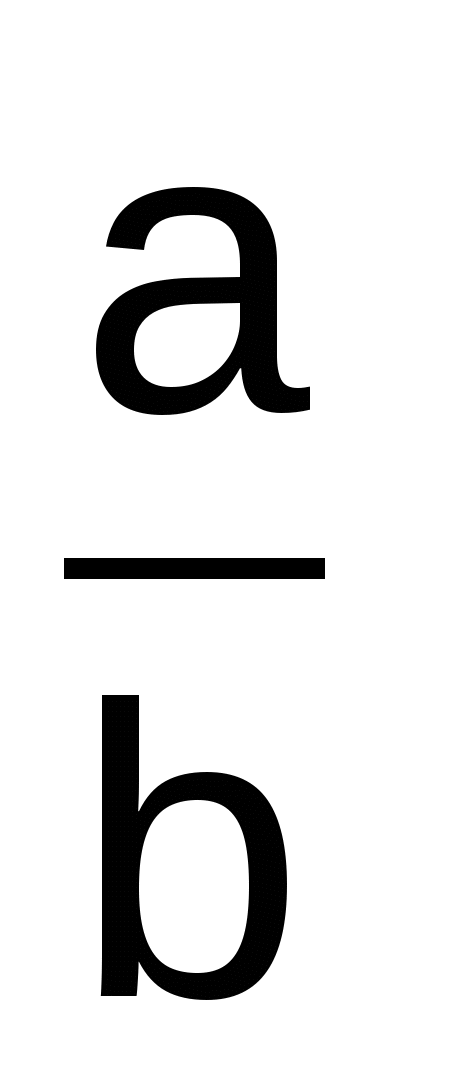 , где , где
а – расстояние, пройденное от линии старта аминокислотой (мм),
b расстояние, пройденное фронтом растворителя (мм).
Идентифицируют аминокислоты, находящиеся в исследуемом растворе (сектор 4), путем сравнения их положения (коэффициент Rf) с положением соответствующих аминокислот, используемых в качестве "свидетелей" (сектора 1, 2, 3).
Практическое значение
Разделение смеси аминокислот методом распределительной хроматографии используют для определения аминокислотного состава белков, для качественного и количественного определения аминокислот в биологических жидкостях и тканях. В научных лабораториях применяются автоматические анализаторы аминокислот с высокой чувствительностью и скоростью проведения анализа.
Определение свободных аминокислот в биологических жидкостях необходимо для диагностики нарушений их обмена. Изменения концентрации аминокислот в сыворотке крови и моче наблюдаются при недостаточной функции печени, усиленном распаде белков, ферментативных нарушениях обмена аминокислот, а также при нарушении выделительной функции почек.
Недостаток аминокислот сказывается в первую очередь на активно работающих органах, например, сердечной мышце.
При врожденных дефектах метаболизма аминокислот увеличивается концентрация в крови и усиливается экскреция с мочой одной или нескольких аминокислот.
Оформление работы
Записывают принцип метода, ход работы, расчеты коэффициента распределения известных и неизвестных аминокислот, подклеивают в тетрадь или зарисовывают полученную хроматограмму с указанием аминокислот.
Лабораторная работа 2 Обнаружение метаболитов фенилаланина в моче Принцип
Кетоны (фенилпируват, фенилацетат и др.) при взаимодействии с FeCl3 образует комплексное соединение зеленого цвета (реакция Феллинга).
Реактивы
1) 10% р-р FeCl3, 2) 2,5 М р-р H2SO4.
Материал исследования
Моча.
Проведение анализа
В пробирку вносят 1 мл мочи, добавляют 2 капли 2,5 М раствора H2SO4, после перемешивания добавляют 2 капли раствора FeCl3. В случае присутствия в моче метаболитов фенилаланина в пробирке через 1-3 минуты появляется зеленое окрашивание.
При фенилкетонурии и тирозинемии появляется зеленый цвет, при гомогентизинатурии – сине-зеленая окраска, при болезни кленового сиропа – серо-зеленое окрашивание.
Нормальные величины Клинико-диагностическое значение
Тест на наличие кетонов в моче используется при нарушениях обмена аминокислот (фенилаланина, тирозина, лейцина). Тест не пригоден для диагностики и не является скрининговым, однако может применяться для контроля над соблюдением диеты при установленном диагнозе.
При фенилкетонурии (фенилпировиноградная олигофрения) положительную реакцию Феллинга моча дает обычно только после года жизни. До года положительный тест выявляется эпизодически (на максимуме выведения фенилкетонов), поэтому при подозрении на фенилкетонурию его следует повторять неоднократно.
Производные фенилаланина появляются в моче также при поражениях печени (вирусный гепатит, отравление ядами).
Оформление работы
Записывают принцип метода, ход работы, используемый реактив и результаты проведения анализа. Отмечают клинико-диагностическое значение и делают вывод о наличии возможных патологий.
Тестовые задания
Выберите один правильный ответ.
Биологическая ценность белков обусловлена
1) порядком чередования аминокислот в молекуле белка
2) аминокислотным составом
3) молекулярной массой белков
4) зарядом белковой молекулы
Для нейтрализации токсичных веществ, образующихся в толстом кишечнике, в печени присутствует фермент
1) гексокиназа
2) аминотрансфераза
3) глюкуронилтрансфераза
4) сахараза
Энтеропептидаза является активатором фермента
1) пепсиноген
2) трипсиноген
3) химотрипсиноген
4) проэластаза
Высокоактивный фермент глутаматдегидрогеназа содержит
1) никотинамидадениндинуклеотид (НАД)
2) флавинадениндинуклеотид (ФАД)
3) флавинмононуклеотид (ФМН)
4) пиридоксальфосфат (ПАЛФ)
Серотонин в реакции декарбоксилирования образуется из
1) гистидина
2) триптофана
3) тирозина
4) 5-гидрокситриптофана
Образование -аминомасляной кислоты катализирует
1) гистидиндекарбоксилаза
2) тирозинмонооксигеназа
3) глутаматдекарбоксилаза
4) орнитиндекарбоксилаза
В состав аминотрансферазы входит кофермент
1) никотинамидадениндинуклеотид
2) флавинадениндинуклеотид
3) тиаминдифосфат
4) пиридоксальфосфат
Синтез соляной кислоты в желудке стимулирует
1) тирамин
2) гистамин
3) дофамин
4) триптамин
При гиповитаминозе С нарушен обмен аминокислоты
1) тирозина
2) лейцина
3) метионина
4) цистеина
Связывание аммиака происходит при
1) синтезе глутамата из 2-оксоглутарата
2) синтезе креатина
3) трансаминировании аланина
4) синтезе серотонина
Ситуационные задачи
1. Больного беспокоят боли в области желудка, отрыжка с неприятным запахом «тухлых яиц», урчание и газообразование в кишечнике. Какие процессы могут быть причиной появления такого запаха? Что Вы порекомендуете для нормализации процессов пищеварения?
2. В эксперименте установлено, что добавка глутаминовой кислоты в раствор, питающий сердце, оказывает положительное воздействие на физиологическую функцию сердечной мышцы, особенно в условиях недостаточного обеспечения кислородом. Объясните механизм положительного действия указанной аминокислоты на деятельность сердца.
3. У пациента содержание мочевины в крови 2 ммоль/л, за сутки с мочой выведено 180 ммоль. О нарушении функции какого органа можно думать? Какие ферменты необходимо исследовать для проверки предположения?
Раздел 6.
Строение и обмен пуриновых и пиримидиновых нуклеотидов
|
 Скачать 5.3 Mb.
Скачать 5.3 Mb.