Практикум по бх. Практикум по биологической химии Для студентов лечебного и педиатрического
 Скачать 5.3 Mb. Скачать 5.3 Mb.
|
Тема 3.2. | ||||||||||||||||||||||||||||||||||
| | Опыт 1, мл | Опыт 2, мл | Контроль, мл |
| Раствор крахмала | 1,0 | 1,0 | 1,0 |
| | Инкубируют при 37°С в течение 5 минут | ||
| Сыворотка крови | 0,02 | –– | –– |
| Моча | –– | 0,02 | –– |
| | Инкубируют при 37°С точно 5 минут | ||
| 0,01 М рабочий р-р йода Холодная дистил. вода | 1,0 8,0 | 1,0 8,0 | 1,0 8,0 |
| | Перемешивают. Измеряют оптическую плотность опытных и контрольного растворов против воды при длине волны 540 нм (зеленый светофильтр) | ||
Расчет
Активность амилазы, г/л·ч =
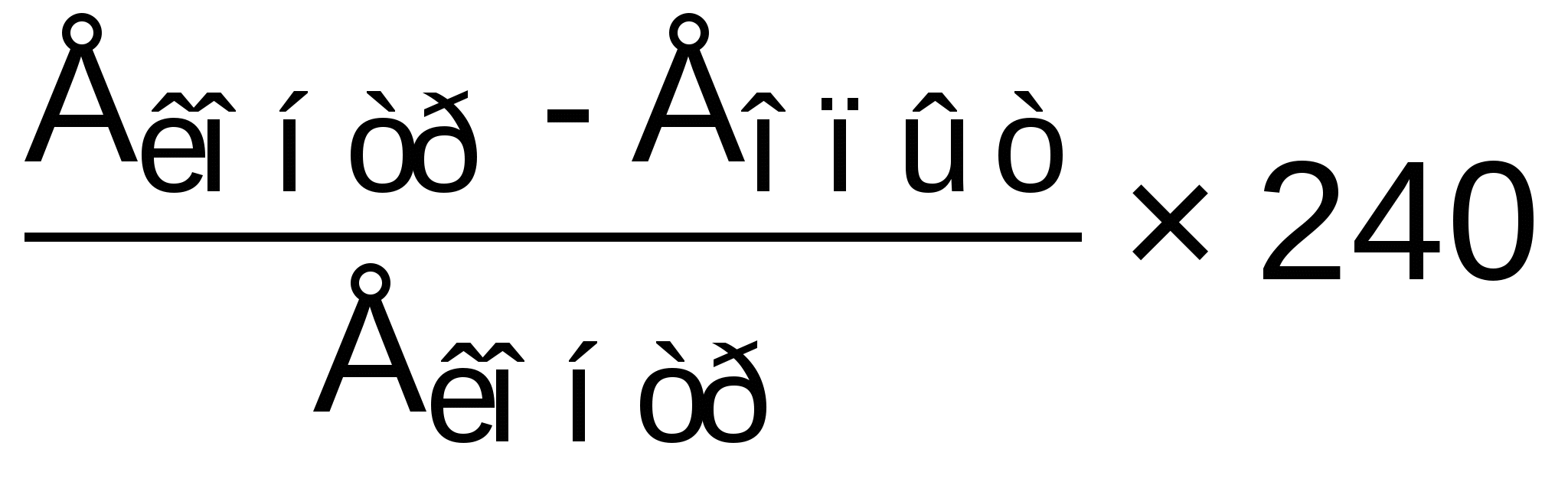 , где
, гдеЕконтр и Еопыт – соответственно оптическая плотность
контрольной и опытных проб, 240 – коэффициент пересчета.
Нормальные величины
| Сыворотка крови Моча | 16-30 г/л·ч 28-160 г/л·ч |
Клинико-диагностическое значение
У здорового человека в крови содержится амилаза 2 изоферментных типов: панкреатическая – P тип (около 30%) и слюнная – S тип (около 70%), которые попадают в кровь в результате естественного старения и отмирания клеток слюнных желез и поджелудочной железы. Фермент имеет относительно низкую молекулярную массу (около 48000 Д), фильтруется в почечных клубочках и присутствует в моче. Соотношение изоферментов в моче иное, чем в крови: Р тип – 70%, S тип – до 30%.
Сыворотка крови и моча
Повышение активности фермента в сыворотке крови и в моче происходит главным образом при заболеваниях поджелудочной железы. При остром панкреатите активность фермента в крови достигает максимума через 12 24 часа от начала заболевания (повышение в 10 30 раз) и при правильной терапии нормализуется на 2 6-е сутки. При хронических панкреатитах повышение активности фермента умеренное. Возрастание активности фермента выявляется также при поражении слюнных желез, холецистите, заболеваниях желчных путей, беременности, почечной недостаточности, кишечной непроходимости, диабетическом кетоацидозе, некоторых опухолях легких и яичников.
Снижение активности в клинической практике выявляется редко, обычно диагностического значения не имеет. Иногда отмечается у больных с заболеваниями печени (цирроз), злокачественными опухолями, гипотиреозом, кахексией, при токсикозе беременных.
Оформление работы
Отмечают принцип метода, ход работы, регистрируют результаты анализа, отмечают клинико-диагностическое значение и делают вывод о возможных патологиях.
Тестовые задания
Выберите один правильный ответ.
Фермент от небелкового катализатора отличает то, что он
1) снижает энергию активации
2) не расходуется в результате реакции
3) не претерпевает необратимых изменений
4) обладает специфичностью
Перенос групп внутри молекулы катализируют
1) изомеразы
2) трансферазы
3) лиазы
4) гидролазы
Присоединение групп по двойным связям и обратимые реакции синтеза-распада катализируют
1) изомеразы
2) лигазы
3) лиазы
4) трансферазы
Алкогольдегидрогеназа входит в класс ферментов
1) оксидоредуктазы
2) гидролазы
3) лигазы
4) трансферазы
Представителем класса гидролаз является
1) каталаза
2) алкогольдегидрогеназа
3) пепсин
4) гемоглобин
Снижение активности фермента при повышении температуры выше 50С обусловлено
1) денатурацией апофермента
2) денатурацией кофермента
3) распадом холофермента
4) гидролизом
Субстратная специфичность ферментов обусловлена
1) набором определенных функциональных групп в активном центре
2) химическим соответствием активного центра субстрата
3) наличием кофермента
4) пространственным соответствием активного центра субстрата
5) комплементарностью активного центра субстрату
Действие конкурентного ингибитора можно снять, если
1) увеличить концентрацию ингибитора
2) увеличить концентрацию субстрата
3) снизить концентрацию фермента
4) изменить условия реакции: рН и температуру
Ковалентная модификация при регуляции активности ферментов – это
1) присоединение к нему какой-либо химической группы
2) внутримолекулярная перестройка структуры фермента
3) присоединение или удаление небольшого фрагмента от субстрата
4) присоединение или удаление небольшого фрагмента от фермента
В отличие от неорганических катализаторов ферменты
1) ускоряют наступление реакции
2) являются регулируемыми
3) расходуются в процессе реакции
4) не катализируют энергетически невозможные реакции
Ситуационные задачи
1. Обнаружено, что если аллостерический фермент аспартат:карбамоил-трансфераза (молекула состоит из 12 протомеров) выдержать в течение 4 минут при 60°С, то он теряет чувствительность к аллостерическому ингибитору (ЦТФ). При этом ферментативная активность сохраняется. Схожие свойства проявляют и другие аллостерические ферменты. Предложите возможные механизмы подобного нарушения.
2. Объясните биохимический смысл некоторых требований (подчеркнуты), предъявляемых к хранению и использованию ферментных препаратов:
растворение сухого препарата дистиллированной водой комнатной температуры.
при растворении препарата перемешивать осторожно.
хранение раствора препарата при низкой температуре.
при необходимости длительного хранения – высушивание препарата и запаивание в вакуумированные ампулы.
3. Липаза – фермент жировой ткани, обеспечивающий расщепление нейтральных жиров, может находиться в двух формах с различной активностью: в виде простого белка и в виде фосфопротеина. Объясните, почему переход одной формы в другую сопровождается изменением активности. Предположите, в каком состоянии липаза является активной, если известно, что выделяющийся при физической нагрузке гормон адреналин запускает каскад реакций, ведущих к фосфорилированию внутриклеточных белков.
Контрольные вопросы к итоговому занятию
Классификация аминокислот по биологической роли, по химическому строению, по физико-химическим свойствам, по растворимости в воде.
Строение протеиногенных аминокислот. Физико-химические свойства аминокислот. Понятие изоэлектрической точки.
Пептидная связь, реакция ее образования. Свойства пептидной связи.
Биологическая роль белков. Классификация белков по функции и строению. Физико-химические свойства белков и белковых растворов. Факторы, стабилизирующие белковую молекулу в растворе. Коллоидные свойства белков.
Влияние смещения рН на заряд аминокислот и белков. Факторы, вызывающие осаждение белков. Свойства денатурированного белка. Характерные особенности денатурации и ренативации.
Уровни структурной организации белковой молекулы. Типы связей, стабилизирующие структуру белковой молекулы. Аминокислоты, образующие эти связи.
Простые белки (альбумины, глобулины, гистоны, протамины), их представители, роль в организме.
Сложные белки: фосфопротеины, нуклеопротеины, гликопротеины и протеогликаны, хромопротеины, металлопротеины, липопротеины. Структура мононуклеотидов на примере АМФ, АДФ, АТФ, цАМФ. Формулы гема, гиалуроновой кислоты и хондроитинсульфатов.
Принцип цветных качественных реакций на аминокислоты и белки. Возможность использования в практике.
Удаление белков из раствора и очистка белковых растворов от примесей. Механизмы реакций. Использование в биохимии и медицине.
Методы осаждения белков, применимые для получения белков и ферментов в нативном состоянии.
Составление произвольных тетрапептидов с заданными свойствами, умение назвать их, определение суммарного заряда и растворимости, зоны pH, в которой находится их изоэлектрическая точка.
Определение составных компонентов фосфопротеинов и гликопротеинов.
Перечислите общие свойства витаминов, их классы. Провитамины и антивитамины, приведите примеры. Общие причины возникновения гипо- и авитаминозов. Гипервитаминозы.
Характеристика жирорастворимых витаминов А, D3, Е, К, F: физиологическое название, химическая структура витаминов А, D2, D3, Е, K, F, активных форм витаминов A и D, суточная потребность, пищевые источники. Биохимические функции и процессы, в которых принимает участие витамин. Возможные причины и клинические проявления гипер-, гипо- и авитаминозов. Что такое каротиноиды? Укажите их роль в организме.
Характеристика водорастворимых витаминов В1, В2, В3 (никотиновая кислота), В5 (пантотеновая кислота), В6, В9, В12, С, Н: физиологическое название, строение (кроме витаминов В12, фолиевой и пантотеновой кислот), суточная потребность, пищевые источники. Биохимические функции и реакции, в которых принимают участие витамины. Структурные формулы коферментов (для В1, В2, В3, В6). Возможные причины и клинические проявления гипо- и авитаминоза. Роль витаминов для правильного роста и развития ребенка.
Механизм антибактериальной активности сульфаниламидных препаратов.
Качественные реакции открытия витаминов А, Е, К, D3, В1, В2, В3, В6, В12. Принцип методов, ход определения, практическое значение методов.
Количественное определение витамина С в моче. Принцип метода, ход определения, клинико-диагностическое значение, нормальные показатели.
Ферменты, их роль в осуществлении биохимических реакций. Сравните ферменты и неорганические катализаторы.
Структурно-функциональная организация ферментов (уровень структуры, простые и сложные ферменты). Холофермент, апофермент, кофактор, кофермент, простетическая группа, активный и аллостерический центры. Роль апофермента и кофермента в катализе. Строение мультиферментных комплексов клетки.
Особенности строения изоферментов. Общая характеристика и примеры изоферментов.
Классификация ферментов. Основные подклассы в каждом классе. Номенклатура ферментов. Что такое классификационный номер? Примеры биохимических реакций, ферменты этих реакций.
Этапы ферментативного катализа. Особенности ковалентного и кислотно-основного катализа.
Количественное определение активности ферментов в биологических объектах. Единицы активности ферментов.
Основные свойства ферментов, графики зависимости активности фермента от различных воздействий. Специфичность фермента, виды специфичности. Механизмы специфичности (теории Фишера и Кошланда).
Способы регуляции метаболической активности в клетке: компартментализация, изменение концентрации фермента, изменение концентрации субстрата, наличие изоферментов, аллостерические механизмы регуляции ферментов, ковалентная модификация ферментов, проферменты и их ограниченный протеолиз, белок-белковое взаимодействие.
Основные виды ингибирования ферментов: конкурентное и неконкурентное, обратимое и необратимое. Примеры.
Использование ферментов в медицине. Энзимотерапия и энзимодиагностика. Использование ингибиторов ферментов в качестве лекарств. Примеры.
Отличие первичных и вторичных форм энзимопатий. Примеры.
Исследование скорости ферментативной реакции на примере каталазы.
Практическое обнаружение влияния температуры на активность ферментов на примере амилазы слюны и дегидрогеназ дрожжей. Принцип метода и ход определения.
Практическое обнаружение действия инактиваторов и активаторов ферментов на примере амилазы слюны. Принцип метода и ход определения.
Иследование специфичности действия ферментов на примере амилазы слюны и уреазы. Принцип метода и ход определения.
Принцип метода и ход определения активности амилазы в сыворотке крови и моче. Нормальные величины и клинико-диагностическое значение метода.
Раздел 4.
Биологическое окисление
Тема 4.1.
Общие пути катаболизма:
окислительное декарбоксилирование пирувата.
Цикл трикарбоновых кислот.
Ферменты дыхательной цепи.
Окислительное фосфорилирование
(семинар)
Актуальность
Биологическое окисление протекает во всех живых клетках организма в виде совокупных окислительных реакций. При этом происходит многократная передача протонов и электронов или только электронов от донора к акцептору. Конечными продуктами этого процесса являются вода окисления и диоксид углерода (Н2О и СО2). Основной функцией биологического окисления является обеспечение организма энергией для процессов жизнедеятельности. Формой энергии, доступной для использования, является аденозинтрифосфорная кислота (АТФ).
Некоторые вещества, как лекарственные (барбитураты), так и токсические (цианиды, окись углерода), подавляют окислительное фосфорилирование и синтез АТФ.
Цель
Изучение реакций пируватдегидрогеназного комплекса и цикла трикарбоновых кислот, строения цепи дыхательных ферментов митохондрий и механизмов окислительного фосфорилирования.
Вопросы для самоподготовки
Пластическая (анаболизм) и энергетическая (катаболизм) функции метаболизма.
Стадии катаболических превращений питательных веществ в организме, связанные с высвобождением свободной энергии. Чему равно высвобождение и запасание энергии на каждом из этапов?
Строение и функции митохондрий.
Химическая формула АТФ (аденозинтрифосфорная кислота), роль АТФ? Значение циклов АТФ – АДФ и НАДФН – НАДФ+.
Основные макроэргические соединения клетки – АТФ, 1,3 дифосфоглицерат, фосфоенолпируват, креатинфосфат, ацетилS-КоА? Что такое субстратное фосфорилирование?
Источники ключевых продуктов метаболизма – ацетилS-КоА и пировиноградной кислоты. Дальнейшая судьба указанных веществ.
Строение мультиферментного пируватдегидрогеназного комплекса, его ферменты и коферменты. Суммарная реакция окислительного декарбоксилирования пировиноградной кислоты. Химизм пяти отдельных реакций. Регуляция процесса.
Реакции цикла трикарбоновых кислот (цикл Кребса, цикл лимонной кислоты). Механизм окисления ацетильной группы. Ферменты и коферменты процесса. Биологическое значение ЦТК. Роль оксалоацетата, НАДН и метаболитов ЦТК в регуляции скорости цикла.
Взаимосвязь ЦТК с катаболизмом углеводов, липидов, белков.
Характеристика процесса окислительного фосфорилирования по плану:
молекулярная организация и последовательность ферментных комплексов цепи переноса электронов, нарисуйте схему цепи дыхательных ферментов;
перенос электронов по комплексам дыхательной цепи, роль коферментов (ФМН, FeS-белки, коэнзим Q, гемовые группы цитохромов);
роль кислорода – конечного акцептора электронов восстановленных субстратов биологического окисления;
выкачивание протонов из матрикса митохондрий – участки трансмембранного переноса (участки сопряжения окисления и фосфорилирования), формирование электрохимического градиента;
строение АТФ-синтазы, роль электрохимического градиента в работе АТФ-синтазы.
Коэффициент фосфорилирования Р/О. Его величина для НАДН и ФАДН2. Расчет количества АТФ, полученной при окислении некоторых субстратов (аланин, аспарагиновая и глутаминовая кислоты).
Комплексы ферментов дыхательной цепи, на которые могут действовать ингибиторы. Как ингибируется процесс окислительного фосфорилирования?
Разобщение окисления и фосфорилирования. Механизм этого явления. Вещества, вызывающие разобщение.
Бурая жировая ткань: ее функция, локализация. Функция белка термогенина. Его роль в термогенезе.
Причины гипоэнергетических состояний.
Регуляция окислительного фосфорилирования. Дыхательный контроль. Роль соотношения АТФ и АДФ в регуляции работы дыхательной цепи.
Примеры применения нуклеотидов (АТФ, АДФ, АМФ, ФМН) в качестве лекарственных препаратов.
Тестовые задания
Выберите один правильный ответ.
Скорость пируватдегидрогеназной реакции ингибируют:
1) АТФ, кальций, НАД
2) кальций, ацетил-КоА, НАД
3) АДФ, ФАДН2, НАДН
4) ацетил-КоА, НАДН, АТФ
В цикле трикарбоновых кислот молекула ФАДН2 образуется при работе:
1) малатдегидрогеназы
2) изоцитратдегидрогеназы
3) сукцинатдегидрогеназы
4) -кетоглутаратдегидрогеназы
Скорость цикла трикарбоновых кислот определяется концентрацией:
1) -кетоглутарата
2) оксалоацетата
3) янтарной кислоты
4) цитрата
Движущей силой переноса электронов по цепи дыхательных ферментов является:
1) энергия распада АТФ
2) перекачивание протонов водорода через мембрану
3) работа железосерных центров
4) различная электроотрицательность переносчиков
В дыхательном контроле проявляется зависимость скорости переноса электронов по дыхательной цепи от:
1) соотношения концентрации АДФ и АТФ
2) концентрации НАДН
3) величины потребляемого кислорода
4) активности АТФ-синтетазы
Увеличение электрохимического градиента приведет:
1) к увеличению скорости перекачивания протонов
2) к ускорению синтеза АТФ
3) к повышению скорости переноса электронов
4) к повышенному выделению СО2 и Н2О
Энергия, высвобождаемая при переносе электронов по цепи дыхательных ферментов, используется на:
1) перекачивание ионов Н+ через мембрану
2) окисление железосерных центров
3) образование молекул воды
4) синтез АТФ
Создание протонного градиента на митохондриальной мембране обусловлено:
1) распадом АТФ
2) окислением НАДН
3) движением электронов
4) выкачиванием ионов Н+ в обмен на Na+
Внедрение разобщителя в митохондриальную мембрану приведет:
1) к снижению окисления НАДН
2) к активации синтеза АТФ
3) к снижению переноса электронов по дыхательной цепи
4) к увеличению протонного градиента
Образующиеся в цикле трикарбоновых кислот восстановленные эквиваленты используются:
1) в цепи дыхательных ферментов
2) в реакциях синтеза глюкозы, жирных кислот и т.д
3) для работы АТФ-синтетазы
4) для синтеза ацетил-КоА
Ситуационные задачи
1. Прием внутрь разобщающих агентов вызывает обильное потоотделение и повышение температуры тела. Дайте этому объяснение на молекулярном уровне. Как изменяется соотношение Р/О в присутствии разобщающих агентов? Можно ли использовать разобщители для борьбы с ожирением? Дайте мотивированный ответ.
2. Особая жировая ткань – бурый жир – имеется у некоторых животных, впадающих в зимнюю спячку или приспособленных к обитанию в холодных местностях. В митохондриях бурого жира выход АТФ на 1 атом поглощенного кислорода составляет менее 1 молекулы, в то время как других тканях 2-3 молекулы.
какая физиологическая функция может определяться этим низким отношением Р/О в буром жире новорожденных?
каковы возможные механизмы, которые могли бы определять столь низкое отношение Р/О, характерное для митохондрий бурого жира.
Раздел 5.
Обмен аминокислот и белков
