Практикум. Лабораторный практикум по органической химии. Практикум по органической химии оглавление Оформление лабораторного журнала 2 гидроксисоединения 3
 Скачать 295.46 Kb. Скачать 295.46 Kb.
|
АМИНОКИСЛОТЫ, ПЕПТИДЫ И БЕЛКИАминокислотыАминокислоты – органические соединения, содержащие в молекуле два типа функциональных групп: карбоксильную —СООН, и аминогруппу —NH2, т.е. относится к гетерофункциональным соединениям. Аминокислоты играют огромную роль в жизни животных и растительных организмов, так как являются теми структурными элементами, из которых построены молекулы важнейшего природного полимера – белка – основы всего живого. Все аминокислоты делятся на природные (обнаруженные в растительных и животных организмах) и синтетические. Природные аминокислоты могут быть протеиногенными (входят в состав белков) и непротеиногенными (не входят в состав белков). Среди природных аминокислот имеется группа незаменимыхаминокислот, состоящая из 10 представителей, которые не могут синтезироваться в организме человека и животного и должны поступать извне с пищевым белком. Отсюда деление белков на полноценные (содержащие все незаменимые аминокислоты) и неполноценные. Обще число известных аминокислот превышает 200, но наиболее важных, постоянно встречающихся во всех белках аминокислот – 20. Все они являются α- аминокислотами, т.е. аминогруппа находится в α-положени относительно карбоксильной группы:    R CH COOH R CH COOHNH2 β- и γ-аминокислоты в составе белков отсутствуют. В зависимости от числа и характера функциональных групп различают: моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые кислоты, оксиаминокислоты, серосодержащие аминокислоты. По химической природе радикала R α-аминокислоты разделяют на алифатические (например, глицин, аланин, аспарагиновая кислота, глутаминовая кислота), ароматические (например, фенилаланин, тирозин) и гетероциклические (например, триптофан, гистидин) Для биохимических превращений и пространственного строения молекул белка важен состав и характер химических связей атомов радикала R в молекулах α- аминокислоты. Могут быть неполярные радикалы и полярные радикалы, содержащие как ионогеные (диссоциирующие) так и неионогенные (недиссоциирующие) функциональные группы. В зависимости от общего числа карбоксильных и аминогрупп в молекуле α- аминокислоты подразделяются на нейтральные (моноаминомонокарбоновые), кислые (моноаминодикарбоновые) и оснòвные (диаминомонокарбоновые) кислоты. Для аминокислот применима международная номенклатура (ИЮПАК), но чаще используют тривиальные названия, связанные с источником выделения. Приводим формулы некоторых α-аминокислот, которые позволят закрепить классификацию аминокислот, рассмотреть в дальнейшем их главные химические свойства.  O O   H2N CH2 C H2N CH2 COH O      CH3 CH C CH3 CH CNH2 OH глицин или гликоколь 2-аминоэтановая кислота аминоуксусная кислота аланин 2-аминопропановая кислота α – аминопропионовая кислота  O O  C CH2 C CH2HO O      CH C CH CNH2 OH O O         C CH2 CH2 CH C C CH2 CH2 CH CHO NH2 OH аспарагиновая кислота 2-аминобутандиовая кислота аминоянтарная кислота глутаминовая кислота 2-аминопентандиовая кислота α – аминоглутаровая кислота  O O        NH2 CH2 CH2 CH2 CH2 CH C NH2 CH2 CH2 CH2 CH2 CH CNH2 OH лизин* 2,6-диаминогексановая кислота α, ε – диаминокапроновая кислота 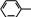  O O CH2 CH C CH2 CH CNH2 OH фенилаланин* 2-амино-3-фенилпропановая кислота α-амино-β-фенилпропионовая кислота O    HO CH2 CH C HO CH2 CH CNH2 OH тирозин 2-амино-3-(4’-гидроксифенил) пропановая кислота α-амино-β-(пара-оксифенил) пропионовая кислота 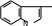 CH2 CH2 H O      CH C CH CNH2 OH O      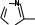 CH2 CH C CH2 CH C N OH N OHNH2 H триптофан* гистидин* * - незаменимые α-аминокислоты Все природные α-аминокислоты (кроме глицина) содержат асимметрический углеродный атом (центр хиральности) и потому оптически активные. Некоторые аминокислоты (изолейцин, треонин, цистин и гидроксипролин) содержат два центра хиральности. Поэтому для большинства α-аминокислот (с одним асимметрическим атомом) возможно существование двух оптически активных энантиомеров (D- и L- конфигурации) и одного рацемата (смесь равных количеств D- и L-изомеров). COOH COOH    NH2 C* H CH3 NH2 C* H CH3H C* CH3 NH2  L(+) аланин D(-) аланин L(+) аланин D(-) аланинЗнаки (+) и (-) указывают на направление вращения плоскости поляризованного света (по часовой или против часовой стрелки), что определяется экспериментально. Для природных α-аминокислот, входящих в состав белков, характерна L- конфигурация. D-изомеры встречаются редко (например, в составе некоторых антибиотиков) и не усваиваются животными организмами. Химические свойства аминокислот определяются их функциональными группами – кислотного характера (СООН) и оснòвного характера (NH2). Поэтому аминокислоты являются амфотерными соединениями, образуя соли как с щелочами, так и кислотами:     CH COO- Na+ + H2O CH COO- Na+ + H2O   R CH COOH NH2 R CH COOH NH2NH2    CH COOH Cl- N+ H3 CH COOH Cl- N+ H3Благодаря своей амфотерности аминокислоты в живом организме играют роль буферных веществ, поддерживающих определенную концентрацию водородных ионов. Одновременное присутствие в молекуле аминокислоты кислотной и оснòвной группы обуславливает их внутримолекулярное взаимодействие, приводящее к образованию внутренней соли или биполярного иона (цвиттер-иона).       H3N+ CH H3N+ CHR R COO- биполярный ион Ионное строение α-аминокислот подтверждено спектроскопическими исследованиями и особенностями их физических свойств. В водном растворе α-аминокислота существует в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы. Положение равновесия зависит от рН среды. N+ H3 CH R - H+  COOH N+ H3 CH COO- COOH N+ H3 CH COO-+ H+ R + OH-  - OH- - OH-NH2 CH COO- R катионная форма (кислая среда) анионная форма (щелочная среда) Положение равновесия различных форм α-аминокислоты при определенных значениях рН зависит от строения радикала R, особенно от наличия в нем ионогеных групп. Но для всех α-аминокислот в сильнокислой среде (рН 1 – 2) преобладает катионная форма, в сильнощелочной среде (рН 13 – 14) - анионная форма. При определенных значениях рН суммарный заряд молекулы равен нулю, биполярный ион не перемещается во внешнем электрическом поле (не участвует в электрофорезе), т.е. молекула находится в изоэлектрическом состоянии. Такое значение рН называется изоэлектрическойточкой(ИЭТ, рI). Более точное определение ИЭТ – значение рН, при котором аминокислота находится в основном в состоянии биполярного иона, а концентрации катионной и анионной форм равны и минимальны. Для нейтральных α-аминокислот значение рI не равно 7, а находится в интервале 5,5 – 6,3, что связано с большей способностью к диссоциации кислотной группы. Для кислых α-аминокислот рI много ниже 7. Например для аспарагиновой кислоты рI = 2,77, для глутаминовой кислоты рI = 3,22. Для оснòвных α-аминокислот рI > 7, например для лизина рI = 9,74. Диссоциация молекул аспарагиновой кислоты в водном растворе дает кислую среду (рН < 7): 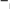 HOOC CH2 HOOC CH2CH COOH N..H2 HOH -OOC CH2 CH COO- + H+ N+ H3 HOH  HOOC CH2 HOOC CH2CH COO- N+ H3 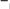 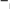  кислая среда (рН<7) рН = 2,77 кислая среда (рН<7) рН = 2,77Но молекула не находится в изоэлектрическом состоянии (суммарный заряд не равен нулю). Поэтому к водному кислому раствору необходимо добавить некоторое количество кислоты для перехода в состояние биполярного иона, что и происходит при рН = 2,77. Избыток добавленной кислоты переводит биполярный ион в катионную форму. Диссоциация основной α-аминокислоты – лизина, в водном растворе обуславливает щелочную среду: .. (CH ) CH COOH   + HOH  H N+ (CH ) H N+ (CH )CH COO- + OH-   H2N 2 4  N..H2 N..H23 2 4  N+ H3 щелочная среда В данном случае для перехода в изоэлектрическое состояние молекулы аминокислоты (биполярного иона) к водному раствору с щелочной средой необходимо добавить некоторое количество щелочи до рН = 9,74. Наряду с рассмотренными кислотно-основными свойствами для аминокислот характерны также реакции, протекающие только по карбоксильной группе (например, образование эфиров) и только по аминогруппе (образование солей с минеральными кислотами, взаимодействие с азотистой кислотой и др.). Реакции, характерные для α-аминокислот, т.е. декарбоксилирование, дезаминирование, с нингидрином и превращения аминокислот при нагревании, зависящие от положения NH2-группы (α, β, γ и δ) и дающие различные продукты. Для аминокислот возможны реакции конденсации, которые происходят при получении пептидов и белков как в процессе жизнедеятельности, так и синтетическим путем. |
