Практикум. Лабораторный практикум по органической химии. Практикум по органической химии оглавление Оформление лабораторного журнала 2 гидроксисоединения 3
 Скачать 295.46 Kb. Скачать 295.46 Kb.
|
ПРАКТИКУМОпыт 14. Кислотные свойства карбоновых кислотРеактивыиоборудование:2н раствор уксусной кислоты (СН3СООН), индикатор конго, индикатор метиловый оранжевый, индикатор фенолфталеин, 3 пробирки. Выполнение опыта: в три пробирки внесите по 5 капель уксусной кислоты и добавьте по 2 капли: в первую пробирку индикатора конго, во вторую – индикатора метилового оранжевого, в третью – индикатора фенолфталеина. Отметьте, в каких пробирках происходит изменение окраски индикатора. Опыт 15. Растворимость в воде карбоновых кислот и их солей. Отношение кислот к индикаторамРеактивы и оборудование: концентрированная муравьиная кислота (НСООН), концентрированная уксусная кислота (СН3СООН), бензойная кислота (С6Н6), дистиллированная вода, 2н раствор гидроксида натрия (NaOH), универсальная индикаторная бумага, 3 пробирки, водяная баня, электроплитка. Выполнение опыта: в три пробирки внесите по 20 капель воды и добавьте в первую пробирку 5 капель концентрированной уксусной кислоты, во вторую – 5 капель концентрированной муравьиной кислоты, в третью - 1 лопатку бензойной кислоты. Пробирки с осадком нагрейте до растворения осадка. По капле полученных растворов органических кислот нанесите на полоску универсальной индикаторной бумаги и определите рН растворов. Нагретые смеси охладите, отметьте, выделяются ли снова кристаллы кислоты и добавьте 3 капли гидроксида натрия, встряхните и отметьте происходящие изменения. Ход реакции:HCOOH CH3COOH HOH  HOH HOHHCOO- + H+ (H3O)  CH3COO- + H+ (H3O) CH3COO- + H+ (H3O) 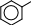 COOH COO- COOH COO- HOH + H+ HOH + H+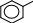 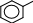 COOH COONa COOH COONa + NaOH + H2O + NaOH + H2Oбензойная кислота бензоат натрия Опыт 16. Окисление карбоновых кислот перманганатом калияРеактивыиоборудование:2н раствор муравьиной кислоты (НСООН), 2н раствор уксусной кислоты (СН3СООН), 2н раствор щавелевой кислоты ((СООН)2), 2н раствор серной кислоты (H2SO4), 0,1н раствор перманганата калия (KMnO4), 3 пробирки, водяная баня, электроплитка. Выполнение опыта: в 3 пробирки внесите по 3 капли растворов муравьиной, уксусной и щавелевой кислот, прибавьте 3 капли раствора серной кислоты и 2 капли раствора перманганата калия. Нагрейте пробирки. Ход реакции:5H–COOH + 2KMnO4 + 3H2SO4 → 5HO–COOH + K2SO4 + 2MnSO4 + 3H2O O окислитель O окислитель   H C H COH O  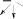 HO C HO COH CO2 H2O  CH3COOH + KMnO4 CH3COOH + KMnO4 O O C C OH KMnO4 OH KMnO4O H SO O   HC + CO2 HC + CO22 4 OH  C COH Одноосновные предельные кислоты, за исключением муравьиной кислоты, устойчивы по отношению к окислителям. Муравьиная кислота, являющаяся по своему строению также и альдегидом, легко окисляется с образованием двуокиси углерода и воды. Щавелевая кислота, легко переходящая в муравьиную с отщеплением СО2, также легко окисляется перманганатом калия в кислой среде. Опыт 17. Открытие уксусной кислоты. Получение комплексной железной соли и разложение ее при кипяченииРеактивыиоборудование:ацетат натрия (СН3СООNa), вода, 0,1н раствор хлорида железа (FeCl3), 1 пробирка, водяная баня, электроплитка. Выполнение опыта: в пробирку внесите 1 лопатку ацетата натрия, добавьте 10 капель воды и 2 капли раствора хлорида железа. Нагрейте пробирку. Ход реакции: |



















