|
|
Практикум. Лабораторный практикум по органической химии. Практикум по органической химии оглавление Оформление лабораторного журнала 2 гидроксисоединения 3
ПРАКТИКУМ Опыт 20. Доказательство наличия гидроксильных групп в глюкозе
Реактивы и оборудование: 2н раствор гидроксида натрия (NaOH), 0,2н раствор сульфата меди (CuSO4), 0,5% раствор глюкозы, 1 пробирка.
Выполнение опыта: в пробирку внесите 6 капель раствора гидроксида натрия и 2 капли раствора сульфата меди. К полученной смеси добавьте 3 капли раствора глюкозы.
Образующийся вначале осадок гидроксида меди Cu(ОН)2 немедленно растворяется и получается прозрачный раствор сахарата меди с синей окраской. Растворение гидроксида меди (II) указывает на наличие нескольких гидроксильных групп в глюкозе. Полученный раствор сохраните для следующего опыта.
Ход реакции:
  CuSO4 + 2NaOH Cu(OH)2 + Na2SO CuSO4 + 2NaOH Cu(OH)2 + Na2SO
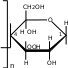
 H H 2 HOH H O   C  C OH   C H + Cu(OH)2 C OH  C OH H    C  H C   HO C  H C  H C O  OH OH H O  .. Cu .. CuOH O  HO HO H HO.. O H   C  C H   C OH + 2H2O C H  C H
CH2OH
CH2OH
или
CH2OH
хелатное соединение
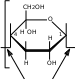
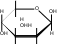 CH2OH CH2OH2 OH   + Cu + Cu6  CH 2OH H 5 O 4 4 H OH H O 1 Cu H  : :O H 2 3 OH1 H OH 4H + 2H 2O
O
O
H
OH OH 3 2 5
H OH
H O:
CH2OH
6
β-D-глюкопираноза H
Образование легкорастворимых, интенсивно окрашенных и не разлагаемых щелочью комплексных алкоголятов меди (хелатных соединений) при взаимодействии растворов сахаров с гидроксидом двухвалентной меди доказывает наличие в молекулах сахаров нескольких гидроксильных групп, расположенных рядом.
Опыт 21. Восстановление гидроксида меди (II) глюкозой в присутствии щелочи (проба Троммера)
Реактивы и оборудование: сахарат меди, 1 пробирка, водяная баня, электроплитка.
Выполнение опыта: полученный в предыдущем опыте щелочной синий раствор сахарата меди нагрейте. Что вы наблюдаете?
Ход реакции: HO C Ht0 + 2Cu+2(OH)2HO C H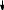 + Cu +1O + 2H O + Cu +1O + 2H O   H C OH  H C OH    H C OH H C OH2 2 оксид меди (I)
CH2OH
глюкоза
CH2OH
глюконовая кислота и смесь продуктов окисления
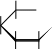 CH 2OH H OH
H
H или  t t0 CH 2OH   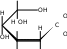  H   OH H COH OHH OH + 2Cu+2(OH)2H OH + Cu2+1O+ 2H2O При нагревании в щелочной среде глюкоза восстанавливает находящуюся в растворе двухвалентную медь до яркоокрашенных нерастворимых продуктов (гидроксид меди (I), оксид меди (I) или металлическая медь). Глюкоза, как и многие моносахариды, в щелочной среде окисляется с глубоким расщеплением молекулы, т.е. идет деструктивное окисление. При этом образуется сложная смесь водорастворимых веществ, преимущественно оксикислот с небольшим числом углеродных атомов. Эта реакция называется пробой Троммера и используется, например, для открытия глюкозы в различных системах. С лучшими результатами реакцию окисления можно проделать, используя не Cu(ОН)2 , а ее раствор в сегнетовой соли (реактив Фелинга, фелингова жидкость), что применяется при анализе сахаров в пищевых продуктах.
Фруктоза в щелочном растворе превращается в глюкозу и маннозу, т.е. в альдозы и также окисляется с расщеплением молекулы, а значит, может дать положительную пробу Троммера.
Опыт 22. Восстановление аммиачного раствора оксида серебра глюкозой Реактивы и оборудование: 0,2н раствор нитрата серебра (AgNO3), 2н раствор
гидроксида натрия (NaOH), водный раствор аммиака (NH4OH), 0,5% раствор глюкозы, 1 пробирка, водяная баня, электроплитка.
Выполнение опыта: в пробирку внесите 2 капли раствора нитрата серебра, 1 каплю гидроксида натрия и добавьте 2-3 капли водного раствора аммиака до растворения образующегося осадка гидроксида серебра. Добавьте 2 капли раствора глюкозы и нагрейте пробирку. Опишите свои наблюдения.
Ход реакции:
 2AgNO3 + 2NaOH Ag2O 2AgNO3 + 2NaOH Ag2O  + 2NaNO3 + H2O + 2NaNO3 + H2O
 Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH
 HO C H t0 HO C H    H C OH  H C OH+ 2[Ag(NH 3) 2]OH      H C OH  H C OH+ 2Ag + 4NH 3 + H 2O CH 2OH глюкоза 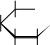 CH 2OH H OH  H H или t t0 CH 2OH глюконовая кислота 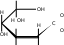 CH 2OH   H  OH H OH H OHC + 2[Ag(NH 3) 2]OH OH H OH + 2Ag + 4NH 3 + H 2O
Опыт 23. Доказательство наличия гидроксильных групп в сахарозе
Реактивы и оборудование: 2н раствор гидроксида натрия (NaOH), 0,2н раствор сульфата меди (CuSO4), 1% раствор сахарозы, 1 пробирка.
Выполнение опыта: в пробирку внесите 6 капель раствора гидроксида натрия и 2 капли раствора сульфата меди. К полученному раствору добавьте 2 капли раствора сахарозы. Вместо осадка гидроксида меди (II) получается раствор сахарата меди. Для каких соединений характерно растворение Cu(ОН)2?
Ход реакции:
  CuSO4 + 2NaOH Cu(OH)2 + Na2SO CuSO4 + 2NaOH Cu(OH)2 + Na2SO
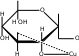
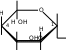
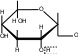 CH 2OH  CH2OH CH2OH H H OO H HO CH2OHH O   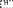  + Cu + Cu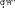
 CH 2OH 
сахарат меди CH2OH H 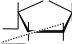 O O H HO CH 2OH H
хелатное комплексное соединение
Опыт 24. Отсутствие восстанавливающей способности у сахарозы
Реактивы и оборудование: сахарат меди, 1 пробирка, водяная баня, электроплитка.
Выполнение опыта: полученный в предыдущем опыте щелочной синий раствор сахарата меди нагрейте.
Как можно было ранее убедиться (см. оп. 21), глюкоза при этих условиях давала отчетливую реакцию восстановления (проба Троммера положительная). Сахароза в этих же условиях не дает реакции восстановления. Объясните почему.
Ход реакции:   CH 2OH  CH2OH CH2OH H O H HO CH2OH+ Cu(OH) 2
H OH
остаток
α – глюкозы
OH H
остаток
β - фруктозы
 сахароза Опыт 25. Доказательство гидролиза сахарозы Реактивы и оборудование: 1% раствор сахарозы, 2н раствор соляной кислоты (HCl), 2н раствор гидроксида натрия (NaOH), 0,2н раствор сульфата меди (CuSO4 ), реактив Селиванова (раствор резорцина в растворе соляной кислоты), 2 пробирки, водяная баня, электроплитка. Выполнение опыта: в первую пробирку внесите 3 капли раствора сахарозы, добавьте 2 капли раствора соляной кислоты. Нагрейте в течение 2 минут. Добавьте 8 капель раствора гидроксида натрия. Едкой щелочи добавляют с избытком, чтобы нейтрализовать кислоту, взятую для гидролиза, а также создать необходимую для реакции восстановления щелочную среду. Затем добавьте 2 капли раствора сульфата меди и нагрейте. Во второй пробирке проделайте реакцию Селиванова. Для этого в пробирку внесите 10 капель реактива Селиванова и 2 капли раствора сахарозы и нагрейте. Объясните, что доказывается первой пробиркой, а что второй. Ход реакции:   H H 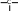 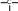 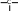  HO H O H H CH 2OH CH2OH C 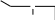 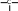 HO H 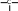 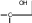 O H H CH 2OH +H 2O +H+, t0H  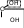  H  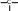  HO H  H H CH2OHHO O + HO H H CH2OH C 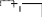 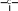 H 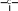 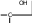 O CH 2OH  остаток α –D– глюкопиранозы остаток β –D– фруктофуранозы α–глюко- пираноза β-фрукто- фураноза
называют инверсией (от французского inverse – обратный), так как раствор сахарозы, имевший до гидролиза правое вращение, т.е. вращает плоскость поляризованного света по часовой стрелке, после гидролиза изменяет вращение на левое под влиянием образующейся фруктозы.
Опыт 26. Наличие восстанавливающей способности у лактозы (молочного сахара)
Реактивы и оборудование: 2н раствор гидроксида натрия (NaOH), 0,2н раствор сульфата меди (CuSO4), 1% раствор лактозы, 1 пробирка, водяная баня, электроплитка.
Выполнение опыта: в пробирку внесите 6 капель раствора гидроксида натрия,
2 капли раствора сульфата меди. Добавьте 2 капли раствора лактозы. Нагрейте раствор.
Ход реакции:
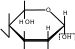 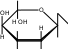 CH2OH CH2OH CH2OH CH2OH
 O O
H OH 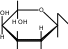 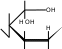 CH 2OH  O H OH H CH 2OH H OHOH  H t0  C + 2Cu+2(OH)2O
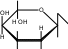 CH 2OH t0  CH2OH CH2OH  OH C +Cu +1O + 2H O  O 2 2O H OH H OH лактобионовая кислота Опыт 27. Открытие крахмала
Формула амилозы:
   CH2OH CH2OH
H OH
-1,4-глюкозидные связи
Реактивы и оборудование: крахмальный клейстер, раствор йода (J2), дистиллированная вода, 1 пробирка.
Выполнение опыта: в пробирку внесите 10 капель крахмального клейстера и 1 каплю раствора йода. Нагрейте пробирку, а затем охладите.
При нагревании раствор обесцвечивается. Но при охлаждении окраска восстанавливается.
Объясните наблюдающиеся явления.
Ход реакции:
охлаждение
 I2 + (C6H10O5)n I2(C6H10O5)n I2 + (C6H10O5)n I2(C6H10O5)n
желтый
нагревание
синий
Окраску имеет комплекс йода с крахмалом, образование которого объясняют способностью молекул I2 помещаться в длинных полостях между витками спиралей, образованных молекулой крахмала. Полости заполнены плотно, и взаимодействия между молекулами достаточно сильны, чтобы обеспечить появление интенсивного окрашивания даже при очень низких концентрациях йода. При взаимодействии йода с крахмалом образуется соединение включения (клатрат) канального типа. Клатрат – это комплексное соединение, в котором частицы одного вещества («молекулы-гости») внедряются в кристаллическую структуру «молекул-хозяев». В роли «молекул-хозяев» выступают молекулы амилозы, а «гостями» являются молекулы йода. Молекулы йода располагаются в канале спирали диаметром 1 нм, создаваемой молекулой амилозы, в виде цепей I − − − I − − − I. Попадая в спираль, молекулы йода испытывают сильное влияние со стороны своего окружения (ОН-групп), в результате чего увеличивается длина связи I–I до 0,306 нм (в молекуле йода длина связи 0,267 нм). Причем эта длина едина для всех атомов йода в цепи. Данный процесс сопровождается изменением бурой окраски йода на сине-фиолетовую (lмакс 620–680 нм). Амилопектин, в отличие от амилозы, дает с йодом красно-фиолетовое окрашивание (lмакс 520–555 нм).



0,267 нм 0,306 нм
I2
Опыт 28. Кислотный гидролиз крахмала
Реактивы и оборудование: крахмальный клейстер, 2н раствор серной кислоты (H2SO4), 2н раствор гидроксида натрия (NaOH), 0,2н раствор сульфата меди (CuSO4), раствор йода (J2), предметное стекло, 1 пробирка, водяная баня, электроплитка.
Выполнение опыта: в пробирку внесите 2 капли крахмального клейстера, добавьте 4 капли раствора серной кислоты и нагрейте в течение 20 минут, затем охладите пробирку. Проверьте гидролизат на отсутствие крахмала. Для этого с помощью пипетки нанесите 1 каплю гидролизата на предметное стекло и добавьте 1 каплю раствора йода. Убедившись в отсутствии крахмала, добавьте к продукту гидролиза 10 капель раствора гидроксида натрия (избыток щелочи нужен для нейтрализации кислоты и создания щелочной среды), затем 2 капли раствора сульфата меди. Нагрейте раствор. При нагревании раствора появляется желтовато- красное окрашивание. Это указывает на то, что крахмал при гидролизе разложился до восстанавливающего дисахарида мальтозы и далее при полном гидролизе до - глюкозы.
Ход реакции:
HOH, H+
HOH, H+
HOH, H+
   (C 6H 10O 5)n (C 6H 10O 5)m mC 12H 22O 11 nC 6H 12O 6
крахмал
декстрины m < n
мальтоза α–глюкоза
Гидролиз крахмала, как и реакции гидролиза других соединений, значительно ускоряется в присутствии кислот или ферментов и используется для получения патоки. Крахмальная патока широко применяется в кондитерской промышленности (в производстве конфет, мармелада, пастилы, карамели, халвы, пряников и различных видов мучных кондитерских изделий). Вопросы для контроля.
Какие соединения называются углеводами?
Как классифицируются углеводы?
Что такое L– и D-, - и -, формы сахара? Укажите на конкретных примерах моносахаридов.
Что такое гликозидный гидроксил? Какие реакции свойственны сахарам по этому гидроксилу?
Укажите, какие дисахариды относятся к восстанавливающему и невосстанавливающему типу. Приведите примеры восстанавливающих и невосстанавливающих дисахаридов.
Гидролиз крахмала и клетчатки. Какие промежуточные и конечные продукты при этом образуются?
|
|
|
 Скачать 295.46 Kb.
Скачать 295.46 Kb.