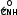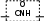5.2. Пептиды и белки Пептиды– продукты конденсации двух и более α-аминокислот, когда карбоксильная группа одной молекулы взаимодействует с аминогруппой соседней  O
молекулы с образованием пептидной (амидной) связи
C NH .
В зависимости от числа аминокислот, участвующих в реакции конденсации, различают ди-, трипептиды и т.д. вплоть до полипептидов. Условно считают вещества с молекулярной массой до 10000 (число аминокислотных остатков до 100) пептидами или полипептидами, а вещества с молекулярной массой от 10000 до нескольких миллионов (число аминокислотных остатков свыше 100) – белками.
Главное, что основой макромолекулы белка является полипептидная цепь как продукт поликонденсации различных α-аминокислот.
В полимерной цепи первая аминокислота со свободной аминогруппой называется N-концевой аминокислотой, последняя аминокислота со свободной карбоксильной группой называется C-концевой аминокислотой.
Пример образования дипептида:
 O     CH 3 CH C NH 2O      + H N CH 2 C OH
аланин глицин
    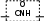 CH 3 CH NH2  CH 2 CO   + H 2O OH
N-концевая аминокислота
пептидная связь
C-концевая аминокислота
В названии пептида только C-концевая аминокислота сохраняет свое название, предыдущие аминокислоты имеют окончание –ил. Поэтому дипептид аланина и глицина называется аланил-глицин. Пептиды, также, как и аминокислоты, являются амфотерными и существуют в виде внутренних солей – биполярных ионов. В зависимости от аминокислотного состава пептиды могут проявлять в растворе преобладающие свойства кислоты или основания. Каждый пептид (полипептид) характеризуется своей изоэлектрической точкой. Полипептиды встречаются в организмах животных и человека, являясь продуктами распада белков. Ряд пептидов играет важную биологическую роль, входят в состав лекарственных средств (например, декапептид грамицидин С -
антибиотик), являются гормонами (например, инсулин), содержатся в головном мозге (группа нейропептидов, обладающих обезболивающим действием).
Белки– высокомолекулярные органические соединения, построенные из α- аминокислот, входят в состав всех живых организмов (животных, растений, микроорганизмов), выполняя многообразные жизненно важные функции (каталитические, энергетические, строительные, обменные, защитные и многие другие). Белки – необходимая составная часть пищевых продуктов.
Все многообразие белковых молекул классифицируют по различным признакам.
По продуктам гидролиза белки делятся на простые (протеины) и сложные (протеиды). Продуктами гидролиза простых белков являются только аминокислоты. В состав сложных белков кроме аминокислот входят и другие классы веществ (называемые простетическими группами).
К простым белкам относятся альбумины, глобулины и другие, которые по- разному растворяются в различных средах.
Сложные белки разделяют по природе простетической группы: фосфопротеиды (содержат молекулы фосфорной кислоты), гликопротеиды (содержат остатки углеводов), нуклеопротеиды (связаны с нуклеиновыми кислотами), липопротеиды (включают жиры, фосфолипиды) и другие.
В последнее время сложные белки называют протеинами (например, липопротеины).
По форме макромолекул белки разделяют на глобулярные (шарообразная или веретенообразная форма) и фибриллярные (волокнистое строение).
Большинство природных белков относится к глобулярным, которые растворимы в воде и солевых растворах с образованием коллоидных систем. Фибриллярные белки не растворяются в воде, к ним относится β-кератин (волосы, роговая ткань), β- фиброин шелка, коллаген кожи (соединительной ткани организма).
Белки и полипептиды характеризуются несколькими видами структур.
Первичнаяструктура – это специфическая последовательность (порядок чередования) α-аминокислот в полипептидной цепи. Пептидные связи (амидные связи), являясь ковалентными, ответственны за формирования первичной структуры. Первичная структура определяется аминокислотным составом пептидов и белков, т.е. природой и количественным соотношением входящих в них α-
аминокислот.
Аминокислотный состав определяется по продуктам гидролиза с применением современных физико-химических методов (в основном хроматографических).
Вторичная структура молекул белка – это конформация полипептидной цепи, которая может быть двух видов: α-спираль и β-структура (структура складчатого листа, складчатого слоя).
Вторичная структура закрепляется за счет водородных связей между пептидными группами α-аминокислотных остатков, довольно близко расположенных в полипептидной цепи. При этом для α-структуры проявляются
внутримолекулярные водородные связи, для β-структуры – межмолекулярные водородные связи.
Полипептидная цепь природных белков частично имеет α-спираль, частично β- структуру.
Третичнаяструктура белковой молекулы – это способ расположения в пространстве всей полипептидной цепи. По-существу третичная структура – это форма молекул белка, которая может быть глобулярной или фибриллярной. Связи, ответственная за третичную структуру – многообразны. Это и ионные взаимодействия, гидрофобные взаимодействия (притяжение углеводородных радикалов R различных молекул аминокислот), водородные связи, ковалентные связи при образовании сложноэфирной группы (СО—О—) или дисульфидных мостиков (S - S).
Все эти связи поперечны по отношению к полипептидной цепи и проявляются между различными частями этой цепи.
Четвертичная структура – это объединение нескольких полипептидных цепей, приводящее к образованию белкового комплекса. При этом каждая отдельная цепь (субъединица) сохраняет характерную для нее первичную, вторичную и третичную структуру, а белковый комплекс (агрегат) представляет собой единое целое и выполняет новые биологические функции, не свойственные отдельным цепям. Четвертичная структура закрепляется за счет водородных связей и гидрофобных взаимодействий между отдельными полипептидными цепями. Четвертичная структура белка крови – гемоглобина – образование из четырех полипептидных цепей.
Химические свойства белков определяются химическими свойствами аминокислот, образующих полипептидную цепь. Сохранение свободных аминогрупп и карбоксильных групп в молекулах белка обуславливает их амфотерность, возможности взаимодействия как с кислотами, так и основаниями.
Различное соотношение NH2-групп и СООН-групп в молекулах белка определяет три их типа – кислые, нейтральные и оснòвные. Соответственно, изоэлектрическая точка таких белков будет лежать в кислой среде, вблизи рН = 7 или в щелочной среде.
Растворимые в воде белки могут образовывать как коллоидные растворы, так и истинные (молекулярные) растворы, что зависит от молекулярной массы, гидрофильности, концентрации макромолекул и многих факторов.
Важнейшие цветные реакции для белков, полипептидов, а также для α- аминокислот выполняют в практикумах по органической химии или биохимии и рассматриваются в учебной литературе.
Денатурация белков – изменение природной (нативной) макроструктуры белка (при сохранении первичной структуры). При этом происходит изменение физико- химических и биологических свойств белков. Денатурация может быть обратимой и необратимой в зависимости от характера внешнего воздействия. При изменении третичной и четвертичной структуры белка возможна обратимая денатурация.
|
 Скачать 295.46 Kb.
Скачать 295.46 Kb. O
O O
O


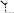
 H2N CH C R1
H2N CH C R1 



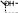 NH CH C R2
NH CH C R2




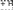 NH CH C
NH CH C