Практикум. Лабораторный практикум по органической химии. Практикум по органической химии оглавление Оформление лабораторного журнала 2 гидроксисоединения 3
 Скачать 295.46 Kb. Скачать 295.46 Kb.
|
ГИДРОКСИСОЕДИНЕНИЯГидроксисоединения – органические вещества, содержащие в молекулах одну или несколько гидроксильных групп —ОН, связанных с углеводородным радикалом. В зависимости от характера углеводородного радикала гидроксисоединения подразделяются на две большие группы: спирты и фенолы. СпиртыСпирты – производные углеводородов, в молекулах которых гидроксильная группа образует σ-связь с sp3-гибридизованной орбиталью атома углерода. Спирты классифицируются: 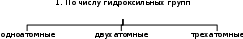   CH3 CH2 OH CH3 CH2 OHэтилоый спирт (этанол) CH2 CH2    OH OH OH OHэтиленгликоль (этандиол) CH2 CH CH2 OH OH OH      глицерин глицерин(пропантриол-1,2,3)    CH3 CH2 OH CH3 CH2 OHH2C    CH OH CH OHCH2 OH  этилоый спирт (этанол) этилоый спирт (этанол)метиловый спирт (этенол) бензиловый спирт (фенилкарбинол)       H H CH3 CH3 H H CH3 CH3  H C C OH H C C OHH H CH3 C OH H CH3 C OH  CH3 CH3этилоый спирт (этанол) пропановый спирт (пропанол) 2-метилпропанол-2 Название спиртов по заместительной номенклатуре ИЮПАК состоят из названия соответствующего углеводорода, суффикса –ол и цифры, указывающей положение гидроксигруппы. В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами –диол(две ОН-группы), -триол (три ОН-группы) и т.д. Химические свойства спиртов определяются электронным строением молекулы и характером ковалентной связи. ..   R O.. H R O.. HВсе многочисленные реакции спиртов можно разделить на три группы: реакции, идущие с участием атома водорода гидроксильной группы (отщепление протона – кислотные свойства); реакции, происходящие с замещением или отщеплением гидроксильной группы; реакции, затрагивающие углеводородный радикал, в том числе реакции окисления. Спирты обладают слабокислотными свойствами, в меньшей степени, чем у воды (для воды рКа = 15,7, для этилового спирта – рКа = 16,0) и поэтому окраска индикаторов не подтверждает кислую среду в спирте. Спирты не взаимодействуют с водными растворами щелочей, но реагируют с щелочными металлами образуя алкоголяты, легко разлагающиеся водой. С карбоновыми кислотами спирты образуют сложные эфиры (реакция этерификации). Спирты можно рассматривать как очень слабые основания, так как они могут протонизироваться за счет неподеленной электронной пары атома кислорода с образованием непрочного оксониевого катиона. Реакции замещения гидроксильной группы на галоген (нуклеофильное замещение SN) и отщепления группы —ОН в реакциях дегидратации (внутримолекулярной или межмолекулярной), как и реакции дегидрирования и окисления, протекают и приводят к получению продуктов в зависимости от характера спирта (первичного, вторичного или третичного). |
