Практикум. Лабораторный практикум по органической химии. Практикум по органической химии оглавление Оформление лабораторного журнала 2 гидроксисоединения 3
 Скачать 295.46 Kb. Скачать 295.46 Kb.
|
ФенолыФенолы – органические соединения, в молекулах которых гидроксильная группа непосредственно связана с атомом углерода ароматического ядра, т.е. образует σ-связь с sp2-гибридизованной орбиталью углеродного атома.  Фенолы классифицируются: OH OH OH 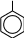   OH OHфенол оксибензол OH резорцин м-диоксибензол OH пирогаллол 1,2,3-триоксибензол  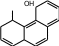 OH OH OH OH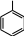  фенол -нафтол фенантрол Химические свойства фенолов объясняются их электронным строением, проявлением мезомерного эффекта (+М – эффекта) для гидроксильной группы. Неподеленная электронная пара атома кислорода находится в сопряжении с π– электронами бензольного ядра, притягивается к ядру. В результате уменьшения электронной плотности атома кислорода прочность связи О—Н уменьшается и облегчается отрыв протона, т.е. усиливается кислотность (как способность отщепления протона). Для фенола величина рКа = 9,7, что значительно меньше рКа алифатических спиртов (для С2Н5ОН рКа = 16,0). Повышенная кислотность фенолов по сравнению со спиртами проявляется во взаимодействии с щелочами с образованием фенолятов. Реакция практически необратимая, т.к. образуется вода, как более слабый электролит чем фенол (для воды рКа = 15,7).  C6H5OH + NaOH C6H5ONa + H2O C6H5OH + NaOH C6H5ONa + H2OОднако фенолы – очень слабые кислоты, окраска индикаторов не подтверждает кислую среду, а феноляты в водных растворах сильно гидролизованы и кислоты, более сильные, чем фенол, вытесняют из фенолятов свободные фенолы. Для фенолов, как производных ароматических углеводородов характерны реакции электрофильного замещения. Гидроксильная группа, проявляя положительный мезомерный эффект (+М), преобладающий над отрицательным индуктивным эффектом (-J) увеличивает электронную плотность в ядре и тем самым облегчает реакции электрофильного замещения. Гидроксильная группа в фенолах является сильным орто-пара ориентантом (заместителем I рода). |
