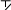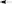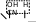Практикум. Лабораторный практикум по органической химии. Практикум по органической химии оглавление Оформление лабораторного журнала 2 гидроксисоединения 3
 Скачать 295.46 Kb. Скачать 295.46 Kb.
|
ПРАКТИКУМОпыт 8. Окислительно-восстановительная реакция формальдегидаРеактивыиоборудование:раствор формальдегида, индикатор метиловый оранжевый, 1 пробирка. Выполнениеопыта:в пробирку внесите 4 капли формальдегида и добавьте 1 каплю индикатора метилового оранжевого. Ход реакции: O O  2H C 2H CH O     H C + CH3OH OH H C + CH3OH OHформальдегид муравьиная кислота Опыт 9. Окисление альдегидов аммиачным раствором оксида серебра (реакция «серебряного зеркала»)Реактивы и оборудование: 0,2н раствор нитрата серебра (AgNO3), 2н раствор гидроксида натрия (NaOH), водный раствор аммиака (NH4OH), 1%-ный раствор формалина, 1 пробирка, водяная баня, электроплитка. Выполнение опыта: в пробирку внесите 2 капли раствора нитрата серебра, 1 каплю раствора гидроксида натрия. К полученному бурому осадку добавьте 2-3 капли аммиака, до растворения осадка. К прозрачному раствору добавьте 2 капли раствора формалина. Пробирку слегка подогреть. На поверхность пробирки серебро выделяется в виде блестящего зеркального налета. Вот почему реакцию восстановления аммиачного раствора оксида серебра называют часто реакцией «серебряного зеркала», хотя положительной реакцией считается и просто почернение или даже побурение бесцветного раствора. Ход реакции: 2AgNO3 + 2NaOH Ag2O + 2NaNO3 + H2O 2AgNO3 + 2NaOH Ag2O + 2NaNO3 + H2O Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH       H C H + 2[Ag+1(NH3)2]OH O H C H + 2[Ag+1(NH3)2]OH OH C OH + 2Ag0 + 4NH3 + H2O O NH3   HC ONH4 O HC ONH4 O   2 H C OH + Ag +1O O 2 Ag+0 + HO C OH     O Oмуравьиная кислота угольная кислота Опыт 10. Окисление альдегидов гидроксидом меди (II) в щелочном раствореРеактивыиоборудование:2н раствор гидроксида натрия (NaOH), 0,2н раствор сульфата меди (CuSO4), 1%-ый раствор формалина, 1 пробирка, водяная баня, электроплитка. Выполнение опыта: в пробирку внесите 6 капель раствора гидроксида натрия и добавьте 2 капли раствора сульфата меди. К выпавшему осадку гидроксида меди прибавьте 2-3 капли раствора формалина и взболтайте раствор. Нагрейте. Что происходит с осадком после нагревания. Ход реакции: O to O to  HC + 2Cu (OH)2 HC + 2Cu (OH)2H O   HC + 2CuOH + H2O OH HC + 2CuOH + H2O OHЖелтый осадок гидроксида меди (I) при нагревании легко теряет воду и превращается в оксид меди (II) красного цвета:  O to O to  HC + Cu2O HC + Cu2OH желтый O   HC + 2Cu HC + 2CuOH красный Это очень важная качественная реакция на альдегидную группу, ее восстанавливающую способность. Она широко известна в биохимии и медицине как проба Троммера; в химии сахаров используется и для количественного определения. В некоторых случаях, в частности у формальдегида, являющегося наиболее активным из альдегидов, реакция может идти и дальше: до образования металлической меди («медного зеркала»). Опыт 11. Йодоформная проба на ацетонРеакция называется пробой Либена и применяется для открытия ацетона. Реактивы и оборудование: ацетон, раствор йодида в иодиде калия (I2+KI), 2н раствор гидроксида натрия (NaOH), 1 пробирка. Выполнениеопыта:в пробирку внесите 5 капель раствора йода в иодиде калия и прибавьте 1-2 капели раствора гидроксида натрия, до обесцвечивания раствора. К раствору добавьте 3 капли ацетона. Мгновенно выпадает желтовато-белый осадок с характерным запахом йодоформа. Ход реакции:+I-OH HI2 + NaOH HOI + NaI |