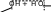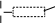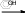|
|
Практикум. Лабораторный практикум по органической химии. Практикум по органической химии оглавление Оформление лабораторного журнала 2 гидроксисоединения 3
ПРАКТИКУМ
Опыт 1. Окисление этилового спирта хромовой смесью
Реактивыиоборудование:этиловый спирт (С2Н5ОН), 2н раствор серной кислоты (H2SO4), 0,5н раствор бихромата калия (K2Cr2O7), 1 пробирка, водяная баня, электроплитка.
Выполнениеопыта:в пробирку внесите 5 капель этилового спирта, добавьте 2 капли раствора серной кислоты и 1 каплю раствора бихромата калия. Полученный раствор нагрейте до начала изменения цвета.
Ход реакции:   CH 3 CH 2 OHокислитель O     CH 3 C H
этанол этаналь
 O O
     3CH3 CH2 OH + K2Cr2O7 + 4H2SO4 3CH3 C + Cr2(SO4)3 + 7H2O + K2SO4 3CH3 CH2 OH + K2Cr2O7 + 4H2SO4 3CH3 C + Cr2(SO4)3 + 7H2O + K2SO4
H
Происходит образование сульфата хрома (III) сине-зеленого цвета.
Реакция может быть использована для открытия этилового спирта (по запаху альдегида).
Опыт 2. Реакция глицерина с гидроксидом меди (II) в щелочной среде
Реактивы и оборудование: 0,2н раствор сульфата меди (CuSO4), 2н раствор гидроксида натрия (NaOH), глицерин (С3Н5(ОН)3), 2 пробирки, водяная баня, электроплитка.
Выполнение опыта: в пробирку внесите 2 капли раствора сульфата меди, 5 капель раствора гидроксида натрия и взболтайте. Появляется студенистый голубой осадок гидроксида меди (II). Нагрейте раствор.
Ход реакции:
 CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
При нагревании в щелочной среде до кипения полученный гидроксид меди (II) разлагается. Это видно по выделению черного осадка меди (II).
 OH OH   Cu CuO + H2O Cu CuO + H2O OH
Повторите опыт, но перед нагреванием гидроксида меди (II) добавьте в пробирку 1 каплю глицерина.
Что происходит с раствором после нагрева?
H H
   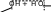 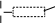 H C OH C H H C OH C H
  Cu Cu
  H C O H + HO H C OH H HO C H    HO C H H  2H 2O + H H C O    C OH H O C H    H   HO C H H глицерат меди Можно предполагать, что реакция идет еще сложнее, так как отмытый от щелочи осадок Сu(ОН)2 в глицерине не растворяется. Растворение наблюдается только в щелочной среде. Опыт 3. Доказательство кислотного характера фенола Реактивы и оборудование: «жидкий» фенол (С6 Н5 ОН), фенольная вода, 2н раствор гидроксида натрия (NaOH), 1 пробирка. Выполнениеопыта:в пробирку внесите 10 капель фенольной воды, добавьте 1 каплю «жидкого» фенола и взболтайте. К полученной мутной эмульсии фенола в воде добавьте 1 каплю раствора гидроксида натрия. Моментально образуется прозрачный раствор фенолята натрия, так как он хорошо растворяется в воде. Ход реакции:   OH ONa  + NaOH + H2Oфенолят натрия Опыт 4. Разложение фенолята натрия кислотой Реактивыиоборудование:фенолят натрия, 2н раствор соляной кислоты (HCl).
Выполнение опыта: к раствору фенолята натрия (опыт 3) добавьте 2 капли раствора соляной кислоты. Жидкость мутнеет вследствие выделения свободного фенола.
Ход реакции:
  ONa OH ONa OH
 + HCl + NaCl + HCl + NaCl
Опыт 5. Качественная реакция обнаружения фенолов. Цветная реакция с хлоридом железа (III)
С помощью этой реакции легко можно отличить различные фенолы по характерной окраске, которую они дают с хлоридом железа (III).
Реактивы и оборудование: «жидкий» фенол, 0,1н раствор пирокатехина, 0,1н раствор хлорида железа (FeCl3), 2 пробирки.
Выполнение опыта: в первую пробирку внесите 5 капель «жидкого» фенола, во вторую пробирку 5 капель раствора пирокатехина и добавьте по 1 капле раствора хлорида железа (III). Отметьте окрас растворов.
Ход реакции:
 3C6H6OH + FeCl3 (C6H6O)3Fe + 3HCl 3C6H6OH + FeCl3 (C6H6O)3Fe + 3HCl
фенолят железа
Опыт 6. Нитрозо-реакция фенолов.
Реактивы и оборудование: «жидкий» фенол, 0,1% водный раствор нитрита натрия (NaNO2), концентрированная серная кислота (H2SO4), концентрированный гидроксид натрия (NaOH), дистиллированная вода, 3 пробирки.
Выполнение опыта: в пробирку внесите 20 капель концентрированной серной кислоты и добавьте 2 капли «жидкого» фенола. Полученный раствор охладите, и добавьте к нему каплю раствора нитрита натрия. При встряхивании смесь окрашивается в густо-зеленый цвет; при избытке нитрита натрия появляется фиолетово-синяя или пурпурная окраска.
Отлейте половину полученного раствора в пробирку с 10 мл воды, при этом образуется розово-красный раствор. Прибавьте к раствору избыток щелочи (розовая окраска раствора переходит в зеленую или синеватую), а затем подкислите раствор кислотой (раствор снова приобретает розовую окраску).
Ход реакции:
Благодаря активирующему действию гидроксигруппы, многие фенолы и их производные вступают в реакцию с азотистой кислотой, которая в присутствии сильной кислоты отщепляет воду и образует слабую электрофильную частицу –
нитрозо-катион +N=O. Первоначально продуктом реакции электрофильного замещения является п-нитрозофенол.
    HO + HNO2 HO N O + H2O HO + HNO2 HO N O + H2O
n-нитрозофенол
п-нитрозофенол легко конденсируется с избытком фенола и образует окрашенное соединение – индофенол, который легко изменяет окраску в зависимости от реакции среды с образованием хиноидных соединений.
   HO N O  ON OH ON OHO N OH   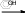 -H 2O индофенол Опыт 7. Окисление фенолов Реактивыиоборудование:«жидкий» фенол (С6 Н5 ОН), 0,1н раствор пирокатехина, 2н раствор серной кислоты (H2 SO4 ), 0,5н раствор бихромата калия (K2 Cr2 O7 ), 0,2н раствор нитрата серебра (AgNO3 ), водный раствор аммиака (NH4 OH), 1 пробирка, предметное стекло. Выполнение опыта: а) в пробирку внесите 2 капли бихромата калия и 2 капли раствора серной кислоты и добавьте при встряхивании 1 каплю «жидкого» фенола. Наблюдается переход оранжевой окраски к коричнево-зеленой. б) на предметное стекло нанесите 1 каплю нитрата серебра и 1 каплю раствора аммиака и добавьте 1 каплю раствора пирокатехина. Ход реакции: Фенолы окисляются уже при стоянии на воздухе, что объясняется повышенной, при сравнении с бензолом, электронной плотностью в цикле. Окисление фенола приводит к орто-и пара-хинонам. Значительно легче вступают в окисление с образованием соответствующих хинонов двухатомные фенолы. 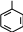  OH O
K 2Cr 2O 7, H +O пара-бензохинон  OH  Ag 2O OH O  O орто-бензохинон Вопросы для контроля.
Какие соединения называются спиртами?
Как классифицируются спирты.
Приведите примеры первичных, вторичных, третичных спиртов и объясните, чем они отличаются друг от друга.
Какое свойство проявляют спирты при реакции с хромовой кислотой?
В чем различие в строении и химических свойствах фенолов и ароматических спиртов?
Какие химические реакции свойственны одноатомным фенолам?
Какие свойства проявляет фенол в реакции с хлоридом железа (III)?
|
|
|
 Скачать 295.46 Kb.
Скачать 295.46 Kb.
 CH3 CH2 OH
CH3 CH2 OH


 CH3 C
CH3 C O
O



 3CH3 CH2 OH + K2Cr2O7 + 4H2SO4 3CH3 C + Cr2(SO4)3 + 7H2O + K2SO4
3CH3 CH2 OH + K2Cr2O7 + 4H2SO4 3CH3 C + Cr2(SO4)3 + 7H2O + K2SO4 CuSO4 + 2NaOH Cu(OH)2 + Na2SO4
CuSO4 + 2NaOH Cu(OH)2 + Na2SO4