2. АЛЬДЕГИДЫ И КЕТОНЫ
Альдегиды и кетоны – органические соединения, содержащие в молекулах
 O O
карбонильную группу (оксо-группу) и Cкарбонильных или оксосоединений. Общая формула альдегидов: R—CHOили Общая формула кетонов: R—CO—R’или поэтому относятся к классу 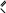 O R C .H R C R' . O Альдегиды называют по тем кислотам, в которые они превращаются при окислении. По международной номенклатуре альдегидам дается суффикс –аль(первый слог названия этого класса соединений), кетонам – суффикс –он (последние буквы названия класса).  O   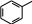  O O C    H C CH 3 C H H H
формальдегид муравьиный альдегид метаналь
ацетальдегид уксусный альдегид этаналь
бензальдегид бензойный альдегид
HO OCH 3ванилин O    C    H H H 3C C CH 3O         CH CH 2 CH 2 C CH C CH 3 Hцитраль 4-гидрокси-3-метоксибензальдегид 3,7-диметилоктадиен-2,6-аль    1 2 3 1 2 3 4    CH 3 C CH 3 CH3 O C CH   O CH3CH 3
ацетон
диметилкетон пропанон
метилизопропилкетон,
3-метилбутанон-2
Химические свойства альдегидов и кетонов определяются прежде всего электронным строением карбонильной группы, в которой происходит значительное смещение электронов двойной связи (особенно π-связи как менее прочной и легко поляризуемой по сравнению с σ-связью) в сторону атома кислорода. В результате возникают большие величины частичных зарядов (δ+ и δ-, соответственно), высокая степень поляризации связи С=О и большая величина дипольного момента этой связи.
+  - -
  R C O H R C O H
Поэтому состояние карбонильной группы можно описать двумя резонансными формами:
     C+ O- C+ O-

При действии полярных агентов связь между атомами углерода и кислорода в карбонильной группе легко переходит в простую связь с образованием биполярного иона.
Как следствие такого состояния функциональной группы, для альдегидов и кетонов характерны и наиболее легко протекают реакции нуклеофильного присоединения (AN).
Вообще для карбонильных соединений, обладающих высокой реакционной способностью, возможно протекание четырех типов реакций:
реакции нуклеофильного присоединения;
реакции замещения карбонильного кислорода (т.е. нуклеофильное присоединение с последующим элиминированием (отщеплением) воды;
реакции окисления;
реакции с участием водорода в α-положении.
Характерные реакции нуклеофильного присоединения происходят при взаимодействии альдегидов и кетонов с многими полярными агентами, в том числе с гидросульфитом натрия (NaHSO3), со спиртами и др.
В реакции с NaHSO3 образуются гидросульфитные (бисульфитные) производные – кристаллические вещества, дальнейшая обработка которых позволяет выделить альдегиды и кетоны из смеси с другими веществами.
При взаимодействии альдегидов и кетонов со спиртами образуются полуацетали и далее ацетали или полукетали и кетали.
Реакции замещения карбонильного кислорода происходят при взаимодействии с гидроксиламином (NH2OH) – образуются оксимы, при взаимодействии с гидразином, фенилгидразином и др.
Реакции окисления легко протекают для альдегидов с образованием карбоновых кислот даже при действии слабых окислителей (аммиачный раствор гидроксида серебра, гидроксид меди (II), кислород воздуха).
Кетоны не окисляются данными реагентами. Только при действии сильных окислителей (перманганат калия или дихромат калия в кислой среде) кетоны участвуют в реакциях окисления. При этом происходит разрыв углеродной цепи вблизи карбонильной группы, и образование кислоты или кислоты и кетона с меньшим числом углеродных атомов, чем в исходной молекуле кетона, т.е. происходит деструктивное окисление.
В целом реакционная способность кетонов ниже, чем альдегидов, так как карбонильная группа в молекуле кетона связана с двумя углеводородными радикалами, которые, обладая положительным индуктивным эффектом (+I), снижают частичный положительный заряд (δ+) на карбонильном углероде и уменьшают величину дипольного момента группы СО. Кроме того, наличие двух радикалов в молекуле кетона снижает доступность карбонильной группы для реагента, т.е. с учетом стерического (пространственного) фактора также объяснима пониженная реакционная способность кетонов по сравнению с альдегидами.
|
 Скачать 295.46 Kb.
Скачать 295.46 Kb. O
O O
O
 O
O

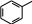
 O O C
O O C


 H C CH3 C H H H
H C CH3 C H H H

 C
C

 H H3C C
H H3C C






 CH CH2 CH2 C CH C
CH CH2 CH2 C CH C

 1 2 3 4
1 2 3 4

 CH3 C CH3 CH3 O
CH3 C CH3 CH3 O
 O CH3
O CH3







