Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
|
| Масса пробы сырьевой смеси m1, кг | Объем выделившегося газа V(CO2) = V2 – V1, м3 | Атмосферное давление P, Па | Давление насыщенного водяного пара h, Па | Давление CO2 (P-h), Па |
| | | | | |
Давление насыщенного водяного пара при температуре опыта взять из таблицы 22.
Таблица 22
Давление насыщенного водяного пара при разных условиях
| t, °С | р, Па | t, °С | р, Па | t, °С | р, Па | t, °С | р, Па |
| 15 | 1704,9 | 19 | 2197,0 | 23 | 2809,0 | 27 | 3565,0 |
| 16 | 1817,0 | 20 | 2337,8 | 24 | 2984,0 | 28 | 3780,0 |
| 17 | 1937,0 | 21 | 2486,0 | 25 | 3164,2 | 29 | 4000,0 |
| 18 | 2064,0 | 22 | 2644,0 | 26 | 3361,0 | 30 | 4245,2 |
Произведите математическую обработку полученных результатов эксперимента.
Рассчитайте массу выделившегося CO2 применив для расчета уравнение Менделеева-Клапейрона:
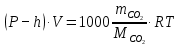 , (9.4)
, (9.4)где
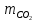 – масса выделившегося CO2, кг;
– масса выделившегося CO2, кг;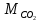 – молярная масса CO2, г/моль;
– молярная масса CO2, г/моль;R – универсальная газовая постоянная, равная 8,31 Дж/(моль∙К).

Рассчитайте массовою долю СаСО3 в образце сырьевой смеси с массой m1:
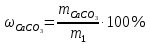 , (9.5)
, (9.5)
Результаты математической обработки занесите в таблицу 23.
Таблица 23
Результаты эксперимента
| Масса CO2, кг | Масса СаСО3, кг | Массовая доля СаСО3, % |
| | | |
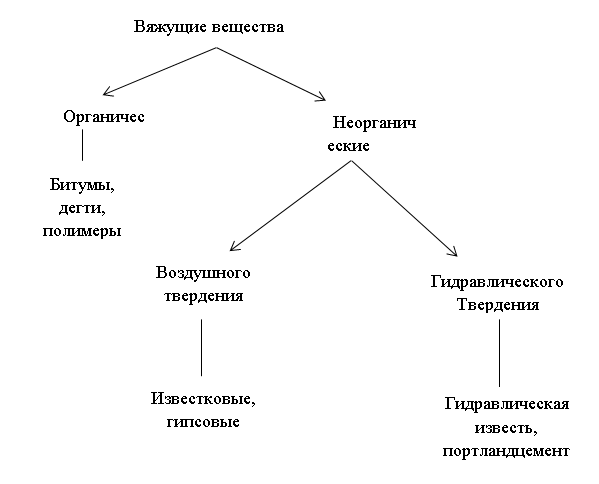
Задание 2. Гашение воздушной извести
Положите в сухую фарфоровую чашку 2 - 3 кусочка воздушной извести, осторожно смочите несколькими каплями воды и наблюдайте за происходящим. Почему выделяется пар? Отметьте знак теплового эффекта протекающей реакции. Как называется этот процесс? Какое техническое название имеет образовавшееся вещество?




Добавьте в чашку 5-6 мл воды, размешайте все стеклянной палочкой, дайте осадку отстояться. Полученный известковый раствор отфильтруйте. В пробирку с фильтратом добавьте 2-3 капли фенолфталеина и отметьте его окраску. О чем она свидетельствует? Затем через раствор окрашенного фильтрата пропустите углекислый газ. Наблюдайте за помутнением раствора с последующим растворением осадка. Как при этом изменяется окраска раствора?




Напишите уравнения реакций наблюдаемых вами процессов и объясните суть происходящего. Укажите значение данных процессов в химии вяжущих веществ.



Задание 3. Схватывание и твердение строительного гипса
Навеску строительного гипса (около 2 г) поместите в фарфоровую чашку. Налейте туда столько воды, чтобы получилась тестообразная масса. Приготовленную однородную смесь перенесите в формочку, предварительно смазанную вазелином. Через 30 минут удалите затвердевшую массу из формы. Укажите механизм твердения гипса. Напишите уравнение реакции гидратации.





Задание 4. Разложение портландцемента соляной кислотой
Приготовленную лаборантом навеску портландцемента (около 1г) поместите в фарфоровую чашку, смочите минимальным количеством воды, быстро и тщательно размешайте стеклянной палочкой. Отмерьте цилиндром 15 мл концентрированной соляной кислоты и медленно прилейте кислоту к содержимому в чашке до полного исчезновения темного цвета цемента. Вылейте в чашку 100 мл горячей воды и отфильтруйте содержимое в колбу. Фильтрат используйте для дальнейших исследований.
Напишите реакции разложения клинкерных минералов цемента соляной кислотой. Какие растворимые соединения присутствуют в получившемся фильтрате и какое соединение осталось неразложившимся на дне чашки?




Задание 5. Качественные реакции обнаружения ионов
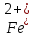 ;
; 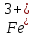 ;
; 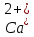 ;
; 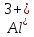
Возьмите четыре пробирки и внесите в каждую по 2 мл фильтрата, полученного в опыте 4.
Обнаружение ионов Fe2+.
В одну из пробирок добавьте красной кровяной соли K3[Fe(CN)6]. Наблюдайте синее окрашивание. Напишите уравнение реакции обнаружения Fe2+.

Обнаружение ионов Fe3+.
Во вторую пробирку добавьте роданид калия KCNS. Наблюдайте кроваво-красное окрашивание. Напишите уравнение реакции обнаружения Fe +.

Обнаружение ионов Са2+.
В третью пробирку добавьте оксалат аммония (NH4)2C204, предварительно нейтрализовав раствор гидроксидом аммония. Наблюдайте появление белого осадка. Напишите уравнение реакции.

Обнаружение ионов А13+.
В четвертой пробирке фильтрат нейтрализуйте раствором щелочи, затем добавьте 0,2 мл аскорбиновой кислоты или трилона «Б» и 1 мл алюминона. Появление красной окраски свидетельствует о наличии в растворе ионов AI3+.
По катионам металлов, обнаруженным при выполнении опыта, запишите формулы оксидов, входящих в состав клинкера портландцемента. На основании выполненного эксперимента представьте основные оксиды, входящие в состав клинкера.






Задание 6. Коррозия цементного камня в агрессивных средах
Под коррозией цементного камня понимают его разрушение в результате взаимодействия с различными реагентами.
Вариант рабочего задания выбрать по последней цифре зачетной книжки.
Таблица 24
Влияние состава среды на коррозию цементного камня
| № варианта | Среда | pH водяной вытяжки | Вид коррозии |
| 1 | H2O | | |
| 2 | HCl | | |
| 3 | CH3COOH | | |
| 4 | H2CO3 | | |
| 5 | H2SO4 | | |
| 6 | NH4NO3 | | |
| 7 | MgCl2 | | |
В стаканчик налейте 50 мл раствора реагента, отвечающего варианту рабочего задания. Туда же внесите взвешенные на технических весах 2 г молотого цементного камня. Тщательно перемешайте суспензию стеклянной палочкой и оставьте стоять 40 минут, периодически перемешивая.
В рабочей тетради запишите минеральный состав цементного камня и реакции гидратации минералов клинкера портландцемента .
Раствор над осадком представляет собой водную вытяжку цементного камня. Через 40 минут измерьте pH раствора, не отделяя его от твердой фазы (за 2...3 минуты до измерения pH прекратите перемешивание). Изменился ли pH вытяжки по сравнению с pH исходного реагента (все реагенты, указанные в таблице 24, имеют pH < 7, pH воды 7).





Выводы
Укажите сущность процессов, лежащих в основе твердения воздушных и гидравлических вяжущих веществ.
Назовите основные виды коррозии цементного камня.







Домашнее задание
Задание 1. Как можно осуществить превращения:
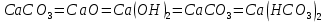 ?
?Напишите уравнения реакций.




Задание 2. Приведите химическую реакцию, лежащую в основе процесса твердения строительного гипса.





Задание 3. Зная минеральный состав цементного камня, напишите возможные химические реакции между составляющими цементного камня и кислотами соляной и угольной.




Задание 4. С какой составляющей цементного камня могут взаимодействовать MgCl2 и NH4NO3? Напишите уравнения реакций.




Задание 5. 10 г технического мела прокалили при температуре 1200 ˚C до постоянной массы. При этом выделилось 2120 см3 CO2, измеренного при нормальных условиях. Вычислите массовую долу (%) CaCO3 в меле (ответ 94,6 %).

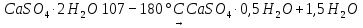 (9.1)
(9.1)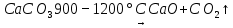 (9.2)
(9.2)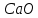 . В обожженной извести наряду с
. В обожженной извести наряду с 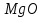 содержится
содержится 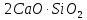 ,
, 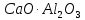 и
и 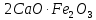 , образовавшиеся в присутствии глинистых примесей в исходном сырье. При содержании глинистых примесей в обжигаемой породе менее 6% получается воздушная известь, а при большем их содержании – гидравлическая известь.
, образовавшиеся в присутствии глинистых примесей в исходном сырье. При содержании глинистых примесей в обжигаемой породе менее 6% получается воздушная известь, а при большем их содержании – гидравлическая известь.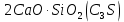 ,
,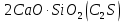 ,
,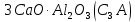 ,
,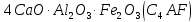 .
.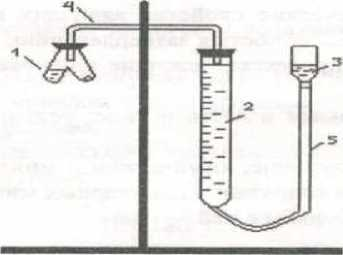 Рис. 8 Установка для улавливания и измерения объема CO2
Рис. 8 Установка для улавливания и измерения объема CO2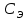 = 2 моль/л. Соедините реакционный сосуд с помощью пробок и трубки (4) с бюреткой (2) и проверьте прибор на герметичность. Для этого опустите уравнительный сосуд (3) таким образом, чтобы уровень жидкости в нем был ниже уровня жидкости в бюретке. Если в течение 1-2 минут уровень жидкости в бюретке не изменится, прибор герметичен. Установите уравнительный сосуд таким образом, чтобы жидкость в нем была на одном уровне с жидкостью в бюретке (5). Затем, наклонив реакционный сосуд, вылейте кислоту из одного колена в другое, не нарушая герметичности установки. Наблюдайте выделение углекислого газа по реакции
= 2 моль/л. Соедините реакционный сосуд с помощью пробок и трубки (4) с бюреткой (2) и проверьте прибор на герметичность. Для этого опустите уравнительный сосуд (3) таким образом, чтобы уровень жидкости в нем был ниже уровня жидкости в бюретке. Если в течение 1-2 минут уровень жидкости в бюретке не изменится, прибор герметичен. Установите уравнительный сосуд таким образом, чтобы жидкость в нем была на одном уровне с жидкостью в бюретке (5). Затем, наклонив реакционный сосуд, вылейте кислоту из одного колена в другое, не нарушая герметичности установки. Наблюдайте выделение углекислого газа по реакции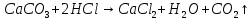 (9.3)
(9.3)