Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
1 мл) оба золя AgJ. Отметьте увеличение мутности системы в результате взаимной коагуляции разноимённо заряженных золей AgJ. Определите знак заряда коллоидных частиц AgI экспериментально. Для этого возьмите два листка фильтровальной бумаги и нанесите на них по капле золя AgJ. Бумага, как некоторые другие вещества, при погружении в воду заряжается отрицательно. Положительно заряженный золь AgJ на бумаге расслаивается, а отрицательно заряженный не расслаивается.Работа 7. ГЕТЕРОГЕННЫЕ ДИСПЕРСНЫЕ СИСТЕМЫЦель работы Изучить классификацию, методы получения и характерные свойства гетерогенных дисперсных систем. Установить причины устойчивости и условия коагуляции коллоидных систем. Теоретические сведения Гетерогенными называются системы, состоящие из двух (или более) веществ, в которых дисперсная фаза распределена в непрерывной дисперсионной среде. В отличие от истинных растворов (молекулярных и ионных), являющихся однофазными, равновесными, термодинамически устойчивыми, гетерогенные дисперсные системы (двух- и более фазные) принципиально неустойчивы, однако некоторые из них длительное время могут сохранять устойчивость и не разрушаться. Причиной принципиальной неустойчивости гетерогенных дисперсных систем (ГДС) является большая свободная поверхностная энергия: 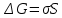 , ,где 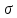 – удельная свободная поверхностная энергия, называемая поверхностным натяжением на границе раздела: жидкость – газ; – удельная свободная поверхностная энергия, называемая поверхностным натяжением на границе раздела: жидкость – газ;S- общая площадь поверхности всех частиц дисперсной фазы. Свободная поверхностная энергия самопроизвольно стремится к уменьшению. Если это происходит за счёт уменьшения площади поверхности частиц дисперсной фазы (слипание частиц), то ГДС уменьшается. С другой стороны, уменьшение  за счёт уменьшения поверхностного натяжения приводит к стабилизации ГДС. Это наблюдается за счёт самопроизвольного процесса адсорбции ионов и молекул на границе раздела фаз. Адсорбция – преимущественное концентрирование веществ в поверхностном слое по сравнению с объемом. Вещества, снижающие свободную поверхностную энергию за счёт адсорбции, называются поверхностно-активными (ПАВ). за счёт уменьшения поверхностного натяжения приводит к стабилизации ГДС. Это наблюдается за счёт самопроизвольного процесса адсорбции ионов и молекул на границе раздела фаз. Адсорбция – преимущественное концентрирование веществ в поверхностном слое по сравнению с объемом. Вещества, снижающие свободную поверхностную энергию за счёт адсорбции, называются поверхностно-активными (ПАВ). Органические ПАВ имеют дифильное строение: их молекулы содержат полярные группы (-OH, -COONa, -NH2 и др.) и достаточно большой углеводородный радикал, как показано на рисунке 5. 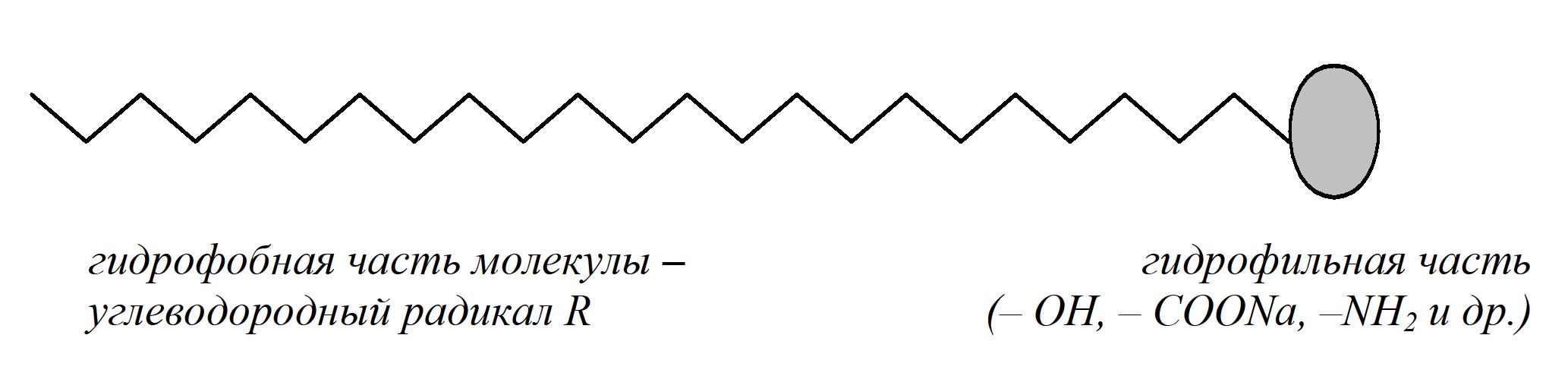 Рис. 5 Схема строения молекулы поверхностно-активного вещества Адсорбция ПАВ влияет на смачивание твёрдой поверхности жидкостью. ПАВ, имеющие в своём составе гидрофильные и гидрофобные группы распологаются на межфазной поверхности в соответствии с правилом уравнивания полярностей, таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная часть – к неполярной (рис. 6). 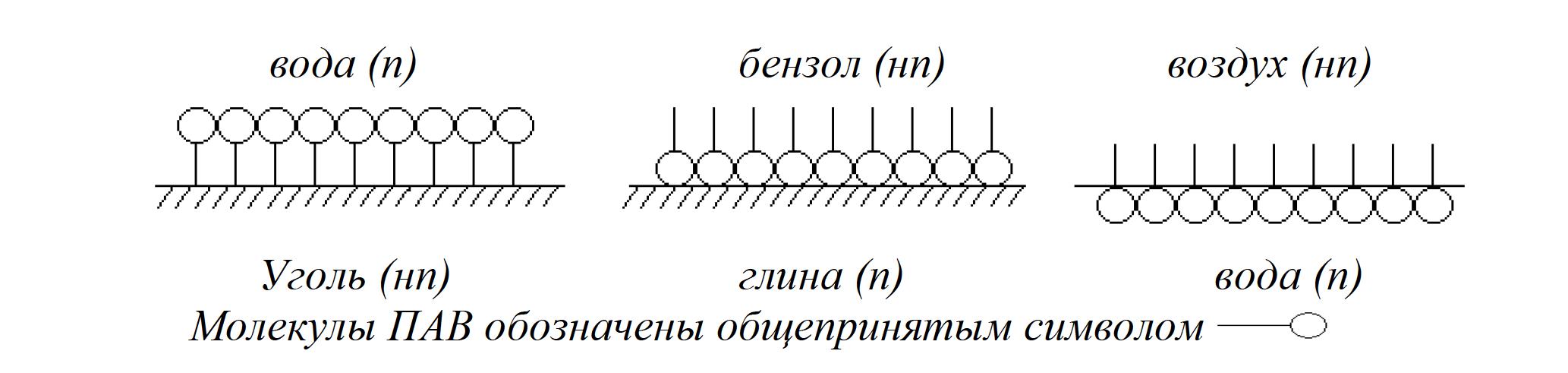 Рис. 6 Схема адсорбции ПАВ на полярной (п) и неполярной (нп) поверхности Все полярные гидрофильные поверхности должны хорошо адсорбировать ПАВ из неполярных или слабополярных жидкостей и наоборот. Рабочее задание Задание 1. Получение и стабилизация суспензии мела в воде Налейте в две пробирки до половины объёма воды. В одну из них добавьте 1 мл раствора желатина (ω = 0,1%). В обе пробирки внесите на кончике шпателя растёртый в порошок мел, сильно встряхните, поставьте пробирки в штатив и следите за расслаиванием суспензии. Сравните время расслаивания суспензий и роль высокомолекулярного вещества желатина.    Задание 2. Получение и стабилизация эмульсии масла в воде Возьмите две пробирки. В одну из них налейте |
| Номер опыта | Дисперсная фаза | Дисперсионная среда | Название системы | Метод получения | стабилизатор | Фактор устойчивости |
| 1 | | | | | | |
| 2 | | | | | | |
| 3 Избыток KJ | | | | | | |
| 3 Избыток AgNO3 | |
Задание 4. Получение золя гидроксида железа (III)
Золь
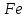 получите по реакции гидролиза хлорида железа (Ш). Для этого нагрейте в колбе до кипения 20 мл дистиллированной воды и медленно прибавьте 25-30 капель раствора
получите по реакции гидролиза хлорида железа (Ш). Для этого нагрейте в колбе до кипения 20 мл дистиллированной воды и медленно прибавьте 25-30 капель раствора 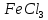 , прокипятите 1-2 минуты. Обратите внимание на изменение цвета раствора.
, прокипятите 1-2 минуты. Обратите внимание на изменение цвета раствора.Напишите уравнение гидролиза
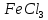 в молекулярной, ионно-молекулярной формах.
в молекулярной, ионно-молекулярной формах.



Схематично представьте коллоидную частицу и мицеллу
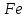 , графически изобразите её. Отметьте составные части мицеллы, границы возникновения общего термодинамического потенциала и ζ-потенциала.
, графически изобразите её. Отметьте составные части мицеллы, границы возникновения общего термодинамического потенциала и ζ-потенциала.Задание 5. Коагуляция коллоидного раствора Fe(OH)3
В три пробирки налейте по 1-2 мл золя
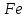 . По каплям (считая их) прибавьте растворы, имеющие одинаковую молярную концентрацию: в первую пробирку - NaCl, во вторую - Na2SO4. Оцените пороги коагуляции электролитов-коагулянтов числом капель их растворов, добавленных к золю
. По каплям (считая их) прибавьте растворы, имеющие одинаковую молярную концентрацию: в первую пробирку - NaCl, во вторую - Na2SO4. Оцените пороги коагуляции электролитов-коагулянтов числом капель их растворов, добавленных к золю 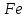 до помутнения.
до помутнения.


Рассмотрите строение двойного электрического слоя и механизм коагуляции золя электролитом.
Назовите ионы-коагуляторы. У какого иона коагулирующая способность выше и как это связано с зарядом коагулирующего иона? Какая связь существует между электрокинетическим потенциалом и агрегативной устойчивостью коллоидных систем?




Задание 6. Получение геля кремниевой кислоты
Налейте в пробирку по 2 мл концентрированных растворов соляной кислоты и силиката натрия.
Нагрейте содержимое пробирки и наблюдайте образование геля кремниевой кислоты.
Приведите уравнение реакции взаимодействия соляной кислоты с силикатом натрия в молекулярной и ионно-молекулярной формах. Составьте формулу мицеллы кремниевой кислоты с отрицательным зарядом коллоидных частиц. Отметьте роль концентрации растворов и нагревания при образовании геля. Какие коллоидные системы называют золями, а какие - гелями?





Задание 7. Адсорбция при коагуляции
К коллоидному раствору гидроксида железа (III) добавьте несколько капель раствора-красителя и перемешайте стеклянной палочкой. Добавьте несколько капель раствора
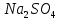 и наблюдайте явную коагуляцию.
и наблюдайте явную коагуляцию.Обратите внимание на окраску золя, образующегося осадка и жидкости над осадком. Объясните наблюдаемые явления.





Выводы
Сформулируйте и запишите причину принципиальной неустойчивости гетерогенных дисперсных систем.
Перечислите основные факторы агрегативной устойчивости коллоидных систем.
Опишите условия коагуляции коллоидных растворов.






Домашнее задание
Задание 1. Образование золя сульфата бария происходит в результате взаимодействия хлорида бария и сульфата магния:
Напишите уравнение реакции в молекулярной и ионно-молекулярной форме;
Составьте формулы мицелл сульфата бария, отвечающих избытку хлорида бария (в одном случае) и избытку сульфата магния (во втором случае);
Рассмотрите строение мицеллы: укажите ядро мицеллы, потенциалопределяющие ионы, противоионы адсорбционного и диффузного слоя; определите границы коллоидной частицы и знак ζ-потенциала;
Среди приведенных электролитов – NaCl, Na2SO4, CaCl2, AlCl3, Na3PO4 – укажите наиболее эффективные для коагуляции положительно и отрицательно заряженных золей BaSO4; назовите ионы-коагуляторы.
Расположите электролиты-коагуляторы в порядке возрастания их порогов коагуляции.












Задание 2. Удаление отрицательно заряженных коллоидных примесей из природных вод осуществляется введением коагулянта Al2(SO4)3, который подвергается гидролизу, образуя положительно-заряженный золь Al(OH)3:
Напишите уравнение полного гидролиза сульфата алюминия;
Составьте мицеллу гидроксида алюминия и укажите ее составные чатси: ядро, потенциалопределяющие ионы, противоионы, коллоидную частицу и границу возникновения дзета-потенциала.






Задание 3. Изобразите графически стабилизацию эмульсий типа «масло-вода» и «вода-масло» поверхностно-активным веществом C17H35COONa. (молекулы ПАВ обозначьте общепринятым символом —○).

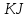 (
(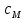 = 0,05 моль/л) и медленно при встряхивании добавьте 3-4 капли раствора
= 0,05 моль/л) и медленно при встряхивании добавьте 3-4 капли раствора 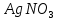 (
(