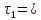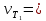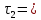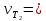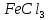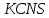Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 5. ОПРЕДЕЛЕНИЕ НАПРАВЛЕННОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕЦель работы Решить вопрос о возможности протекания и направленности химической реакции при стандартных условиях. Изучить факторы, влияющие на скорость химической реакции. Рассмотреть влияние внешних условий на смещение химического равновесия. Теоретические сведения В качестве критерия возможности протекания процесса в неизолированной термодинамической системе, характеризующейся постоянным давлением и температурой, выступает изменение изобарно-изотермического потенциала (энергии Гиббса): ΔrG. В соответствии со вторым законом термодинамики для самопроизвольного течения процесса является неравенство ΔrG < 0. Для определения направления процесса в системе достаточно рассчитать эту величину: 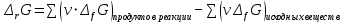 , (5.1) , (5.1)где ΔfG – потенциал образования соединения, ν – стехиометрический коэффициент в реакции. ΔrG можно рассчитывать не только через потенциалы образования, но и через энтальпии образования (ΔfH) и энтропии (S) соответствующих веществ Расчет ведут по формуле 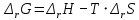 , (5.2) , (5.2)Где 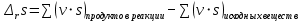 , (5.3) , (5.3)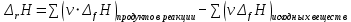 , (5.4) , (5.4)T – температура, К. Потенциал образования, энтропия для стандартных условий обозначаются соответственно ΔfG˚298, ΔfH˚298, S˚298 (или кратко ΔfG˚, ΔfH˚, S˚) и даются в справочных таблицах . Если окажется, что в данных условиях ΔrG < 0, то возможно протекание процесса в прямом направлении, если же ΔrG > 0, то в данных условиях возможен лишь обратный процесс, при ΔrG = 0, система находится в состоянии термодинамического равновесия. Изменение энергии Гиббса отвечает на вопрос о принципиальной возможности или невозможности протекания процесса в данных условиях, но ничего не сообщат о скорости, с которой идет реакция. Скорость реакции изучает химическая кинетика. Основные факторы, влияющие на скорость химических реакций: природа и концентрация реагирующих веществ, температура, присутствие катализатора. Химическую реакцию, протекающую в гомогенной системе, можно представить в общем виде: aA + bB → dD + eE, где A и B – исходные вещества, D и E – продукты реакции, a, b, c, d, e – стехиометрические коэффициенты. В соответствии с законом действующих масс при постоянной температуре скорость химических реакций пропорциональна произведению концентрации реагирующих веществ. Если данную реакцию считать элементарной, т.е. протекающей в одну стадию, то математически закон действующих масс выражается через кинетическое уравнение реакции следующего вида: 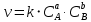 где k – константа скорости реакции, зависит от природы реагирующих веществ и температуры; 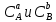 – концентрации реагирующих веществ, взятые в степенях, равных стехиометрическим коэффициентам. – концентрации реагирующих веществ, взятые в степенях, равных стехиометрическим коэффициентам.Если процесс протекает в гетерогенной системе, то в кинетическое уравнение входят концентрации веществ, находящихся только в жидкой или газовых фазах. С повышением температуры возрастает число активных (реакционноспособных) частиц и скорость реакции увеличивается. По правилу Вант-Гоффа при изменении температуры на каждые 10˚ скорость химической реакции изменяется в 2-4 раза. 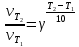 (5.5) (5.5)где 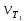 и и 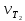 – скорость реакции при температурах T1 и T2; – скорость реакции при температурах T1 и T2;γ – температурный коэффициент скорости реакции. Химические реакции могут быть обратимыми и необратимыми. Обратимые реакции протекают как в прямом, так и в обратном направлениях. При равенстве скоростей прямой и обратной реакций наступает состояние химического равновесия. При изменении внешних условий (концентрации, температуры, давления) изменяются скорости реакций и происходит смещение равновесия. Согласно принципу Ле Шателье: если на систему, находящуюся в состоянии равновесия, воздействовать извне, то в системе происходят процессы, противодействующие данному изменению, то есть ослабляющие его воздействие. Повышение концентрации исходных веществ увеличивает скорость прямой реакции и равновесие смещается вправо, то есть увеличивается концентрация продуктов реакции при наступлении нового состояния равновесия. При нагревании системы равновесие смещается в сторону процесса, идущего с поглощением теплоты (процесса, идущего с выделением теплоты). Увеличение внешнего давления смещает равновесие в сторону образования меньшего числа моль газообразных веществ; уменьшение – в сторону большего числа моль газообразных веществ. Рабочее задание Задание 1. Зависимость скорости реакции от концентрации реагирующих веществ Докажите возможность протекания процесса 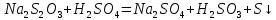 при стандартной температуре (температуре близкой к комнатной). Согласно теории электролитической диссоциации уравнение можно представить в полном и кратком молекулярно-ионном виде соответственно следующим образом: 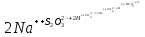 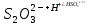 Рассчитайте 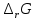 , воспользовавшись формулой (5.2), и сделайте вывод о возможности протекания процесса. Термодинамические характеристики, необходимые для расчета, приведены в таблице 9. , воспользовавшись формулой (5.2), и сделайте вывод о возможности протекания процесса. Термодинамические характеристики, необходимые для расчета, приведены в таблице 9.Таблица 9 Значения термодинамических параметров
   Убедившись в принципиальной возможности протекания процесса взаимодействия тиосульфата натрия с серной кислотой, изучите влияние концентрации тиосульфата ( 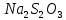 ) на скорость химической реакции. ) на скорость химической реакции.Признаком протекания реакции является помутнение раствора вследствие выделения серы.    В штативе закреплены три бюретки, в которых налиты: в одну раствор 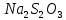 , в другую раствор , в другую раствор 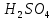 , в третью дистиллированная вода. Приведите бюретки в рабочее состояние, установив уровень жидкости в них на определённом целом делении. , в третью дистиллированная вода. Приведите бюретки в рабочее состояние, установив уровень жидкости в них на определённом целом делении.Опыты проводятся в соответствии с таблицей 10. Таблица 10 Зависимость скорости реакции от концентрации реагирующих веществ
В три пробирки из бюретки налейте соответственно 1, 2, 3 мл раствора тиосульфата натрия, затем в первую пробирку добавьте 2 мл дистиллированной воды, во вторую – 1 мл, в третью воды не добавляйте. Таким образом, имеем три раствора с увеличивающейся концентрацией 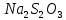 . .Заметив время, в первую пробирку прилейте 1 мл раствора серной кислоты, содержимое перемешайте и, наблюдая на темном фоне в проходящем свете, отметьте время помутнения раствора. Время (с), прошедшее от момента добавления кислоты (начало реакции) до помутнения, внесите в таблицу. Содержимое пробирки вылейте и пробирку вымойте водой. Аналогично выполните опыт со второй и третьей пробирками. Рассчитайте относительную скорость реакции ( 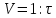 , с-1) и представьте результаты эксперимента в виде графика, отложив по абсциссе объем раствора тиосульфата (концентрация), по ординате - относительную скорость реакции. , с-1) и представьте результаты эксперимента в виде графика, отложив по абсциссе объем раствора тиосульфата (концентрация), по ординате - относительную скорость реакции.Сделайте вывод о влиянии концентрации реагирующих веществ на скорость химической реакции.       Задание 2. Влияние температуры на скорость химической реакции Зависимость скорости реакции от температуры изучите также на примере взаимодействия тиосульфата натрия с серной кислотой. Объёмы растворов возьмите такие же, как в первой пробирке предыдущего опыта. В стакан с водой комнатной температуры ( 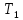 ) поместите исходные растворы в пробирках. Приготовьте водяную баню с температурой на 20 °С выше ( ) поместите исходные растворы в пробирках. Приготовьте водяную баню с температурой на 20 °С выше (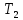 ) и выдержите в ней исходные растворы 5-7 минут. Проведите реакции и рассчитайте относительную скорость. Результаты внесите в таблицу 11. ) и выдержите в ней исходные растворы 5-7 минут. Проведите реакции и рассчитайте относительную скорость. Результаты внесите в таблицу 11.По правилу Вант-Гоффа рассчитайте экспериментальное значение температурного коэффициента и, сравнив его с теоретическим значением, оцените точность эксперимента.    Таблица 11 Зависимость скорости реакции от температуры
   Задание 3. Влияние изменения концентрации реагирующих веществ на смещение химического равновесия Реакция между хлоридом железа (III) и роданидом калия идет с образованием окрашенного в интенсивно красный цвет роданида железа (III) и является обратимой: 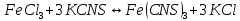 красный цвет Таблица 12 Смещение химического равновесия
В пробирку, на три четверти заполненную дистиллированной водой, внесите по 3-4 капли растворов хлорида железа и роданида калия. Содержимое перемешайте и разделите на четыре пробирки. Добавьте в первую пробирку 2-3 капли раствора 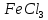 , во вторую – столько же раствора KCNS, в третью - на кончике шпателя , во вторую – столько же раствора KCNS, в третью - на кончике шпателя 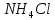 , четвертая пробирка остается для сравнения. Данные наблюдений внесите в таблицу 12. , четвертая пробирка остается для сравнения. Данные наблюдений внесите в таблицу 12.Каким изменением состояния отвечает равновесная система на увеличение концентрации: а) исходных веществ, б) продуктов реакции? Соответствует ли это принципу Ле Шателье?    Скорость какого процесса: прямого или обратного - увеличивается при увеличении концентрации: а) исходных веществ; б) продуктов реакции?     Является ли это противодействием на внешнее воздействие?    Задание 4. Влияние температуры на смещение химического равновесия Все химические реакции сопровождаются образованием новых веществ, т.е. изменением природы участников реакции, а потому либо выделением теплоты ( 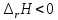 – реакция экзотермическая), либо поглощением теплоты ( – реакция экзотермическая), либо поглощением теплоты (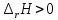 – реакция эндотермическая). Если прямая реакция идет с выделением теплоты, то обратная - с поглощением. – реакция эндотермическая). Если прямая реакция идет с выделением теплоты, то обратная - с поглощением.В пробирку налейте 2-3 мл раствора крахмала и добавьте несколько капель раствора йода. Наблюдайте образование соединения синего цвета. При нагревании пробирки окраска раствора исчезает, а при охлаждении - появляется. Таким образом, наблюдается смещение равновесия Охлаждение извне  . .Нагревание извне Используя принцип Ле Шателье, определите, с выделением или поглощением теплоты идет прямая реакция. Укажите, в сторону какого процесса (экзотермического или эндотермического) смещается химическое равновесие: а) при повышении температуры, б) при понижении температуры.     Задание 5. Влияние давления на химическое равновесие Рассчитайте теоретически, как изменится состояние равновесия в гомогенной системе 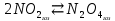 , ,если общее давление над системой увеличить в 3 раза? Расчет проведите, воспользовавшись кинетическими уравнениями прямой и обратной реакций.    Выводы Укажите, какая термодинамическая функция является критерием самопроизвольного протекания изобарно-изотермического процесса и как она изменяется при этом? Опишите, как изученные экспериментально факторы влияют на скорость гомогенной реакции. Объясните смещение химического равновесия при изменении концентрации веществ, температуры, давления на основе принципа Ле Шателье.       Домашнее задание Задание 1. Если в реакцию вступит 2,24 л аммиака измеренных при н.у.: 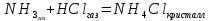 , то ____________ теплоты , то ____________ теплоты○ 1) поглотится 17,7 кДж ○ 2) выделится 17,7 кДж ○ 3) поглотится 3,54 кДж ○ 4) выделится 3,54 кДж Ответ подтвердите расчетом.  Вещество: NH3 HCl NH4Cl 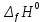 , кДж/моль -46 -92 -315 , кДж/моль -46 -92 -315   Задание 2. Изменение энергии Гиббса химического процесса 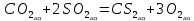 равно: равно:○ 1) –754,5 кДж ○ 2) 754,5 кДж ○ 3) 984,5 кДж ○ 4) 480 кДж Ответ подтвердите расчетом и укажите, в каком направлении (прямом или обратном) возможно его самопроизвольное протекание в стандартных изобарно-изотермических условиях.  Вещество: CO2 SO2 CS2 O2 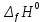 , кДж/моль -394 -296 -115 0 , кДж/моль -394 -296 -115 0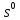 , Дж/(моль∙К) 214 248 238 205 , Дж/(моль∙К) 214 248 238 205    Задание 3. Для увеличения скорости обратной реакции в 16 раз 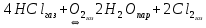 парциальные давления продуктов реакции следует увеличить в ______ раз парциальные давления продуктов реакции следует увеличить в ______ раз○ 1) 16 ○ 2) 8 ○ 3) 4 ○ 4) 2 Запишите кинетические уравнения прямого и обратного процесса и обратного процесса и подтвердите ответ расчетом.   Задание 4. Если скорость реакции увеличилась в 27 раз при повышении температуры на 30 ˚C, то температурный коэффициент скорости равен ○ 1) 9 ○ 2) 3 ○ 3) 2 ○ 4) 2,7 Ответ подтвердите расчетом и сформулируйте правило Вант Гоффа.     Задание 5. Если образец цинка растворяется в серной кислоте при 25 ˚C за 16 минут, а при 45 ˚C за 4 минуты, то температурный коэффициент равен ○ 1) 4 ○ 2) 2 ○ 3) 3 ○ 4) 2,5 Ответ подтвердите расчетом.     Задание 6. Равновесие в системе 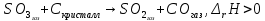 сместится в сторону продуктов реакции сместится в сторону продуктов реакцииПри увеличении продуктов реакции При увеличении парциального давления CO При уменьшении общего давления При уменьшении концентрации SO3 Напишите выражение для константы химического равновесия данной системы и объясните, что она характеризует.     | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

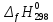 , кДж/моль
, кДж/моль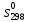 , Дж/(моль∙К)
, Дж/(моль∙К)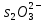
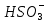
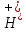
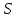
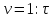 , с-1
, с-1