Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 3. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙЦель работы Усвоить классификацию неорганических соединений. Познакомиться с химическими свойствами оксидов, гидроксидов и солей. Установить характер взаимодействия и генетическую связь между важнейшими классами неорганических веществ. Теоретические сведения Важнейшими классами сложных неорганических веществ являются оксиды, гидроксиды, кислоты и соли. Оксиды — это соединения двух элементов, один из которых кислород. Общая формула оксидов ЭхОу, где х - число атомов элемента, у - число атомов кислорода. Оксиды бывают несолеобразующие (SiO, CO, N2O, NO) и солеобразующие. Последние делятся на основные, кислотные, амфотерные. Основными называются оксиды, которым соответствуют основные гидроксиды (основания). Например, №2О, CaO, MnO являются основными оксидами, так как им соответствуют основания NaOH, Ca(OH)2, Mn(OH)2. Основные оксиды образуют металлы со степенью окисления +1, +2 (кроме Be, Zn, Sn). Кислотными называются оксиды, которым соответствуют кислоты. Например, CO2, P2O5, Mn2O7 - кислотные оксиды, так как им соответствуют кислоты H2CO3, H3PO4, HMnO4. Такие оксиды образуют все неметаллы и металлы, имеющие степень окисления +5, +6, +7. Например, оксиды CO2 и P2O5 образованы неметаллами - углеродом и фосфором, а оксид Mn2O7 - металлом марганцем, проявляющим степень окисления +7. Амфотерными называются оксиды, которые в зависимости от условий проявляют основные или кислотные свойства, то есть обладают двойственным характером. К ним относятся оксиды металлов со степенью окисления +3, +4 – Al2O3, Fe2O3, MnO2 и др., а также BeO, ZnO, SnO. Основания – сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксильных групп -ОН. Общая формула оснований Ме(ОН)n ,где n - число гидроксильных групп, равное степени окисления металла. Например: NaOH, Ca(OH)2, Ni(OH)2 . Если в состав молекулы основания входит одна группа -ОН, то оно называется однокислотным, если две группы - двухкислотным и т.д. Если от молекулы основания мысленно отнять одну или несколько гидроксильных групп, то оставшаяся часть молекулы называется остатком основания. Валентность основного остатка определяется числом гидроксильных групп, замещенных в молекуле основания на кислотный остаток. Кислоты – сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на металл, и кислотного остатка (табл. 4). Валентность кислотного остатка определяется числом замещенных атомов водорода в молекуле кислоты на основной остаток. Таблица 4 Название некоторых кислот и их средних остатков
Если в состав молекулы кислоты входит один атом водорода, она называется одноосновной (HCl, HNO3, HBr), если два и более - многоосновной (H2SO4, H3PO4 и др.). Амфотерные гидроксиды - сложные вещества, которые проявляют свойства, как кислот, так и оснований. Поэтому формулы амфотерных гидроксидов можно записать как в форме оснований, так и в форме кислот. Zn(OH)2 ↔ H2ZnO2 основание цинковая кислота Al(OH)3 ↔ H3AlO3 ↔ HAlO2 + H2O основание ортоалюминиевая кислота металюминиевая кислота Cr(OH)3 ↔ H3CrO3 ↔ HCrO2 ↔ HCrO2 + H2O основание ортохромистая кислота метахромистая кислота Соли - сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металла или гидроксильных групп в молекулах оснований кислотными остатками. При полном замещении атомов Н или групп ОН- образуются средние соли: 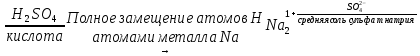  При неполном замещении атомов водорода в молекулах многоосновных кислот атомами металла образуются кислые соли: 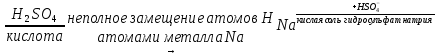 Двухосновная кислота с любым металлом образует одну среднюю и одну кислую соль. Например, кислота H2SO3 образует с основанием NaOH соли Na2SO3 и NaHSO3. Трехосновная кислота с любым металлом дает одну среднюю и две кислые соли. Например, H3PO4 образует с NaOH три соли – Na3PO4, Na2HPO4 и NaH2PO4. Одноосновные кислоты кислых солей не образуют. Название кислой соли имеет приставку гидро-, указывающую на наличие незамещенных атомов водорода; если таких атомов два или больше, то их число обозначается греческими числительными (ди-, три- и т.д.) Например, Na2HPO4 называется гидрофосфатом натрия, а NaH2PO4 – дигидрофосфатом натрия. При неполном замещении гидроксильных групп в молекулах многокислотных оснований кислотными остатками образуются основные соли:  Двухкислотное основание дает одну среднюю и одну основную соль с данным кислотным остатком. Например, основание Mg(OH)2 образует с кислотной HCl соли MgCl2 и MgOHCl. Трехкислотное основание дает одну среднюю и две основные соли. Например, Al(OH)3 образует с HCl соли AlCl3, AlOHCl2, Al(OH)2Cl. Однокислотные основания основных солей не образуют. Название основной гидроксильных групп. Напрмер, AlOHCl2 называется гидроксохлоридом алюминия, Al(OH)2Cl – дигидроксохлоридом алюминия. Рабочее задание Задание 1. Изучение свойств основных оксидов. Установите окраску универсального индикатора в различных средах. В три пробирки налейте по 3-4 мл воды (нейтральная среда) и добавьте по капле универсального индикатора, а затем в одну пробирку добавьте каплю кислоты, а в другую – каплю щелочи. Запишите в таблицу 5 наблюдаемую окраску. Таблица 5 Окраска универсального индикатора в различных средах
В две пробирки налейте 1-2 мл воды и добавьте 2-3 капли универсального индикатора. В одну пробирку на кончике шпателя внесите оксид кальция CaO, а в другую – оксид меди CuO. Встряхните содержимое пробирок. Отметьте наблюдаемые явления, имея в виду, что универсальный индикатор имеет в слабых кислотах желтую окраску. Напишите уравнение наблюдаемой реакции. Сделайте заключение о растворимости основных оксидов в воде.     В две пробирки внесите на кончике шпателя небольшое количество оксида меди. Прилейте в одну из пробирок 1 - 2 мл серной кислоты H2SO4, а в другую - такой же объем гидроксида натрия NaOH. Содержимое пробирок слегка подогрейте. Отметьте протекание реакции только в одной из пробирок. Напишите ее уравнение. Охарактеризуйте химические свойства основных оксидов.     Задание 2. Изучение свойств кислотных оксидов Получите оксид углерода (IV) - углекислый газ. Для этого в пробирку с газоотводной трубкой поместите 2-3 кусочка мрамора (CaCO3) и добавьте к ним небольшой объем концентрированной соляной кислоты. Выделяющийся газ последовательно пропустите через заранее приготовленные пробирки: с водой, содержащей универсальный индикатор; с насыщенным раствором гидроксида кальция Ca(OH)2; с разбавленным раствором серной кислоты. Отметьте наблюдаемые явления. Запишите уравнения реакций. Охарактеризуйте химические свойства кислотных оксидов.       Задание 3. Получение и изучение свойств гидроксидов В две пробирки налейте по 0,5-1 мл сульфата меди CuSO4 и сульфата цинка ZnSO4 соответственно. Добавьте в каждую из пробирок несколько капель гидроксида натрия. Наблюдайте образование голубого аморфного осадка Cu(OH)2 и белого осадка Zn(OH)2. Напишите уравнения реакций их получения. Можно ли получить гидроксиды меди и цинка взаимодействием соответствующих оксидов с водой? Почему?      Разделите каждый из осадков на две части: к одной прибавьте 0,5-1 мл серной кислоты, к другой - столько же щелочи NaOH. В каких случаях произошло растворение осадков? Напишите уравнения наблюдаемых реакций. Укажите, каким способом могут быть получены нерастворимые в воде основания. Сделайте вывод о характере гидроксидов меди и цинка.      Задание 4. Составление уравнений реакций получения солей Пример. Составьте возможные уравнения реакций получения средней соли карбоната магния MgCO3, а также соответствующих ей кислой и основной соли. Для получения указанных солей могут быть использованы следующие соединения: Кислота — H2CO3, Основание — Mg(OH)2, Кислотный оксид — CO2, Основный оксид — MgO. Составим возможные уравнения реакций получения MgCO3, помня что могут взаимодействовать только вещества различного характера: CO2 + MgO → MgCO3; кислотный оксид основный оксид средняя соль – карбонат магния CO2 + Mg(OH)2 → MgCO3 + H2O; кислотный оксид основание H2CO3 + MgO → MgCO3 + H2O; кислота основный оксид H2CO3 + Mg(OH)2 → MgCO3 + 2H2O. кислота основание Так как Mg(OH)2 является двухкислотным основанием, то пир его взаимодействии с H2CO3 может быть получена основная соль. Для этого основание должно быть взято в избытке: H2CO3 + 2Mg(OH)2 → (MgOH)2CO3 + 2H2O Кислота основание гидроксокарбонат магния Так как H2CO3 является двухосновной кислотой, при ее взаимодействии с Mg(OH)2 может быть получена кислая соль. Для этого в избытке должна быть взята кислота: 2H2CO3 + Mg(OH)2 → Mg(HCO3)2 + 2H2O. Кислота основание гидрокарбонат магния Выберите вариант задания по последней цифре зачетной книжки (табл. 6). Напишите все возможные уравнения реакций получения соли (а), которая представлена в вашем варианте, путем взаимодействия соединений различных классов. Укажите тип реакций. Составьте уравнение реакции получения соли (б). Укажите условие, при котором образуется данная соль. Таблица 6 Варианты заданий
          Выводы Сформулируйте и запишите принцип кислотно-основного взаимодействия. Составьте и изобразите схему генетической связи различных классов неорганических соединений на конкретном примере получения средней соли задания 4.        Домашнее задание Задание 1. Кремниевой кислоте соответствует формула ○ 1) H3PO4 ○ 2) H2CO3 ○ 3) HNO3 ○ 4) H2SiO3 Задание 2. Формула высшего оксида элемента, образующего летучее водородное соединение H 2Э, имеет вид ○ 1) ЭО2 ○ 2) ЭО4 ○ 3) ЭО ○ 4) ЭО3 Задание 3. Кислотами являются гидроксиды ○ 1) C (IV) ○ 2) Ca ○ 3) S (IV) ○ 4) Fe (II) Напишите формулы кислот и уравнения реакций, подтверждающих химические свойства     Задание 4. Амфотерными являются гидроксиды ○ 1) марганца (VII) ○ 2) кальция ○ 3) бериллия ○ 4) алюминия Напишите формулы гидроксидов в виде соответствующих кислот и в виде соответствующих оснований, а также уравнения реакций, подтверждающих их амфотерные свойства.     Задание 5. Какие из соединений могут взаимодействовать между собой? ○ 1) H2CO3 и P2O5 ○ 2) H2S и Na2O ○ 3) MgO и CrO3 ○ 4) Cu(OH)2 и K2O Напишите уравнения реакций, названия исходных веществ, указав к какому классу соединений они относятся и какими свойствами (основными, кислотными, амфотерными) обладают. Назовите продукты реакций. Объясните, почему не могут взаимодействовать другие из указанных соединений.        Задание 6. Получению кислых солей соответствуют уравнения: KOH + H3PO4 → 2KOH + H3PO4 → 3KOH + H3PO4 → 6KOH + P2O5 → Закончите уравнения реакций, не меняя коэффициенты в левой части уравнения, и напишите названия полученных солей.     Задание 7. Основные соли образуются в реакциях, уравнения которых начинаются следующим образом: NaOH + H2SO4 → 2KOH + N2O5 → Al(OH)3 + 2HNO3 → Fe(OH)2 + HCl → Закончите уравнения реакций, не меняя коэффициенты в левой части уравнения, и напишите названия полученных солей.     | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
