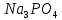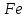Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 6. РАВНОВЕСИЕ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВЦель работы Овладеть методикой определения электролитической диссоциации, сильных и слабых электролитов, степени константы диссоциации. Познакомиться с электролитической диссоциацией кислот, оснований, солей. Изучить условия протекания практически необратимых реакций двойного обмена и правила написания ионно-молекулярных реакций. Ознакомиться с характеристикой реакции среды с помощью водородного показателя pH. Усвоить суть процесса гидролиза солей и условий его смещения. Теоретические сведения Растворами называются гомогенные, самопроизвольно образовавшиеся системы переменного состава. Общими являются те свойства растворов, которые зависят от концентрации и практически не зависят от природы веществ, образовавших раствор. Общие свойства растворов проявляются в понижении температуры их замерзания, повышении температуры кипения, а также в явлении осмоса. Повышение температуры кипения и понижение температуры замерзания раствора неэлектролитная пропорционально моляльной концентрации раствора (Cm): 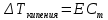 (6.1) (6.1)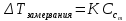 (6.2) (6.2)Где E – эбулиоскопическая постоянная растворителя, (градус кг)/моль; K – криоскопическая постоянная растворителя, (градус кг)/моль. Для растворов электролитов в формулы вводится изотонический коэффициент i 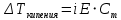 (6.3) (6.3)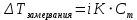 (6.4) (6.4)Моляльная концентрация: 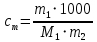 , моль/кг , моль/кгГде m1 и M1 – масса (г) и молярная масса (г/моль) растворенного вещества; m2 – масса растворителя, г; 1000 – коэффициент перевода г в кг. Осмотическое давление (  ) рассчитывается по уравнению Вант-Гоффа: ) рассчитывается по уравнению Вант-Гоффа: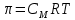 (6.6) (6.6)где CM – молярная концентрация раствора, г/моль; R – универсальная газовая постоянная, 8,31 (л∙кПа)/(К∙моль); T – температура, K. Отличительным свойством электролитов является их способность под действием полярных молекул растворителя распадаться (диссоциировать) на ионы – заряженные частицы. К электролитам относятся кислоты, основания, соли. Количественно электролитическая диссоциация характеризуется степенью и константой диссоциации. Степень электролитической диссоциации (α) равна отношению числа молекул, которые продиссоциировали на ионы, к общему числу молекул электролита. Для сильных электролитов (табл. 13) степень диссоциации равна единице, таким образом, сильные электролиты существуют в растворах в виде гидратированных ионов. Слабые электролиты имеют степень диссоциации значительно меньше единицы и в растворах находятся, в основном, в виде молекул. Таблица 13 Сильные и слабые электролиты
Примечание: к слабым электролитам относится также вода. Константа электролитической диссоциации (табл. 14) характеризует равновесие диссоциации только слабых электролитов. Чем меньше величина константы диссоциации, тем более слабым является электролит. Таблица 14 Константы диссоциации кислот и оснований в водных растворах
Процесс диссоциации сильных электролитов происходит в одну ступень. Слабые электролиты диссоциируют обратимо, причем многоосновные кислоты и многокислотные основания диссоциируют по ступеням. Рабочее задание. Задание 1. Проведение практически необратимых реакций двойного обмена Вариант задания выберите по последней цифре зачетной книжки в соответствии с таблицей 16 Таблица 16 Перечень реактивов к рабочему заданию
Из набора реактивов, предложенных к заданию 1, вам следует выбрать по два таких, чтобы провести между ними три реакции, идущие с образованием: Газообразного вещества; Нерастворимого вещества; Слабого электролита. Пользуясь таблицей растворимости и таблицей констант диссоциации слабых электролитов, проведите реакции в пробирках, взяв для этого по 1-2 мл выбранных растворов электролитов. Все выполненные реакции напишите в молекулярной, полной и сокращенной ионно-молекулярной форме и проверьте у преподавателя правильность выполнения и оформления опыта.      Задание 2. Изменение pH раствора электролита и вычисление степени его диссоциации В стаканчик с соответствующей надписью налейте около 50 мл раствора электролита и отлейте из него в пробирку 2-3 мл, куда добавьте 2-3 капли индикатора универсального. О какой реакции среды: кислой или щелочной, говорит окраска индикатора, какое значение рН (> 7 или < 7) соответствует данному электролиту? Определите рН раствора универсальной индикаторной бумагой и внесите данные в табл. 17. Таблица 17 Значения pH раствора электролита и степени его диссоциации
Задание 3. Гидролиз солей В две пробирки налейте на 3/4 объёма воды и определите значение рН с помощью универсальной индикаторной бумаги. Запишите значение водородного показателя воды в рабочую тетрадь.  Добавьте в пробирки понемногу солей, предложенных вариантом рабочего задания 4, встряхните содержимое пробирок и определите рН растворов универсальной индикаторной бумагой. Запишите значения рН растворов солей и сравните их с водородным показателем воды. Произошло ли увеличение или уменьшение рН или его значение не изменилось?  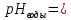 _____; _____; 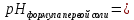 _____; _____; 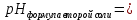 _____; _____;Для объяснения наблюдаемых явлений напишите уравнения взаимодействия солей с водой в молекулярной и ионно-молекулярной форме. Отметьте, в растворе какой соли и почему реакция среды стала кислой, щелочной или не изменилась.       Таблица 18 Перечень реактивов к рабочему заданию
Выводы Сформулируйте и запишите условия протекания практически необратимых реакций двойного обмена. Сформулируйте и запишите, как по значению степени диссоциации определить, является электролит сильным или слабым. Объясните, какие соли подвергаются гидролизу, и какие не подвергаются и почему при гидролизе солей всегда изменяется pH среды. Домашнее задание Задание 1. Составьте уравнения электролитической диссоциации следующих веществ: HNO3, H2SiO3, KOH, Al(OH)3, NH4OH, CuSO4, Na2CO3, FeCl2, NaH, CO3, (ZnOH)Cl.       Задание 2. Напишите молекулярные, полные и сокращённые ионно-молекулярные уравнения реакций 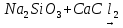 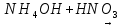 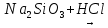     Задание 3. Водородный показатель раствора HNO3 равен 1, а раствора HNO2 равен 2. Вычислите степень диссоциации азотной и азотистой кислот, если концентрация обеих кислот составляет 0,1 моль/л.    Задание 4. Вычислите концентрацию раствора гидроксида аммония NH4OH, если степень его диссоциации составляет 0,1 pH = 12.    Задание 5. Напишите молекулярные, полные и сокращенные ионно-молекулярные уравнения гидролиза солей: Нитрита натрия Хлорида алюминия Карбоната калия Для каждой соли укажите реакцию среды, а также частицу, способствующую протеканию гидролиза. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

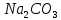 ,
, 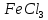 , HCl, NaOH
, HCl, NaOH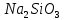 ,
, 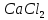 , HCl,
, HCl, 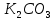
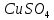 ,
, 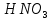 , KOH
, KOH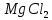 ,
, 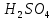 ,
, 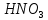 ,
,  ,
, 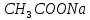 , HCl,
, HCl, 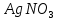 ,
, 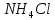 ,
, 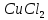 ,
, 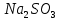
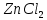 ,
, 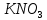 ,
,