Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 8. ЖЕСТКОСТЬ ПРИРОДНЫХ ВОДЦель работы Познакомится с минеральными солями, обусловливающими жесткость воды. Овсвоить методику определения карбонатной и общей жесткости воды. Овладеть расчетами жесткости воды по результатам анализов. Теоретические сведения Природная вода, содержащая большое количество солей кальция и магния, является жесткой водой. Суммарное содержание этих солей определяет общую жесткость. Жесткость воды, обусловленную присутствием гидрокарбонатов кальция и магния, называют карбонатной. При длительном кипячении такой воды в ней образуется осадок: 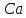 , ,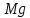 и эта жесткость устраняется. Поэтому карбонатную жесткость называют также временной. Все остальные соли кальция и магния, находящиеся в воде и остающиеся в ней после кипячения, образуют некарбонатную или постоянную жёсткость. Жесткость воды измеряется числом ммоль-эквивалентов ионов кальция и магния, содержащихся в 1 л воды: 1 ммоль эквивалента соответствует нахождению в воде 20 мг ионов Ca2+ или 12 мг ионов Mg2+. По содержанию солей жесткости воды делятся на мягкие – Жобщ до 3 ммоль/л, средней – Жобщ до 6 ммоль/л и очень жесткие Жобщ > 10 ммоль/л. Использование жестких вод приводит к весьма нежелательным результатам: непроизводительный расход мыла, износ тканей при стирке, понижение питательных качеств продуктов, усиления коррозии котлов, отложение накипи на поверхности теплообменных аппаратов, что снижает экономичность их работы. В связи с этим воду необходимо умягчать, а затем использовать для хозяйственно – бытовых и промышленных нужд. Суть умягчения заключается в осаждении ионов Ca2+ и Mg2+ путем обработки воды специальными реагентами. Жесткость питьевой воды не должна превышать 7 ммоль/л, а котельной – 0,017 ммоль/л. Расход воды в хозяйственной деятельности человека очень высок, поэтому процесс умягчения требует больших затрат. Чтобы добиться необходимого качества воды, не прибегая к лишним затратам, сначала проводят анализ на содержание солей жесткости, а затем расчет необходимого количества реагентов для обработки воды. Рабочее задание Задание 1. Определение карбонатной (временной) жесткости В основе определения лежит следующая реакция: 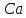 Карбонатную жёсткость определяют титрованием точно отмеренного объёма исследуемой воды кислотой с точной концентрацией в присутствии индикатора. Бюретку промойте раствором соляной кислоты (НСl) с молярной концентрацией эквивалента 0,1 моль/л, затем наполните им бюретку так, чтобы в носике не было пузырьков воздуха. Избыток раствора слейте и установите уровень жидкости в бюретке на нулевом делении, чтобы нижняя граница мениска касалась отметки. При каждом последующем титровании устанавливайте уровень кислоты на любом целом делении. Отмерьте мерной колбой 100 мл исследуемой воды и количественно перенесите в коническую колбу на 250 мл, добавьте 3-4 капли индикатора метилоранжа. Приготовленную пробу воды оттитруйте (прибавлением по каплям при постоянном перемешивании) раствором кислоты до перехода окраски из желтой в оранжевую от одной избыточной капли кислоты. По бюретке определите объем кислоты, пошедший на титрование. Титрование повторите, если результаты двух титрований отличаются более чем на 0,1 мл. Расчет жесткости воды ведите по среднему значению. Полученные данные внесите в таблицу 20. Таблица 20 Результаты определения карбонатной жесткости
Карбонатную жесткость воды (Жк) рассчитайте по формуле 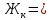 , (ммоль/л) (8.1) , (ммоль/л) (8.1)где 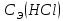 – молярная концентрация эквивалента раствора кислота; – молярная концентрация эквивалента раствора кислота;V1 – объем воды, взятый для анализа, мл4 V2 – объем раствора кислоты, пошедший на титрование, мл; 1000 – коэффициент перевода моль в ммоль.    Задание 2. Определение общей жесткости воды Общая жесткость воды определяется титрованием точно отмеренного объема воды трилоном «Б» в щелочной среде в присутствии индикатора - хрома темно-синего. В коническую колбу на 250 мл отмерьте мерной колбой 100 мл исследуемой воды, добавьте 5 мл аммонийного буфера и на кончике шпателя - хрома тёмно-синего. Приготовленную пробу воды оттитруйте из бюретки, заполненной, как описано в предыдущем опыте, трилоном «Б» до перехода окраски из вишнёвой в синюю. Титрование повторите, для расчёта используйте средний результат. Расчёт общей жёсткости воды (Жобщ) проведите по формуле 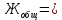 (ммоль/л) (8.2) (ммоль/л) (8.2) По данным анализа двух опытов рассчитайте постоянную жёсткость воды (Жп), исходя из выражения 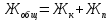 (8.3) (8.3) Выводы Укажите, какие соли в основном обусловливают исследованной воды К какой группе вод по жесткости относится исследованная вода? Отвечает ли исследованная вода нормам ГОСТ «Вода питьевая»?       Домашнее задание Задание 1. Анализом установлено, что в 500 мл воды содержится 42 мг ионов Mg2+ и 56 мг ионов Ca2+. Вычислите общую жесткость воды.    Задание 2. Сколько граммов сульфата кальция содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л?    Задание 3. Определите карбонатную и общую жесткость воды Воронежского водохранилища, содержащей в 300 мл 30 мг Ca2+; 3,6 мг Mg2+; 90 мг Na+; 61 мг HCO3+; 180 мг Cl-.    Задание 4. Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатами, содержащимися в 100 мл этой воды, было израсходовано 5 мл раствора HCl с концентрацией 0,1 моль/л.    |

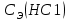 , моль/л
, моль/л