Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 1. ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ ВЕЩЕСТВАЦель работы Освоить экспериментальный метод определения молекулярной массы газа Научиться вести химические расчеты, используя основные понятия и законы химии Теоретические сведения Молекулярная масса является основной характеристикой любого вещества, простого или сложного. Основные понятия химии — относительная молекулярная масса (Mr), молярная масса (M, г/моль), количество вещества (ν, моль), молярный объем (Vm = 22,4 г/л), число Авогадро NA = 6,02∙1023 моль-1. В этой же работе рассмотрены основные законы химии, в том числе закон Авогадро и следствия из закона, позволяющие проводить химические расчеты. Экспериментальное определение молекулярной (молярной) массы газообразных веществ основано на применении закона Авогадро и его следствий. Молярная масса газа определяется на основании молярного объема (Vm). Один моль любого газа при нормальных условиях (н.у.) (p = 1,013∙105 Па, T = 273 K) занимает объем, равный 22,4 л: Vm = 22,4 л/моль. Зная массу газа в определенном объеме, можно вычислить его молярную массу: 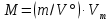 (1.1) (1.1)где M – молярная масса газ, г/моль; m – масса газа, г; V˚ – объем газа (н.у.), л; Vm – молярный объем. Выражение 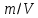 представляет собой массу единицы объема газа (н.у.), т.е. его абсолютную плотность p (г/л; кг/м3). Молярная масса газа равна представляет собой массу единицы объема газа (н.у.), т.е. его абсолютную плотность p (г/л; кг/м3). Молярная масса газа равна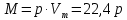 (1.2) (1.2)Если объем газа измерен при температуре и давлении, отличных от нормальных то для вычисления абсолютной плотности объем газа необходимо привести к нормальным условиям используя формулу, объединяющую законы Бойля-Мариотта, и Гей-Люсака: 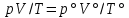 , тогда , тогда 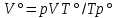 (1.3) (1.3)Молекулярная масса (молярная масса газа) может быть определена через его относительную плотность по другому газу, молекулярная масса которого известна. Относительной плотностью газа 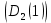 называется отношение массы определенного объема одного газа (m1) к массе такого же объема другого газа (m2), взятых при одних и тех же условиях, а значит, и отношение молярных масс этих газов (M1 и M2): называется отношение массы определенного объема одного газа (m1) к массе такого же объема другого газа (m2), взятых при одних и тех же условиях, а значит, и отношение молярных масс этих газов (M1 и M2):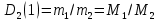 ; (1.4) ; (1.4)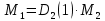 (1.5) (1.5)Отношение 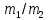 и и 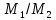 показывает, во сколько раз один газ тяжелее или легче другого газа. Если плотность исследуемого газа определяется по воздуху, средняя молярная масса которого ̴ 29 г/моль, то молярная масса газа равна: показывает, во сколько раз один газ тяжелее или легче другого газа. Если плотность исследуемого газа определяется по воздуху, средняя молярная масса которого ̴ 29 г/моль, то молярная масса газа равна: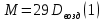 (1.6) (1.6)Определение молекулярной массы с помощью уравнения Менделеева – Клапейрона: 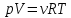 , или , или 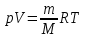 , (1.7) , (1.7)где ν – количество (моль) газа, m – масса газа, M – его молярная масса, R – универсальная газовая постоянная. Рабочее задание Определение молекулярной массы вещества Последовательность выполнения работы: Сухую колбу емкостью 0,250 л закройте пробкой, нижний уровень пробки отметьте карандашом для надписей по стеклу; Взвесьте на технических весах (точность 0,01 кг) колбу с воздухом, закрытую пробкой m1 (г)4 Поместите в реакционную колбу несколько кусочков мраморной крошки и из воронки прилейте раствор HCl. Образующийся в результате реакции CO2 в течение 3-4 минут наполняет колбу-приемник , вытесняя из нее воздух; Наполненную диоксидом углерода колбу закройте пробкой так, чтобы она вошла до метки, и взвесьте на тех же весах, на которых взвешивали колбу с воздухом m2 (г); Измерьте объем колбы (V) в условиях опыта (p, T). Для этого заполните колбу водой до отметки и вылейте воду в мерный цилиндр; Отметьте показания барометра (p) и термометра (t) во время опыта; Внесите результаты опыта в таблицу 1. 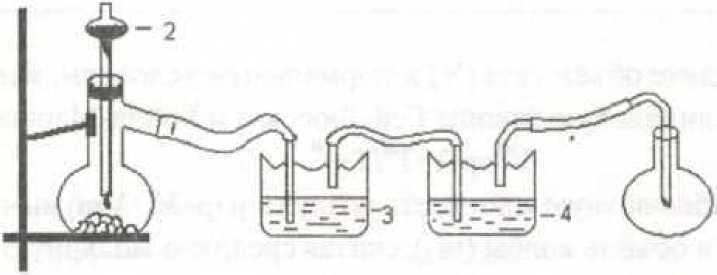 Рис. 1. Установка для получения СО2: 1 - реакционная колба; 2 - делительная воронка с раствором HCI; 3, 4 - промывные склянки; 5 - колба-приемник СО2 Таблица 1 Результаты опыта
Приведите объем газа (V) к нормальным условиям, используя формулу, объединяющую законы, Гей-Люсака и Бойля-Мариотта (1.5)   Через абсолютную плотность воздуха p ( 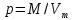 ) вычислите массу воздуха в объеме (m3), считая среднюю молярную массу воздуха равной 29 г/моль: ) вычислите массу воздуха в объеме (m3), считая среднюю молярную массу воздуха равной 29 г/моль: 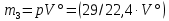   Рассчитайте массу пустой колбы (m4) и массу CO2 в объеме колбы (m5): 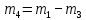 и и 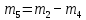   Вычислите относительную молекулярную массу диоксида углерода и его молярную массу через относительную плотность CO2 по воздуху: 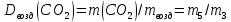 и и 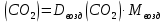 ; ;  Вычислите относительную ошибку опыта ( 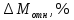 . .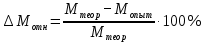   Выводы Перечислите основные понятия и законы атомно-молекулярного учения, использованные при расчетах молекулярной массы газа.       Домашнее задание Задание 1. Какое количество вещества (моль) содержится в 0,1 м3 водорода (н.у.) и в 0,1 кг этого газа?     Задание 2. Вычислите относительную плотность по воздуху газовой смеси, в которой объемные доли метана CH4 и этана C2H6 равны 52 и 48 % соответственно. Тяжелее или легче воздуха эта смесь?     Задание 3. Определите давление 0,1 кг пропана в сосуде объемом 102 м3 при – 2 ˚C.     Задание 4. Образец алюминия массой 3 г, содержащий 10% примесей, взаимодействует с избытком соляной кислоты. Рассчитайте: Количество (моль) образовавшегося хлорида алюминия и его массу; массовую долю алюминия в хлориде алюминия; Объем выделившегося водорода при нормальных условиях и в условиях, отличных от нормальных: T = 298 K и p = 98600 Па.         |
