Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 2. ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТА ВЕЩЕСТВАЦель работы Научиться проводить расчеты эквивалентов простых и сложных веществ; усвоить закон эквивалентов. Освоить экспериментальный метод определения эквивалента вещества Теоретические сведения Эквиваленты и молярные массы эквивалентов простых и сложных веществ могут быть определены экспериментально и вычислены исходя из состава соединения. Значения эквивалента вещества зависит от того, в какой конкретной реакции оно участвует. Молярная масса эквивалента основания может быть вычислена как частное от деления молярной массы основания на его кислотность, определяемую числом вступающих в реакцию гидроксильных групп. Для вычисления молярной массы эквивалента кислоты необходимо молярную массу кислоты разделить на ее основность, которая определяется числом атомов водорода, замещающихся на атомы металла. Чтобы вычислить молярную массу эквивалента соли, надо молярную массу соли разделить на произведение числа атомов металла в молекуле соли на его степень окисления. Эквивалентным объемом (VЭ) называется объем, занимаемый эквивалентом газообразного вещества (н.у.). Учитывая, что молекулы простейших газов двухатомны (H2, O2), и зная молярный объем газа (Vm = 22,4 л/моль), можно рассчитать молярные объемы эквивалентов: 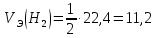 (л/моль); (л/моль); 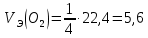 (л/моль). (л/моль).В соответствии с законом эквивалентов массы (объемы) реагирующих друг с другом веществ пропорциональны их молярным массам (объемам) эквивалентов: 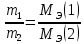 ; ; 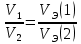 ; ; 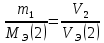 , (2.1) , (2.1)где m1 и m2 – массы веществ; V1 и V2 – объемы газообразных веществ (н.у.); MЭ(1) и MЭ(2) – молярные массы эквивалентов веществ; VЭ(1) и VЭ(2) – молярные объемы эквивалентов газообразных веществ. Рабочее задание. Определение эквивалента карбоната кальция Для определения эквивалента вещества соберите установку, схема которой приведена на рисунке 2. 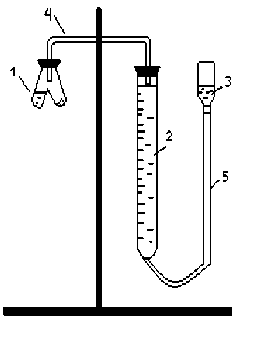 Рис. 2. Схема установки для определения эквивалента вещества: 1 - реакционный сосуд; 2 - бюретка; 3 - уравнительный сосуд; 4, 5 - соединительные трубки Таблица 2 Значения давления насыщенного водяного пара при разных температурах
Таблица 3 Данные для расчета молярной массы эквивалента
В соответствии с уравнением Менделеева-Клапейрона 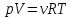 , рассчитайте количество CO2 (моль): , рассчитайте количество CO2 (моль):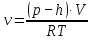 . (2.2) . (2.2)  Масса CO2 равна 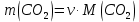 . (2.3) . (2.3)  Используя закон эквивалентов (2.1), вычислите молярную массу эквивалента CaCO3: 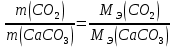 . .  Приведите объем выделившегося углекислого газа V(CO2) к нормальным условиям (V˚), воспользовавшись законом Гей-Люсака и Бойля-Мариотта: 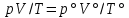   По закону эквивалентов вычислите молярную массу эквивалента CaCO3: 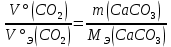 , где , где 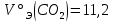 (л/моль) (л/моль)  Вычислите относительную ошибку опыта 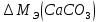 , %: , %: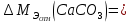   Выводы Запишите основные законы и положения атомно-молекулярной теории, использованные при расчетах эквивалента вещества. Установите, соответствует ли результаты эксперимента теоретически рассчитанной величине молярной массы эквивалента карбоната кальция?          Домашнее задание Задание 1. Вычислите молярные массы эквивалентов следующих веществ: CaO, KOH, Mg(OH)2, Ca(HCO3)2, H3PO4, Na2CO3, SO2, NH3. Для газообразных веществ (SO2 и NH3) найдите молярные объемы эквивалентов    Задание 2. Вычислите количество вещества и число молярных масс эквивалентов, содержащихся в 14,8 г гидроксида кальция, 106 г карбоната натрия, 1,46 г гидрокарбоната магния.    Задание 3. Вычислите молярную массу эквивалента H3PO4 в реакциях обмена, в результате которых образуются кислые и нормальные соли.    Задание 4. Рассчитайте молярную массу эквивалента металла и его атомную массу, если 1,215 кг его вытесняют из серной кислоты 1,12∙10-3 м3 водорода (н.у.). Валентность металла равна двум.     Задание 5. Природные воды, содержащие в растворенном состоянии достаточное количество CO2, растворяют известняки, превращая карбонат кальция в гидрокарбонат: CaCO3 + CO2 + H2O = Ca(HCO3)2. В реакцию вступает 1 кг известняка, содержащего 10% примесей. Рассчитайте: Массу образовавшегося Ca(HCO3)2; Объем CO2, необходимый для растворения CaCO3; Молярные массы эквивалентов веществ, участвующих в реакции.       |
