Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 13. КАЧЕСТВЕННЫЙ И КОЛИЧЕСТВЕННЫЙ АНАЛИЗЦель работы Ознакомиться с качественными реакциями обнаружения катионов и анионов. Научиться вести расчеты и готовить растворы заданной концентрации. Овладеть техникой титриметрического анализа. Теоретические сведения Закономерности, в соответствии с которыми проводятся исследования качественного и количественного состава веществ, композиционных материалов и других объектов, изучаются аналитической химией. Основанием для проведения исследования является наличие аналитического сигнала, т.е. функциональной зависимости того или иного измеряемого свойства вещества от его содержания в анализируемом объекте. В качественном анализе только фиксируется наличие аналитического сигнала, в количественном анализе измеряется его интенсивность. Неорганический качественный анализ в водных растворах основан на ионных реакциях и позволяет обнаруживать элементы в форме катионов или анионов по их специфическим аналитическим сигналам. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения, происходит окисление или восстановление с изменением цвета раствора (табл. 30). Основной операцией в титриметрическом анализе является титрование, которое заключается в прибавлении из бюретки по каплям одного раствора к предварительно точно отмеренному объёму второго раствора. Концентрация одного раствора точно (до 0,0001 моль/л) известна, он называется рабочим, стандартным или титрованным. Второй раствор - исследуемый, его концентрация определяется в ходе анализа (рис. 15). Титриметрический метод исследования состоит в точном измерении объемов растворов двух веществ, вступающих между собой в реакцию. 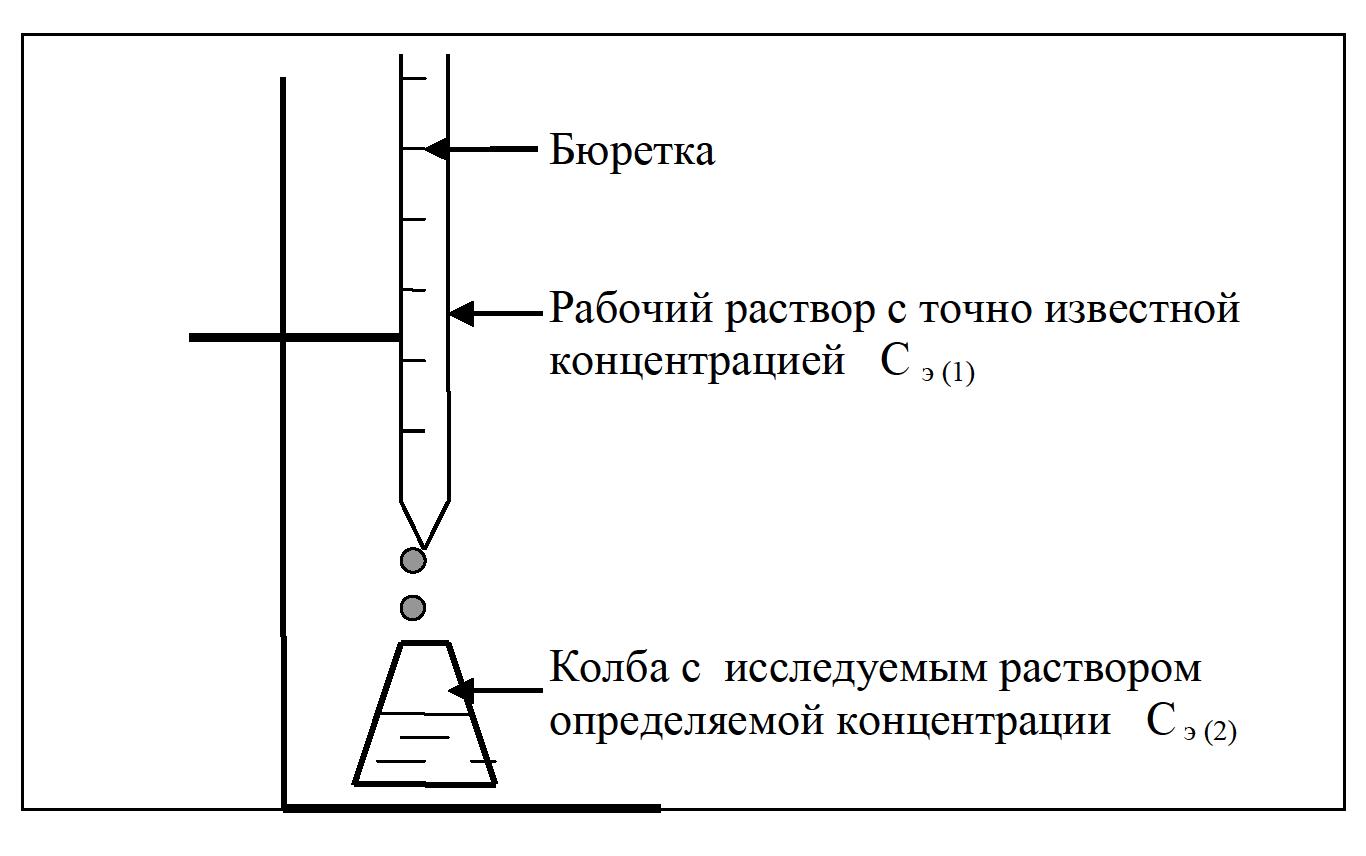 Рис. 15 Схема установки для проведения титриметрического анализа Таблица 30 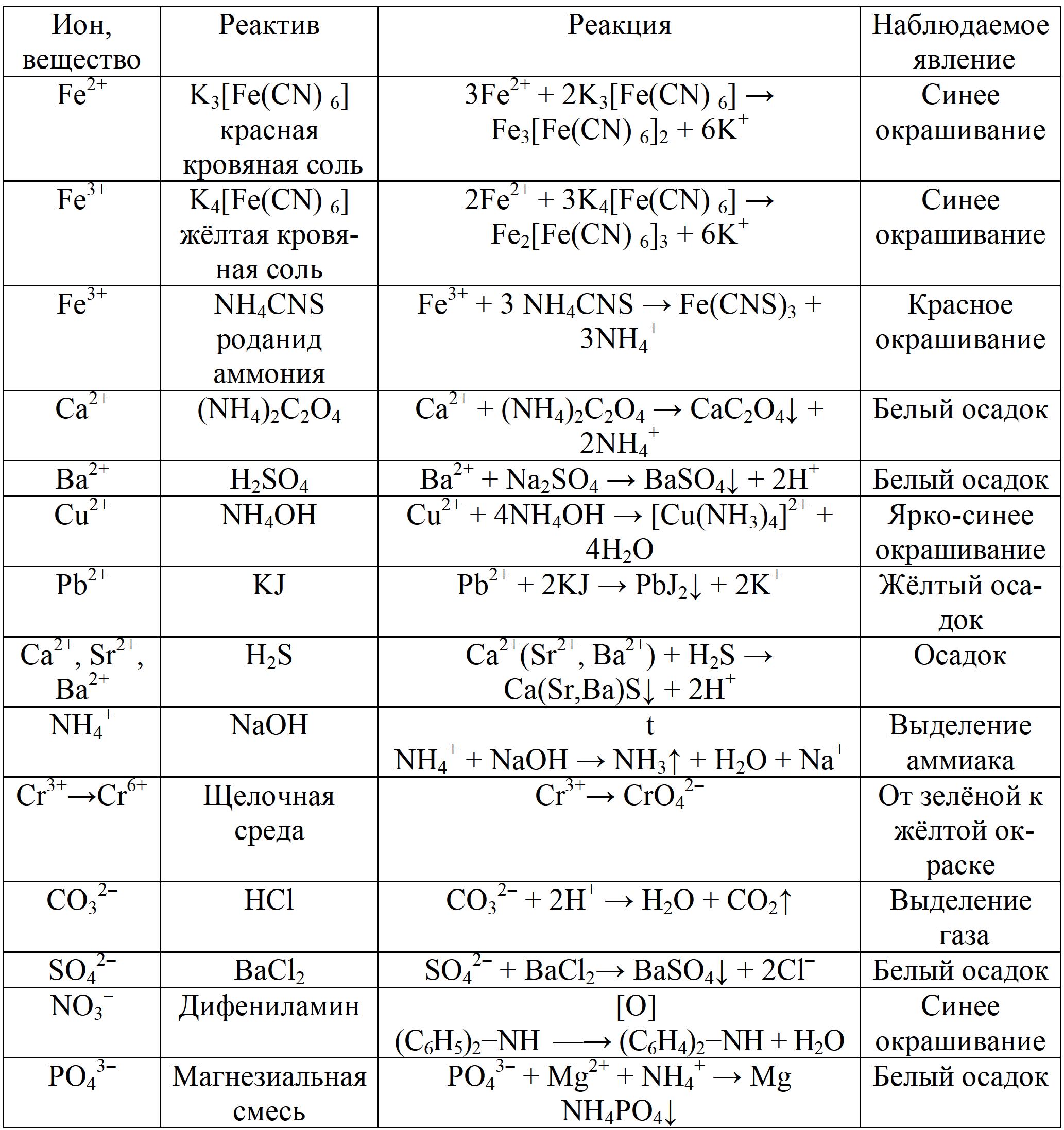 Качественные реакции обнаружения некоторых катионов и анионов Качественные реакции обнаружения некоторых катионов и анионовТитрование ведется до точки эквивалентности, когда количества реагирующих веществ станут эквиваленты: 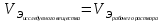 , (13.1) , (13.1)Для расчета результата анализа в титриметрии используется основная формула CЭ(1)∙V1 = CЭ(2)∙V2 (13.2) где CЭ(1) и V1 – молярная концентрация эквивалента (моль/л) и объем рабочего раствора (мл), пошедшего на титрование; CЭ(2) и V2 – молярная концентрация эквивалента (моль/л) и объем исследуемого раствора (мл), взятого для титрования. Молярная концентрация эквивалента 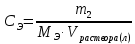 , моль/л (13.2) , моль/л (13.2)Где m2 – масса растворенного вещества; V – объем раствора, л; MЭ – молярная масса эквивалента растворенного вещества, вычисляется по формуле 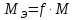 Коэффициент f равен числу эквивалентов, содержащихся в 1 моль вещества или, что то же самое, обратной величине числа химических связей MЭ = (M): (n) Например: M(HCl) = MЭ(HCl); MЭ(H2SO4) = 1/2 M(H2SO4); M(KOH) = MЭ(KOH); MЭ(K2SO4) = 1/2 M(K2SO4); MЭ(Ba(OH)2) = ½ M(Ba(OH)2); MЭ(Al2(SO4)3) = 1/6 M(Al2(SO4)3). Между молярной концентрацией и молярной концентрацией эквивалента существует соотношение 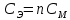 или или 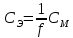 (13.3) (13.3)Точка эквивалентности фиксируется с помощью кислотно-основных индикаторов, например фенолфталеина, метилоранжа, окраска которых зависит от pH среды. В основе метода нейтрализации лежит реакция 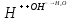 . В момент окончания титрования число эквивалентов кислоты равно числу эквивалентов щелочи. . В момент окончания титрования число эквивалентов кислоты равно числу эквивалентов щелочи.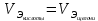 , ,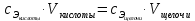 . (13.4) . (13.4)Рабочее задание Задание 1. Качественные реакции обнаружения ионов Таблица 31 Варианты рабочего задания для проведения качественных реакций обнаружения ионов
Для проведения качественных реакций к 1-2 мл раствора вещества, содержащего анализируемый ион, добавьте такой же объём реактива на этот ион. Отметьте наблюдаемое явление (образование осадков, окрашенных комплексных соединений, окисление или восстановление с изменением цвета раствора, выделение газа и т.д.) – аналитический сигнал. Каждый студент, выполняющий определённый вариант, записывает уравнение реакции и уточняет вид аналитического сигнала. Все студенты записывают все реакции в рабочую тетрадь, вид аналитического сигнала вносят в таблицу 32.      Задание 2. Приготовление раствора кислоты Методы приготовления растворов с точно известной концентрацией: растворением в мерной колбе содержимого «фиксанала» (запаянной стеклянной ампулы, содержащей (как правило) точно 0,1000 моль эквивалента вещества); из более концентрированного раствора готовят раствор приблизительной концентрации, а его точную концентрацию устанавливают титрованием; растворением в мерной колбе, взвешенной на аналитических весах точно рассчитанной навески. Вариант задания выберите по последней цифре зачётной книжки из таблицы 32. Таблица 32 Варианты рабочего задания по приготовлению раствора кислоты
Запишите в рабочую тетрадь вариант рабочего задания, проставив вместо многоточия соответствующие данные. Приготовить _____ мл ... кислоты с молярной концентрацией (эквивалента) _____моль/л из исходного раствора плотностью _____ г/см3 и массовой Долей _____ %. Объём раствора исходной кислоты рассчитайте аналогично задаче 4. Рассчитанный объём кислоты отмерьте мерной пробиркой и вылейте в мерную колбу. Колбу заполните водой точно до метки и тщательно перемешайте. Полученный таким образом раствор будет иметь приблизительно заданную концентрацию.      Задание 3. Установление точной концентрации приготовленного раствора Бюретку промойте приготовленным раствором кислоты и затем заполните им бюретку доверху. Проследите за тем, чтобы в «носике» бюретки не было пузырьков воздуха. Избыток раствора слейте и установите уровень жидкости в растворе на нулевом делении, чтобы нижняя граница мениска касалась нулевой отметки. При каждом последующем титровании устанавливайте уровень кислоты на любом целом делении бюретки. Пипетку дважды промойте рабочим раствором NaOH с молярной концентрацией эквивалента 0,0500 моль/л, отберите 10 мл его, перенесите в чистую колбу для титрования и добавьте 3-4 капли фенолфталеина. Затем по каплям, постоянно перемешивая раствор NaOH, приливайте кислоту из бюретки в колбу до исчезновения розовой окраски. В этот момент среда становится нейтральной, так как количество кислоты эквивалентно количеству щёлочи. Сделайте отсчёт по бюретке и запишите в таблице 33 объём кислоты, пошедший на титрование. Таблица 33 Данные по приготовлению и определению точной концентрации раствора кислоты
    Выводы Сформулируйте и запишите в чем отличие качественного и количественного химического анализа. Каким методом вы пользовались, чтобы приготовить раствор с точно известной концентрацией? Сформулируйте суть титриметрического метода анализа.       Домашнее задание Задание 1. Для приготовления 700 г раствора с массовой долей иодида калия 5 % необходимо растворить ____ граммов соли ○ 1) 84 ○ 2) 50 ○ 3) 35 ○ 4) 65 Правильность ответа подтвердите расчетом.    Задание 2. Молярная концентрация эквивалента раствора сульфата натрия, в 50 мл раствора которого содержится 7,1 г данной соли, равна ____ моль/л. ○ 1) 0,2 ○ 2) 2,0 ○ 3) 0,1 ○ 4) 1,0 Правильность ответа подтвердите расчетом.    Задание 3. Для нейтрализации 40 мл раствора уксусной кислоты с молярной концентрацией 0,5 моль/л требуется раствор, содержащий _____ миллилитрам ○ 1) 0,01 ○ 2) 0,02 ○ 3) 0,04 ○ 4) 0,05 Правильность ответа подтвердите расчетом.    Задание 4. Объем раствора хлорида кальция с молярной концентрацией 0,1 моль/л, необходимый для осаждения карбонат-ионов из 200 мл раствора карбоната калия с молярной концентрацией 0,15 моль/л, равен _____ миллилитрам ○ 1) 200 ○ 2) 100 ○ 3) 150 ○ 4) 300 Правильность ответа подтвердите расчетом    Задание 5. Объем раствора серной кислоты с молярной концентрацией 0,2 моль/л, необходимый для нейтрализации 40 мл раствора гидроксида натрия с молярной концентрацией эквивалента 0,15 моль/л, равен _____ миллилитрам. ○ 1) 30 ○ 2) 15 ○ 3) 45 ○ 4) 60 Правильность ответа подтвердите расчетом.    Задание 6. При разбавлении 0,5 М раствора соляной кислоты в пять раз pH будет иметь значение, равное ○ 1) 1 ○ 2) 10 ○ 3) 12 ○ 4) 5 Правильность ответа подтвердите расчетом.    | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

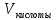 , мл
, мл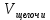 , мл
, мл