Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
1 мл щелочи КОН. Затем в каждую пробирку насыпьте на кончике шпателя несколько кристаллов сульфита натрия Na2SO3. Как изменилась окраска растворов?Работа 10. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ЭЛЕКТРОХИМИЧЕСКИЕ СИСТЕМЫ. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТЦель работы Усвоить суть процессов окисления и восстановления и научиться рассчитывать коэффициенты в уравнениях реакций. Изучить электрохимическую активность металлов, научиться рассчитывать электродные потенциалы и овладеть методикой определения электродвижущих сил гальванических элементов. Теоретические сведения Окислительно-восстановительные реакции сопровождается перемещением электронов от одних частиц (восстановителей) к другим частицам (окислителям), при этом изменяются степени окисления этих частиц. Под степенью окисления понимают воображаемый заряд атома, вычисленный из предположения, что соединение состоит из ионов. Степени окисления имеют знак «+» или «-» и целочисленное значение. Степени окисления элемента в простом веществе равны нулю. В химических соединениях более электроотрицательный элемент имеет отрицательную степень окисления, а менее электроотрицательный элемент – положительную. Алгебраическая сумма степеней окисления в нейтральной молекуле равна нулю, в сложном ионе- заряду иона. У большинства элементов высшая степень окисления имеет положительный знак и равна номеру группы в периодической системе. Для неметаллов низшая степень окисления равна высшей минус восемь, а поэтому имеет отрицательный знак, например, высшая степень окисления серы равна 6+, а низшая равна: 6-8=-2. Обычно в соединениях степень окисления фтора равна -1, кислорода -2, водорода +1. При контакте металла с раствором собственной соли протекают два противоположных процесса: переход ионов металла в раствор; адсорбция катионов из раствора на поверхности металла. Если в начальный момент времени скорость первого процесса больше скорости второго, поверхность металла приобретает избыточный отрицательный заряд, а прилегающий слой раствора – положительный; и наоборот, если скорость второго процесса больше скорости первого, поверхность металла заряжается положительно, а прилегающий слой раствора – отрицательно. И в том, и в другом случае между двумя заряженными слоями возникает разность потенциалов, называемая электродным потенциалом. Величина электродного потенциала зависит от природы металла, концентрации ионов в растворе, температуры и определяется уравнением Нернста: 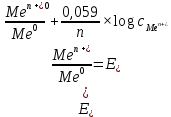 , (10.1) , (10.1)где 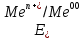 – стандартный электродный потенциал, возникающий на границе раздела «металл – раствор» при концентрации ионов металла 1 моль/л, температура 298 К и давление 101 кПа (таблица «Стандартные электродные потенциалы в водных растворах»). – стандартный электродный потенциал, возникающий на границе раздела «металл – раствор» при концентрации ионов металла 1 моль/л, температура 298 К и давление 101 кПа (таблица «Стандартные электродные потенциалы в водных растворах»).n – число электронов, принимающих участие в процессе на электроде; 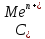 - концентрация ионов металла в растворе. - концентрация ионов металла в растворе.В зависимости от величины и знака стандартного электродного потенциала все металлы можно расположить в ряд стандартных электродных потенциалов (ряд напряжений), который характеризует электрохимическую активность металлов в окислительно-восстановительных реакциях, протекающих в водной среде при стандартных условиях: чем ближе металл к началу ряда, т.е. чем отрицательнее значение его потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная активность его иона; каждый металл в ряду напряжений обладает способностью вытеснять все следующие за ним металлы из растворов их солей; все металлы, стоящие в ряду напряжений до водорода, вытесняют его из разбавленных кислот (Кроме HNO3), стоящие правее – не обладают такой способностью. Так как при любой окислительно-восстановительной реакции происходит переход электронов от восстановителя к окислителю, можно создать такие условия, при которых окислительная и восстановительная реакции будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока, т.е. энергия химической реакции будет превращена в электрическую энергию. Устройства, которые применяются для преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами (рис. 9).  Рис. 9. Графическое изображение медно-цинкового гальванического элемента Действие любого гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. В простейшем случае гальванический элемент состоит из двух металлических электродов, погруженных в раствор электролита. Процесс окисления протекает на более активном металле, который называют анодом; процесс восстановления – на менее активном, который называют катодом. Электроны при этом переходят от анода к катоду по внешней цепи, ионы движутся от катода к аноду в растворе и через электролитический мостик. Электродвижущая сила гальванического элемента (ЭДС) равна разности электродных потенциалов катода и анода: 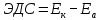 , ,где Ек – потенциал катода; Еа – потенциал анода. Рабочее задание Задание 1. Влияние реакции среды на окислительные свойства перманганата калия Налейте в три пробирка 2-3 мл раствора перманганата калия KMnO4 и добавьте в первую пробирку | ||||||||||||||||||||||||||||||||||||
| Вари ант | Электрод | Концентрация раствора, моль/л | Электродный потенциал, В |
| 1 | Zn/ZnSO4 | 0,01 | |
| 2 | 0,10 | | |
| 3 | Cu/CuSO4 | 0,01 | |
| 4 | 0,10 | |
Внесите в таблицу 26 значения электродных потенциалов всех вариантов. Укажите, от каких факторов зависит значение электродного потенциала.
У какого металла, имеющего более отрицательное или более положительное значение электродного потенциала, выше восстановительная активность?





Задание 3. Измерение ЭДС гальванического элемента
В таблицу 27 запишите значения стандартных электродных потенциалов.
Медный и цинковый электроды тщательно зачистите наждачной бумагой, промойте дистиллированной водой, просушите фильтровальной бумагой и опустите в стаканы, наполненные соответственно растворами сульфата меди (0,1 моль/л) и сульфата цинка (0,1 моль/л).
Растворы соедините электролитическим мостиком, а электроды подключите к выводам измерительного прибора: катод к «+», анод – к «–». Измерьте величину ЭДС и запишите в графу «Величина ЭДС экспериментальная».
Таблица 27
ЭДС медно-цинкового гальванического элемента
| Электрод (полуэлемент) | Концентрация электролита, моль/л | Стандартный электродный потенциал, В | Величина электродного потенциала, В | Величина ЭДС | |
| теоретическая | экспери- ментальная | ||||
| Zn | ZnSO4 | 0,1 | | | | |
| Cu | CuSO4 | 0,1 | | | ||
Рассчитайте величину ЭДС (величина ЭДС теоретическая), и внесите значение в таблицу 27.
Запишите схему и процессы на электродах медно-цинкового гальванического элемента.
Сравните теоретическое и экспериментальное значения ЭДС медно- цинкового гальванического элемента.





Задание 4. Действие разбавленных кислот на металлы
В две пробирки налейте по 1-2 мл разбавленной соляной, и в две - разбавленной азотной кислоты. В пробирки опустите по кусочку железа и меди. Если реакции не идут, растворы осторожно подогрейте на спиртовке.
Чтобы определить степень окисления полученного в результате реакции железа, содержимое пробирок, в которые оно помещено, разделите на две части. К одной из них добавьте 1-2 капли роданида железа KCNS, который в присутствии Fe3+ окрашивает раствор в красный цвет:
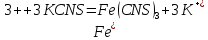 .
.К другой части добавьте 1-2 капли красной кровяной соли K3[Fe (CN)6], которая при наличии в растворе ионов Fe2+ образует осадок темно-синего цвета - турнбулеву синь:
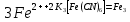 .
.Запишите схемы происходящих окислительно-восстановительных реакций и рассчитайте коэффициенты методом электронного баланса, укажите окислитель и восстановитель, процессы окисления и восстановления. Обратите внимание на то, какой ион является окислителем в соляной кислоте, и какой - в азотной.
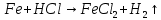 ;
;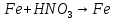 ;
;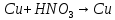 .
.Ориентируясь на значения стандартных электродных потенциалов, объясните, почему медь не растворяется в разбавленной соляной кислоте, а в азотной растворяется и почему железо растворяется в обеих кислотах.








Выводы
Составьте и запишите правило, по которому можно установить, какой металл будет восстановителем, а ион какого металла – окислителем в системе, содержащей две окислительно-восстановительные пары.
Объясните, почему водные растворы кислот и солей снижают долговечность металлических конструкций.
Домашнее задание
Задание 1. Вычислите степени окисления всех элементов в соединениях:
H2O, HCl, K2CO3, KCl, KClO3, Cr2(SO4)3, H2S



Задание 2. При работе гальванического элемента, состоящего из кобальтового и оловянного электродов, помещенных в 0,1 M растворы своих солей, на аноде протекает реакция
○ 1) Sn0 – 2e- → Sn2+ ○ 2) Co0 – 2e- → Co2+
○ 3) Sn2+ + 2e- → Sn0 ○ 4) Co2+ + 2e- → Co0
Ответ подтвердите, вычислив значения электродных потенциалов, величину ЭДС и составив схему процессов на аноде и катоде. Запишите токообразующую реакцию.






Задание 3. Наибольшую величину ЭДС в стандартных условиях будет иметь гальванический элемент, составленный
○ 1) из Ag и Cu ○ 2) из Al и Ag
○ 3) из Fe и Al ○ 4) из Ni и Fe
Правильность ответа подтвердите расчетом.




Задание 4. Коэффициент перед окислителем в уравнении
HNO2 + KMnO4 + H2SO4 → HNO3 + MnSO4 + K2SO4 + H2O равен
○ 1) 5 ○ 2) 7 ○ 3) 2 ○ 4) 10.
Определите степени окисления всех веществ, участвующих в реакции, напишите уравнения процессов окисления и восстановления и рассчитайте коэффициенты в данной реакции.





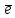 .
.