Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 11. КОРРОЗИЯ МЕТАЛЛОВ. ЗАЩИТА ОТ КОРРОЗИИЦель работы Разобраться в сущности, механизма химической и электрохимической коррозии металлов и сплавов. Ознакомиться с факторами, влияющими на скорость коррозии. Рассмотреть важнейшие методы защиты металлов от коррозии. Теоретические сведения Коррозией называется разрушение металлов и сплавов в результате взаимодействия их с агрессивной окружающей средой. Данный процесс протекает самопроизвольно (ΔG < O), причиной чего является термодинамическая неустойчивость металлов. В результате коррозии металл окисляется, окислитель окружающей среды восстанавливается. По механизму протекания процесса различают химическую и электрохимическую коррозию. Сущность химической коррозии сводится к непосредственному взаимодействию металла с окислителем окружающей среды, в результате электроны от металла переходят к окислителю. Процесс окисления и восстановления происходит на одних и тех же участках поверхности металла. Коррозия по химическому механизму протекает в неэлектропроводящих средах: атмосфере сухих газов, растворах неэлектролитов. Сущность электрохимической коррозии сводится к возникновению и работе коррозионных (короткозамкнутых гальванических) элементов. Следствием этого является то, что процессы окисления и восстановления идут на различных участках поверхности металла, что сопровождается движением электронов внутри металла. На анодных участках поверхности идет окисление металла: Me0 – ne- = Men+. На катодных участках поверхности в нейтральной или щелочной средах идут процессы восстановления кислорода: O2 + 2H2O + 4e- → 4OH- В кислой среде – выделение водорода: 2H+ + 2e- → H20. Коррозия по электрохимическому механизму протекает в средах, проводящих электрический ток: влажной атмосфере, почве, растворах электролитов. На скорость коррозии влияют как внутренние факторы (неоднородность сплава по химическому и фазовому составам, дефекты кристаллической решетки, наличие примесей и др.), так и внешние (реакция среды, наличие ионов – актививатор коррозии, агрессивных газов и др.). Многообразные методы защиты от коррозии, по сути их действия делятся на 4 группы: Легирование металлов Защитные покрытия Электрохимическая защита Изменение свойств коррозионной среды Рабочее задание Задание 1. Изучение механизма коррозионных процессов. Коррозия меди в атмосфере йода (демонстрационно, в вытяжном шкафу) Медную проволоку зачистите наждачной бумагой, обратите внимание на цвет и состояние поверхности до опыта. В тигель, закрепленный в штативе, поместите несколько кристалликов йода и медную проволоку, прикрепленную к крышке тигля. Нагрейте до появления газообразного йода. Через 2-3 минуты выньте медную проволоку из тигля. Изменилась ли поверхность медной проволоки? О чем это свидетельствует?    Напишите молекулярное и электронные уравнения реакции взаимодействия Cu с J2, имея в виду, что на поверхности образовалась соль Cu2J2.     По какому механизму: химическому или электрохимическому, протекает коррозия в данном случае? В чем заключается её сущность?     Коррозия при контакте двух металлов Возьмите две канцелярские скрепки (Fe), в одной из них укрепите медную проволоку, в другой – гранулу цинка. В две пробирки налейте примерно по 2 мл серной кислоты и добавьте несколько капель красной кровяной соли K3[Fe(CN)6], опустите в одну из них скрепку с медью, в другую - скрепку с цинком. Красная кровяная соль – реактив на ионы Fe+2. В присутствии этих ионов раствор окрашивается в синий цвет образующимся осадком темно-синего цвета «турнбулевой сини»: 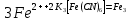 . .Запишите схемы возникших коррозионных элементов. Разберите работу каждого из них. Напишите уравнения электродных процессов. По какому механизму протекает коррозионный процесс и в чем заключается его сущность?       Факторы, влияющие на скорость коррозии. Влияние OH иона на скорость коррозии (активаторы и ингибиторы коррозии) Возьмите две пробирки, налейте в них по 2-3 мл соляной кислоты. В одну опустите гранулу алюминия, в другую – железную скрепку. Нагрейте обе пробирки до равномерного выделения пузырьков водорода. Запишите уравнения происходящих реакций.    Затем в обе пробирки добавьте около 0,5 мл концентрированного раствора NaOH. Что происходит? Запишите наблюдения в тетрадь. Какую роль играет ион ОН- в каждом рассмотренном случае?    Влияние хлорид-иона на коррозию алюминия В две пробирки налейте примерно по 2 мл сульфата меди, в каждую из них опустите по грануле алюминия. В одну из пробирок добавьте на кончике микрошпателя кристаллический хлорид натрия. Опишите наблюдаемое. Какую роль играет ион Сl?    Влияние образования коррозионного элемента на скорость коррозии цинка В пробирку налейте 2-3 мл серной кислоты, поместите в нее гранулу цинка. Обратите внимание на скорость выделения водорода. Запишите уравнение проходящей реакции. Опустите в кислоту медную проволоку, не доводя ее до соприкосновения с цинком. Выделяется ли водород на меди? Погрузите медную проволоку так, чтобы она касалась гранулы цинка. Опишите наблюдаемую картину. Объясните, почему в данном случае на меди выделяется водород, составьте схему образовавшегося коррозионного элемента и запишите уравнения электродных процессов.    Сравните интенсивность выделения водорода в первом и во втором случае. Что можно сказать о скорости коррозии цинка в обоих случаях?    Коррозия металла в результате различного доступа кислорода (демонстрационно) Зачистите стальную пластину наждачной бумагой, промойте дистиллированной водой, высушите фильтровальной бумагой. На поверхность пластины пипеткой нанесите каплю специально приготовленного раствора, содержащего хлорид-ионы (активатор коррозии) и K3[Fe(CN)6] (реактив на ионы Fe2+). Через 2-3 минуты добавьте каплю фенолфталеина (рис. 10). Опишите наблюдаемую картину и объясните её, имея в виду, что окислителем является растворенный в воде кислород. Известно, что концентрация кислорода уменьшается с увеличением толщины слоя воды.     Железо легко пассивируется, поэтому чем больше концентрация кислорода у поверхности железа, тем поверхность более пассивна, то есть потенциал её имеет более положительное значение по сравнению со стандартным электродным потенциалом. Учитывая вышесказанное, составьте схему коррозионного элемента, работающего в рассматриваемом случае, и напишите уравнения электродных процессов. Подтверждают ли экспериментальные наблюдения теоретические данные?    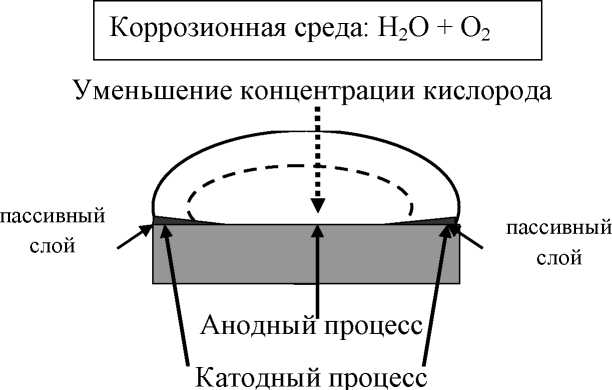 Рис. 10. Схема коррозии стальной пластинки при различном доступе кислорода Задание 2. Защита металлов от коррозии. Защитные свойства металлических покрытий В две пробирки налейте по 2-3 мл соляной кислоты и добавьте по 2-3 капли K3[Fe(CN)6] – реактив на ионы Fe2+. В одну пробирку поместите пластину луженого (покрытого оловом) железа, в другую - оцинкованного железа. Предварительно края каждой пластины зачистите наждачной бумагой. На каком образце появилось синее окрашивание? О чем это свидетельствует? Составьте схемы коррозионных элементов и разберите их работу. Укажите, какое покрытие катодное, какое - анодное. Какой из двух металлов будет защищать железо более длительное время при равных условиях, если покрытия не нарушены?       Действие ингибитора на коррозию железа В три пробирки налейте примерно по 2-3 мл соляной кислоты, в каждую из них опустите канцелярскую скрепку (Fe). Если скорость выделения водорода невелика, пробирки нагрейте на спиртовке до равномерного выделения пузырьков газа. Затем в первую пробирку добавьте на кончике микрошпателя уротропин, во втору. – 0,5-1 мл формалина, третья пробирка – контрольная. Сравните интенсивность выделения водорода в пробирках. Какова роль уротропина и формалина?    Выводы Сделайте заключение о сущности коррозии по химическому и электрохимическому механизму. Укажите, какие факторы влияют на скорость коррозии. Перечислите основные группы методов защиты металлов от коррозии.       Домашнее задание Задание 1. При нарушении цинкового покрытия на железном изделии во влажном воздухе на катоде будет протекать реакция, уравнение которой имеет вид … ○ 1) O2 + 2H2O + 4e- → 4OH- ○ 2) Zn0 – 2e- → Zn2+ ○ 3) Fe2+ + 2e- → Fe0 ○ 4) Fe0 – 2e- → Fe2+ Напишите уравнение анодного процесса. По какому механизму протекает коррозионный процесс?    Задание 2. Для защиты медных изделий от коррозии в качестве катодного покрытия можно использовать … ○ 1) Ag ○ 2) Ni ○ 3) Cr ○ 4) Sn Напишите электронные уравнения процессов, происходящих при нарушении выбранного покрытия (среда кислая). По какому механизму протекает коррозионный процесс?      Задание 3. Для защиты железных изделий от коррозии в качестве анодного покрытия используют … ○ 1) Олово ○ 2) Медь ○ 3) Цинк ○ 4) Серебро Напишите электронные уравнения процессов, происходящих при нарушении выбранного покрытия (среда кислая). Укажите механизм, по которому протекает коррозионный процесс. |
