Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
по 1 мл метилметакрилата. В одну из них налейте такой же объем бромной воды, в другую – несколько капель раствора КМnО4.Работа 12. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯЦель работы Познакомиться с особенностями строения и типичными свойствами некоторых классов органических соединений. Усвоить основные методы получения высокомолекулярных соединений. Получить обоснованные представления о химических свойствах полимеров и возможных направлениях их использования. Теоретические сведения Органические соединения – это соединения углерода, углеводороды и их производные. Органические соединения очень многочисленны, отличаются большим многообразием превращений и имеют большее значение в жизни и хозяйственной деятельности человека (пластмассы, каучуки, химические волокна, моторное топливо, ионообменные смолы, смазочные масла, красители, лекарственные препараты, моющие вещества и т.д.). Связи в органических соединениях ковалентные, преимущественно малополярные, поэтому для них характерна летучесть и низкая температура кристаллизации. Органические соединения могут иметь линейное, разветвленное и циклическое строение. Атомы углерода образуют между собой одинарные (о), двойные и тройные (ℼ) связи. Эти особенности химической природы углерода, важнейшего элемента органических соединений, обусловливают многочисленность и большое разнообразие углеводородов и их производных. Фундаментальная теория органической химии - теория химического строения А.М. Бутлерова, сущность которой заключается в следующем. Все химические соединения имеют определенный порядок связи атомов в молекуле, т.е. строение. Атомы соединены друг с другом химическими связями в соответствии с их валентностью. Углерод в органических соединениях практически всегда четырехвалентен. Свойства вещества определяются качественным, количественным составом, строением. Это положение теории доказывает явление изометрии. Изомеры - вещества, имеющие одинаковый состав, но разное строение, а потому и разные свойства. Изучая физические и химические свойства вещества, можно познать его строение и, наоборот, зная строение вещества, можно многое сказать о его свойствах. Химические свойства атомов и атомных группировок не являются постоянными, а зависят от других атомов молекулы. При этом наиболее сильное влияние атомов наблюдается в том случае, если они связаны непосредственно. Теория химического строения А.М. Бутлерова позволила не только систематизировать накопленный многими исследователями материал, но и понять тесную связь между строением и свойствами вещества, целенаправленно проводить синтез новых веществ и предвидеть результаты многих проводимых исследований. По строению основной цепи органические соединения делятся на ряды, представленные на рисунке 11. Представители одного гомологического ряда, отличающиеся друг от друга на различное число групп СН2 (гомологическая разница) и характеризующиеся похожими свойствами, называются гомологами. При замене в молекуле углеводорода одного или нескольких атомов водорода на определенные группы атомов (функциональные группы) образуются различные классы органических соединений. Функциональные группы и обусловливают важнейшие химические свойства органических соединений. Молекула органического соединения может быть представлена двумя фрагментами: R — X Углеродная цепь функциональная группа 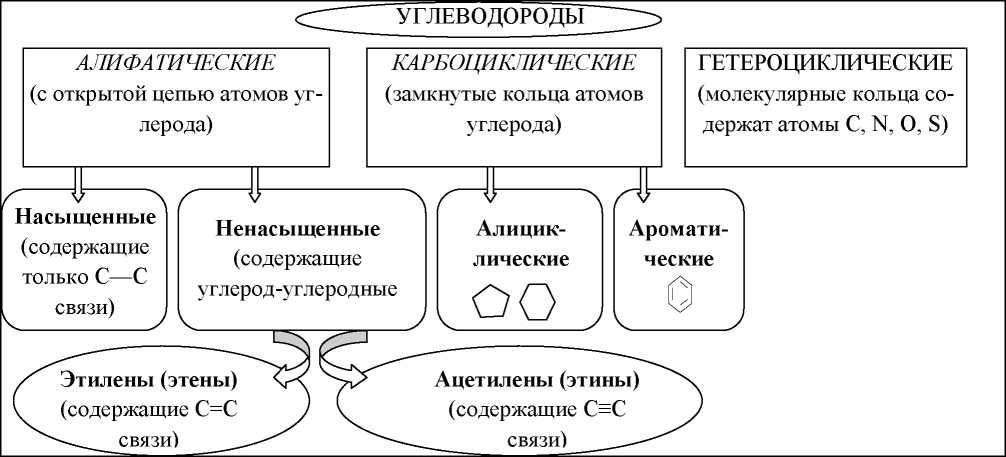 Рис. 11. Классификация органических соединений по строению основной цепи Важнейшие классы органических соединений представлены в таблице 28. Таблица 28 Классы органических соединений
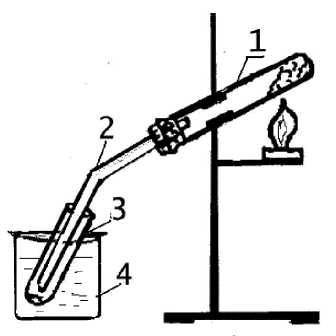
Соединения определенного гомологического ряда и класса характеризуются типичными химическими свойствами. Для углерода также характерно образование бесконечно длинных цепей, что приводит к возникновению высокомолекулярных соединений (полимеров). Полимеры – это высокомолекулярные вещества, макромолекулы которых состоят из огромного количества структурных звеньев, соединяющихся друг с другом посредством ковалентных связей. Схематично реакцию полимеризации можно представить следующим образом: n(A) → (A)n где – А молекула исходного мономера; (А)n – макромолекула, состоящая из n мономерных звеньев; n – степень полимеризации. В зависимости от метода получения полимеры можно разделить на полимеризационные и поликонденсационные. Полимеризационные полимеры получают из ненасыщенных углеводородов, содержащих двойные связи: nCH2 = CH → (– CH2 – CH –)n   X X Поликонденсационные полимеры получают по реакции поликонденсации низкомолекулярных веществ, имеющих не менее двух функциональных групп. При этом наряду с полимером образуются побочные низкомолекулярные вещества: 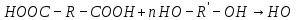 Двухосновная кислота двухатомный спирт полиэфир Полимеры с макромолекулами линейного или разветвленного строения, способные многократно размягчаться при нагревании и затвердевать при охлаждении, называются термопластичными. Они растворяются в органических растворителях. Полимеры, необратимо меняющие свойства при нагревании, называется термореактивными. Рабочее задание Задание 1. Получение углеводородов простой перегонкой нефти (опыт выполняется демонстрационно) В перегонную колбу дистилляционной установки (рис. 12) налейте до половины ее объема нефти, бросьте несколько керамических кусочков (для равномерного кипения), плотно закройте колбу пробкой с термометром (шкала до 350 °С), проверьте плотность соединения частей установки. Затем пустите воду в рубашку охлаждения холодильника и включите колбонагреватель. По мере нагревания нефти начнётся постепенное испарение углеводородов и их конденсация в холодильнике (перегонка). В ходе перегонки следите за равномерностью кипения смеси, за показаниями термометра и за поступлением отгона в приёмник. 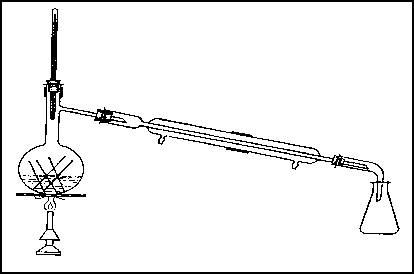 Рис. 12. Установка для простой перегонки Отберите следующие фракции дистиллята:   бензин бензин – t = (70-120) °С (газолин) – t = (120-180) °C (лигроин)   керосин – t = (180-200) °C (уайт-спирит) – t = (200-250) °C (газойль) Укажите состав нефти (объемные проценты фракций) и назначение полученных при перегонке продуктов.       Задание 2. Окисление органических соединений Поставьте в штатив 6 пробирок и налейте по |

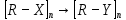 ,
,