Рабочая тетрадь по химии. Рабочая тетрадь по химии для студентов, обучающихся по всем образовательным программам бакалавриата и специалитета
 Скачать 1.37 Mb. Скачать 1.37 Mb.
|
Работа 4. ОПРЕДЕЛЕНИЕ ТЕПЛОВОГО ЭФФЕКТА ХИМИЧЕСКИХ РЕАКЦИЙЦель работы Усвоить основные положения химической термодинамики; Ознакомиться со способами определения и расчета тепловых эффектов химических реакций. Научиться решать вопрос о возможности протекания и направленности химических реакций. Теоретические сведения Обмен энергией между изучаемой системой и внешней средой описывают законы, которые изучает термодинамика. Согласно первому началу термодинамики теплота Q, подведенная к системе, расходуется на приращение внутренней энергии ΔU и на работу системы против действия внешних сил A: 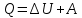 . (4.1) . (4.1)Положительными считаются работа, совершаемая системой, и теплота, подводимая к системе. Если на систему не действую никакие другие силы, кроме постоянного давления, то есть единственным видом работы является работа расширения, то 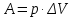 (4.2) (4.2)где p – давление; ΔV – изменение объема системы. Следовательно, в изобарных процессах (при p = const) 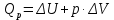 (4.3) (4.3)Вводя величину H = U = pV (ΔH = ΔU + pΔV), называемую энтальпия, получим 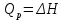 . (4.4) . (4.4)Таким образом, в изобарном процессе теплота, подведенная к системе равна изменению энтальпии системы ΔH. Согласно закону Гесса, изменение энтальпии химической реакции (тепловой эффект реакции при постоянном давлении) определяется лишь конечным и начальным состоянием системы и не зависит от пути перехода системы из одного состояния в другое. Согласно следствию закона Гесса изменение энтальпии реакции ΔrH равно разности между суммой энтальпий образования ΔfH исходных веществ с учетом стехиометрических коэффициентов ν:  . (4.5) . (4.5)Энтальпия образования соединения ΔfH определяется как изменение энтальпии реакции образования 1 моль этого соединения из соответствующих простых веществ. Обычно определяют изменение стандартной энтальпии реакции ΔrH˚ по стандартным энтальпиям образования веществ при 298 К, приведенным в справочниках и обозначаемым как ΔfH (тепловой эффект) и агрегатные состояния веществ, называется термохимическим уравнением. Коэффициенты в термохимических уравнениях могут быть как целыми, так и дробными. Изменение энтальпии в ходе химической реакции не служит критерием самопроизвольного (без затраты работы) протекания. Самопроизвольно могут протекать как экзотермические (ΔrH < 0), так и эндотермические (ΔrH > 0) процесса, служит изменение энтропии ΔrS можно рассматривать как меру неупорядоченности ее состояния. Согласно второму началу термодинамики в изолированных системах самопроизвольно протекают такие процессы, которые сопровождвются увеличением энтропии (ΔrS > 0). Для химической реакции в стандартных условиях: 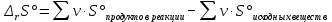 , (4.6) , (4.6)где S˚ – стандартные энтропии веществ. Движущей силой химических процессов, протекающих в неизолированных системах при постоянных давлении и температуре, является стремление к минимуму энергии (энтальпийный фактор) и максимуму энтропии (энтропийный фактор) Оба этих фактора учитывает энергия Гиббса (изобарно-изотермический потенциал G). При стандартных условиях для неизолированных систем 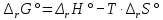 , (4.7) , (4.7)где T = 298 К Условие принципиальной возможности протекания процесса при T = const и при p = const в неизолированных системах: 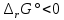 (4.8) (4.8)Если 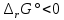 , протекание реакции принципиально возможно. Процесс принципиально невозможен в данных условиях, если , протекание реакции принципиально возможно. Процесс принципиально невозможен в данных условиях, если 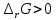 . В системе наступает термодинамическое равновесие, если . В системе наступает термодинамическое равновесие, если 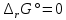 . .Чем более отрицательно значение 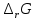 , тем дальше способна система находиться от состояния равновесия, тем более она реакционноспособна. , тем дальше способна система находиться от состояния равновесия, тем более она реакционноспособна.Рабочее задание Задание 1. Расчет изменения стандартной энтальпии реакции нейтрализации и оценка возможности самопроизвольного протекания процесса Согласно теории электролитической диссоциации нейтрализация сильной кислоты сильным основанием в разбавленном растворе отвечает следующему уравнению: 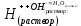 . .Рассчитайте изменение энтропии в ходе реакции нейтрализации при ст.у. 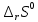 , а затем вычислите изменение энергии Гиббса , а затем вычислите изменение энергии Гиббса 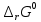 в ст.у. изобарно-изотермических условиях и сделайте вывод о возможности самопроизвольного протекания данной реакции в неизолированных системах. в ст.у. изобарно-изотермических условиях и сделайте вывод о возможности самопроизвольного протекания данной реакции в неизолированных системах.Таблица 7 Значения термодинамических функций
    Задание 2. Определение теплоты нейтрализации сильной кислоты сильным основанием Приступая к работе, выберите вариант задания в соответствии с последней цифрой номера в зачетной книжке. Таблица 7 Варианты задания
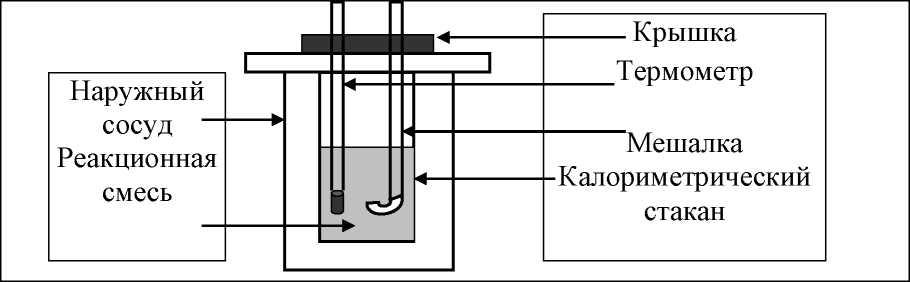 Рис.3. Схема калориметрической установки Взвесьте сухой внутренний калориметрический стакан на технических весах, запишите его массу – mстакана:__________ Отмерьте цилиндром заданный объем раствора NaOH с молярной концентрацией 1 моль/л, вылейте его в калориметрический стакан и, перемешивая, отметьте температуру раствора – Tначальная: ________ Затем добавьте такой же объем серной кислоты H2SO4 с молярной концентрацией 0,5 моль/л, закройте стакан крышкой, энергично перемешайте мешалкой и запишите максимальную конечную температуру опыта – Tконечная: __________ По полученным результатам рассчитайте: Разницу температур ∆T = Tконечная – Tначальная :  Суммарную массу раствора mраствора (г), находящегося в калориметрическом стакане, приняв его плотность ρ равной 1 г/мл: 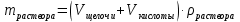 ; ; Теплоемкость системы cm (Дж/К) как сумму теплоемкостей раствора и стакана (теплоемкостью называется количество теплоты, необходимое для повышения температуры вещества на 1 K): 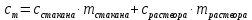 ; (4.9) ; (4.9)где 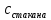 – удельная теплоемкость стекла (0, 753 кДж/(г∙К)); – удельная теплоемкость стекла (0, 753 кДж/(г∙К));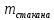 – масса стакана, г; – масса стакана, г;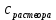 – удельная теплоемкость раствора (4, 184 Дж/(г∙К)); – удельная теплоемкость раствора (4, 184 Дж/(г∙К));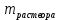 – суммарная масса раствора, г. – суммарная масса раствора, г. Количество теплоты q (Дж), выделившейся в калориметре: 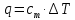 (4.10) (4.10) Число моль полученной воды 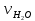 (моль), равное числу моль нейтрализованной щелочи: (моль), равное числу моль нейтрализованной щелочи: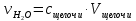 , ,где 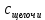 – молярная концентрация раствора щелочи NaOH, моль/л; – молярная концентрация раствора щелочи NaOH, моль/л;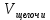 – объем раствора щелочи NaOH, взятый для опыта, л; – объем раствора щелочи NaOH, взятый для опыта, л; Тепловой эффект реакции нейтрализации (изменение энтальпии реакции) 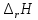 (кДж/моль): (кДж/моль):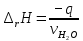 . (4.11) . (4.11) Сравните теоретическое значение теплоты нейтрализации 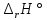 , полученное термодинамическим расчетом с использованием стандартных энтальпий образования веществ , полученное термодинамическим расчетом с использованием стандартных энтальпий образования веществ 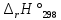 (задание 1) и значение теплоты нейтрализации, полученное экспериментально в задании 2. (задание 1) и значение теплоты нейтрализации, полученное экспериментально в задании 2.       Выводы Опишите способы определения и расчета тепловых эффектов химических реакций. Укажите, какие термодинамические функции служат критерием самопроизвольного протекания процессов в изолированных и неизолированных системах.       Домашнее задание Задание 1. При разложении 200 г карбоната кальция 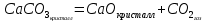 теплоты … теплоты …○ 1) затрачивается 177 кДж ○ 2) выделяется 177 кДж ○ 3) затрачивается 354 кДж ○ 3) выделяется 354 кДж Ответ подтвердите расчетом и укажите, от каких факторов зависит величина теплового эффекта.   СаО - 635 СО2; - 394. Вещество: СаСО3 Δf Н0, кДж / - 1206 моль:     Задание 2. При образовании 1 моль воды в соответствии с химической реакцией 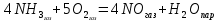 теплоты … теплоты …Ответ подтвердите расчетом:  Вещество: NH3 O2 NO H2O 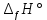 , кДж/моль -46 0 -94 -242 , кДж/моль -46 0 -94 -242    Задание 3. Изменение энергии Гиббса при гидролизе карбамида 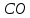 равно: равно:○ 1) -168 кДж ○ 2) 168 кДж ○ 3) -295 кДж ○ 4) 295 кДж Ответ подтвердите расчетом и укажите, в каком направлении (прямом или обратном) возможно его самопроизвольное протекание в стандартных условиях.  Вещество: Co(NH2)2 H2O CO2 NH3 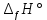 , кДж/ моль -33 -285 -394 -46 , кДж/ моль -33 -285 -394 -46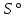 , Дж/(моль∙К) 105 70 214 193 , Дж/(моль∙К) 105 70 214 193    |

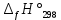 , кДж/моль
, кДж/моль