Решение перечисленных задач возможно только при наличии достаточного количества зарегистрированных и доступных для измерения показателей, отражающих уровень качества продукции.
 Скачать 253.46 Kb. Скачать 253.46 Kb.
|
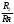 = R Rя — сопротивление ячейки = R Rя — сопротивление ячейкиR — магазин сопротивлений R1 R2 — переменные сопротивления, плечи реохорда G — скользящий контакт 4.1.4 Установка для выполнения кондуктометрического титрования При кондуктометрическом титровании в процессе анализа неоднократно регистрируется аналитический сигнал — электропроводность (или сопротивление), на основании этих измерений проводятся расчёты. Для этих целей служат специальные электролитические ячейки — сосуды с вмонтированными электродами, конструкция таких ячеек должна соответствовать интервалу измеряемых сопротивлений. Расстояние между электродами и их поверхность выбирают в зависимости от сопротивления раствора: чем выше измеряемое сопротивление, тем больше должна быть площадь электродов и меньше расстояние между ними. С учётом этого и выбирают электролитическую ячейку. Для каждой ячейки имеется характеристика — константа сосуда, которая должна быть постоянной при неизменном объёме раствора в области тех сопротивлений, которые измеряются в данной ячейке. Установка для кондуктометрического титрования. 2     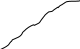      + +      Rx н.г. Rx н.г.             — 4 — 4    1 10000 3 1 10000 3    1000 1000   10 100 10 1005 Расходный мост Бюретка Платиновые электроды Стакан для исследуемого раствора Магнитная мешалка 4.1.5 Порядок выполнения титрования. В стакан для титрования помещают аликвоту исследуемого раствора и добавляют воду, чтобы электроды были полностью покрыты, м/мешалку и измеряют электропроводность, затем прибавляют рабочий раствор порциями, измеряя электропроводность после каждой порции. Следует провести 4-5 отсчётов электропроводности до точки эквивалентности и 4-5 отсчётов после точки эквивалентности. По полученным данным построить график зависимости удельной электропроводности от объёма израсходованного реактива.   Н Н  Т.э. V 4.2 Потенциометрические методы анализа 4.2.1 Основы метода Потенциометрические методы анализа основаны на том, что потенциал ряда электродов является функцией активности (концентрацией), поэтому измеряя электрохимический потенциал электрода, погружаемого в анализируемый раствор — определяют концентрацию испытуемого вещества. Потенциал электрода в растворе зависит от природы металла и от концентрации раствора, в который помещён электрод, эта зависимость выражается уравнением Нернста: Еме. = Е0ме. + 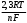 · ℓg[Me+n] (1) · ℓg[Me+n] (1)R — газовая постоянная — 8,314 Дж. T — абсолютная температура F — число Фарадея 96500 n — заряд иона 2,3 — коэффициент перевода ℓn → ℓg Уравнение (1) можно представить в виде: Еме. = Е0ме. + 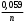 · ℓg[Men+] · ℓg[Men+]Е0 — нормальный, или стандартный потенциал данной окислительно-восстановительной системы, т.е. потенциал, который возникает в том случае, когда активности всех компонентов, участвующих в окислительно-восстановительном процессе, равны единице. Окислительно-восстановительная система, определяющая потенциал электрода, может находиться в растворе, в который электрод помещают, но может возникать при погружении электрода в раствор. В первом случае электродами являются инертные металлы (платина, золото и др.), которые не принимают участие в реакции, а служат лишь передатчиками электронов между компонентами окислительно-восстановительной системы, которые обуславливают величину потенциала электрода. Таким примером может служить платина, погружённая в раствор, содержащий ионы Fe2+ и Fe3+ . В этом случае на электроде протекает реакция: _ Fe3+ + e → Fe2+ Потенциал которой имеет вид: Е = Е0 + 0,059 ℓg[Fe3+]•[Fe2+] Если в окислительно-восстановительной реакции участвуют ионы водорода, то потенциал электрода зависит также от величины рН раствора. Хингидронный электрод является чувствительным на [H+]. Основной компонент электрода — эквимолекулярное соединение хинона и гидрохинона.   О ОН О ОН    С6Н4О2 С6Н4(ОН)2— зелёные кристаллы плохо растворимые в воде С6Н4О2 С6Н4(ОН)2— зелёные кристаллы плохо растворимые в воде Попадая в воду, распадается на хинон и гидрохинон: Гидрохинон диссоциирует в воде С   6Н4(ОН)2 С6Н4О22- + 2Н+ 6Н4(ОН)2 С6Н4О22- + 2Н+_ С   6Н4О22- С6Н4О2 + 2е 6Н4О22- С6Н4О2 + 2е—————————————_—— С   6Н4(ОН)2 С6Н4О2 + 2е 6Н4(ОН)2 С6Н4О2 + 2еПроисходит реакция окисления с участием [H+] Ехэ = Е0хэ + 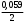 ℓg ℓg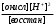 = Е0хэ + 0,059ℓg = Е0хэ + 0,059ℓg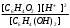 [Хиноны] и [Гидрохиноны] можно сократить, по условию они равны — смесь эквимолекулярна, отсюда: Ехэ = Е0хэ + 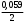 ℓg[Н+]2 = Ехэ + ℓg[Н+]2 = Ехэ + 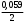 • 2рН = Е0хэ - 0,059рН • 2рН = Е0хэ - 0,059рНЕхэ = Е0хэ - 0,059рН Устройство хингидронного электрода очень просто — на дне стеклянного сосуда кристаллы хингидрона и туда же опущена платиновая пластинка — подвод и отвод ē.  Pt Pt    Исслед.раствор Исслед.раствор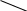 Кристаллы хингидрона Кристаллы хингидрона   Достоинство ― простота, устойчивость к загрязнению, возможность использования в неводных средах. Недостаток ― измерения можно производить до рН не более 8 и в отсутствии окисл. и восст. 4.2.2 Электроды, применяемые в потенциометрических методах анализа Во всех потенциометрических методах анализа используют гальванические элементы, включающие два электрода, помещённые в один и тот же раствор и измеряют ЭДС полученного гальванического элемента. Электрод, потенциал которого зависит от концентрации (активности) определяемого иона в растворе, называется индикаторным. Индикаторные электроды могут быть электродами I и П рода. Электроды I рода обратимы относительно ионов одного вида (металлическая пластина, опущенная в раствор собственной соли Cu/CuSO4, Ni/NiSO4). ЕCu0/Cu2+ = E0Cu0/Cu2+ + 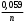 ℓg[Cu2+] ℓg[Cu2+]Часто используют электроды из серебра, ртути, кадмия, меди и некоторых других металлов. Хром, кобальт и ряд других не дают воспроизводимых результатов и электроды из этих металлов не применяются. Для измерения окислительно-восстановительного потенциала системы применяются электроды из благородных металлов ― Pt, Au, Ir или графита. К электродам I рода можно отнести водородный электрод, потенциал которого зависит от рН раствора. Е = Е0 + 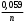 ℓg[H] ℓg[H]Е = Е0 + 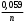 рН рННаряду с электродами I рода существуют электроды П рода, потенциал которых определяется концентрацией соответствующих анионов. Такие электроды представляют собой пластину металла, покрытую труднорастворимой солью этого металла и опущенная в раствор соли, содержащей одноимённый ион. К электродам П рода относятся хлорсеребряный, каломельный и др. Хлорсеребряный электрод изготавливают из серебряной проволоки, которую покрывают тонким слоем хлорида серебра, он помещён в раствор соли KCl. Хлорсеребряный электрод: Ag│AgCl│KCl EАg/Ag+ = ЕХ.С. + 0,059ℓg[Ag+] = EХ.С. + 0,059ℓg 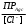 Для измерения потенциала индикаторного электрода в анализируемый раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемых ионов. Этот второй электрод называют электродом сравнения. В качестве индикаторных электродов используют электроды двух типов. Электродообменные, на межфазных границах которого протекают реакции с участием электронов. Ионообменные, на межфазных границах которого протекают реакции сопровождающиеся обменом ионов. Такие электроды называют ион-селективными. А). Ион-селективные электроды. Ион-селективные электроды широко внедряются в практику химического анализа, применяются для определения самых разнообразных веществ. Они подразделяются на несколько групп: а) Стеклянные электроды б) Твёрдые электроды с гомогенной или гетерогенной системой. в) Жидкостные электроды ( на основе ионных ассоциатов, хелатов металлов, нейтральных лигандов и тд.) г) Газовые электроды д) Электроды для измерения активности (концентрации) биологических веществ. Ион-селективные электроды представляют собой электрохимические полуэлементы, у которых разность потенциалов на границе раздела фаз Электрод ― Электролит зависит от концентрации (активности) определяемого иона в растворе. Электродом обычно является твёрдая или жидкая мембрана, способная обмениваться ионами с анализируемым раствором. Если ионы в раствор электролита проникают из мембраны, то её поверхность приобретает заряд, противоположный заряду перешедших в раствор ионов и на границе раздела фаз возникает потенциал, величина которого зависит от концентрации (активности) данных ионов в растворе. Если мембрана разделяет два раствора с различной активностью, то потенциал определяется уравнением Нернста. Е = Е0 + 0,059ℓg 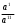 а1 ― активность (концентрация) ионов в первом растворе а11 ― активность (концентрация) ионов во втором растворе Обычно в одном из растворов активность (концентрацию) сохраняют постоянной (чаще внутри мембраны). Если а11 ― const, тогда: Е = Е0 + 0,59 ℓgа1 Т.е. потенциал индикаторного ион-селективного электрода зависит только от активности ионов первого раствора. Ион-селективные электроды находят широкое применение в практике физико-химического анализа. С помощью их можно быстро провести анализ по определению многих ионов, даже тех, которые другими методами не определяются. Существуют ион-селективные электроды для определения К+, Na+, Ba2+, Ca2+, Cu2+, NO3-, SO42-, PO43-, CN -, SCN -. Главным достоинством ион-селективных электродов является высокая избирательность определения. Чувствительной частью ион-селективного электрода является мембрана, которая разделяет два раствора, находящихся в контакте, на внутренний и внешний, поэтому электроды называются мембранными. Существуют различные классификации ион-селективных электродов, но наиболее удобна классификация по виду мембраны: 1 Электроды с твёрдой мембраной. а) Стеклянные б) С кристаллической мембраной в) С плёночной мембраной 2. Электроды с жидкой мембраной. 3. Специальные электроды ― газовые, ферментативные и др. В потенциометрии в качестве индикаторных обычно применяют мембранные (ион-селективные) электроды. Через мембрану возможно перемещение ионов одного вида, активность ионов внутри мембраны постоянна. Среди ион-селективных электродов наибольшее распространение получил стеклянный электрод, предназначенный для измерения рН. Устройство его довольно простое ― включает стеклянную трубку с шариком на конце. Шарик изготовлен из специального стекла, обладающего повышенной электропроводностью и заполнен стандартным раствором ― 0,1 М раствором HCl с добавками KCl или NaCl. Токоотводом служит хлор-серебряный электрод ― серебряная проволока, покрытая хлоридом серебра, к которой припаян изолированный провод. Шарик имеет толщину стенок 0,06-0,1 мм, изготовлен из стекла состава - 64% SiO2 28% Na2O 8% MgO Внутри стеклянной трубки помещена серебряная проволочка, покрытая труднорастворимой солью серебра AgCl, защищенная стеклянным кожухом. Ag, AgCl | HCl(0,1 M) || стекло || исследуемый раствор. Перед применение стеклянного электрода для определения рН ― его вымачивают в 0,1 М растворе HCl. В результате этой операции происходит обмен ионов. Ионы водорода из раствора кислоты обмениваются на ионы натрия в стекле шарика и на границе стекло кислота устанавливается равновесие:     Н+ Na+ Н+ Na+В таком состоянии электрод готов к работе. Потенциал стеклянного электрода обусловлен обменом ионов щелочных металлов, находящихся в стекле с ионами водорода раствора. Концентрация ионов водорода на внутренней поверхности стеклянной мембраны находится в равновесии с внутренним раствором HCl и на границе мембрана ― внутренний раствор устанавливается равновесный потенциал (Е1). При погружении стеклянного электрода в исследуемый раствор ионы водорода начинают перемещаться через стекло шарика (мембрану) из раствора с большой активностью, при этом на границе мембрана ― внешний раствор возникает равновесный потенциал (Е2). Разность этих потенциалов даёт общий потенциал стеклянного электрода: Ест. = Е1 + Е2 Электродная реакция на стеклянном электроде сводится к обмену ионами водорода между раствором и стеклом: Н |
