Решение перечисленных задач возможно только при наличии достаточного количества зарегистрированных и доступных для измерения показателей, отражающих уровень качества продукции.
 Скачать 253.46 Kb. Скачать 253.46 Kb.
|
  +(р-р) Н+(стекло) +(р-р) Н+(стекло)Т.е. она не связана с переходом электронов. Ионы водорода на поверхности внешней стороны мембраны находятся в равновесии с ионами водорода в исследуемом растворе и на границе раздела возникает потенциал. Е1 = Е10 + 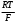 ℓn ℓn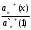 Где: ан+(х) ― активность ионов водорода в исследуемом растворе. а` н+ (1) ― активность ионов водорода на внешней поверхности мембраны. Аналогично на границе раздела внутренней поверхности мембраны возникает потенциал: Е2 = Е20 + 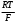 ℓn ℓn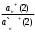 Где: ан+(2) ― активность ионов водорода во внутреннем растворе а` н+ (2) ― активность ионов водорода на внутренней поверхности мембраны. Суммарный потенциал стеклянного электрода: Ест = Е1 – Е2 = Е10 – Е20 + 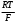 ℓn ℓn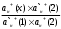 При постоянных значениях: а` н+ (1) ― активность ионов водорода на внешней поверхности мембраны а` н+ (2) ― активность ионов водорода на внутренней поверхности мембраны ан+(2) ― активность ионов водорода во внутреннем растворе Уравнение принимает вид: Ест = const + 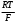 ℓn ан+(х) ℓn ан+(х)Т.е. потенциал мембраны характеризует рН исследуемого раствора. Или Ест = const + 0,059ℓgСн+ Величина const зависит от природы вспомогательного электрода сравнения, природы внутренного раствора и др. При определении рН, с использованием стеклянного электрода в паре с каломельным ― измеряют ЭДС цепи: Hg, Hg2Cl2│KCl│ ан+(х)│стекло│HCl│AgCl, Ag ЭДС цепи Е = Е1 – Е2 Е1 = Е0 Hg2Cl2/Hg – 0,059ℓg aCl-(1) – 0,059ℓg aн+(х) Е2 = Е0 АgCl/Аg – 0,059ℓg aCl-(2) – 0,059ℓg aн+(cт) Е = [Е0 Hg2Cl2/Hg - Е0 АgCl/Аg + 0,059ℓg 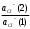 + 0,059ℓg H+(ст) – 0,059ℓg aH+|(x) = Eст – 0,059ℓп ан+(х) + 0,059ℓg H+(ст) – 0,059ℓg aH+|(x) = Eст – 0,059ℓп ан+(х)Стеклянные электроды обладают рядом достоинств: а) Широкий диапазон значений рН (от 0 до 13), который можно измерять стеклянным электродом. б) Быстрота достижения равновесия и простота работы. в) Возможность использовать электрод в присутствии окислителей, восстановителей, коллоидных растворов и пр. Одним из недостатков стеклянного электрода является его хрупкость. Другим недостатком ― является искажение результатов, если рН внутреннего раствора близок к рН исследуемого. Сухие электроды очень слабо реагируют на изменение рН анализируемого раствора, поэтому перед началом измерений сухие электроды необходимо выдержать в соответствующем буферном растворе, после этого провести калибровку электрода, сверяя показания потенциала на приборе с известной рН. Выпускаемые стеклянные электроды для измерения рН (ЭСЛ - 11Г –0,5, ЭСЛ – 41Г – 0,4, ЭСЛ – 63 – 0,7, ЭСЛ – 43 – 07) пригодны для измерения рН в интервале от 0 до 14. Выпускаются стеклянные электроды для измерения активности щелочных металлов, например, ЭСNА – 51 – 7 для ионов Na+ и ЭСЛ – 91 – 07 ― для ионов К+. К электродам с твёрдой мембраной относятся электроды с кристаллической мембраной, когда в качестве мембраны используют моно – или поликристаллы труднорастворимых в воде солей с ионным характером.    1 ― мембрана 1 ― мембрана  2 ― корпус электрода 2 ― корпус электрода   6 3 ― внутренний раствор (0,1 М р-р 6 3 ― внутренний раствор (0,1 М р-ропределяемого иона и KCl) 4 ― внутренний полуэлемент Ag/AgCl  5 5 ― место припоя 5 5 ― место припоя4 6 ― экранированный провод  3 2     1 Самый чувствительный участок электрода ― мембрана. Перенос заряда в кристаллической мембране происходит за счёт дефектов кристаллической решётки ― ионы перемещаются в пустующие узлы решётки. Если мембрана неоднородна, гетерогенна ― в ней активный компонент ― кристалл внедрён в инертный связующий материал ― полиэтилен, эпоксидную смолу и т.д. Твёрдым ион-селективным электродом является фтористый электрод, в котором монокристалл LaF3 является мембраной, чувствительность такого электрода позволяет измерять концентрацию F – от 10 –6 до 1 м/л. Ион-селективный электрод с мембраной из сульфида серебра для измерения ионов Ag+ и S2-. Электроды на основе сульфида серебра с добавкой соответствующего галогенида серебра позволяют измерять Cl -, J -, Br -, CN – и др. Введение в сульфид серебра сульфидов других металлов позволяет получить электрод, чувствительный к ионам металлов, внесённых со вторым сульфидом (Cd2+, Pb2+, Cu2+). Широкое применение получают твёрдые электроды с плёночной мембраной. В таких мембранах тонкоизмельчённое активное вещество ― кристаллы ― заключено в неэлектропроводную матрицу, изготовленную из полистирола, агар-агара, каучука, полиэтилена, эпоксидной смолы и др. В качестве активного вещества применяют соли ― галогениды, сульфиты, оксалаты и др. Конструкция электродов с плёночной мембраной аналогична конструкции электродов с кристаллической мембраной, только вместо мембраны вклеена матрица, а внутрь электрода залит раствор сравнения 0,1 м KCl и 0,1м соли измеряемого иона (для нитрат-селективного ― нитрат калия, для фторид-селективного ― фторид натрия и т.д.). Перед работой плёночные пластифицированные электроды вымачивают в анализируемом растворе в течение суток. К электродам с плёночной мембраной относится нитрат-селективный электрод ― ЭМ – NO3 – 01. В настоящее время широко применяются электроды с жидкой мембраной. В электродах с жидкой мембраной раствор сравнения отделён от анализируемого тонким слоем органической жидкости, содержащей жидкий ионит, не смешивающийся с водой, но селективно реагирующий с определяемым ионом. Жидкие мембраны готовят из жидких или твёрдых ионитов или их растворов в подходящих органических растворителях, не смешивающихся с водой и могут быть катионными, анионными и нейтральными. Существуют катионные жидкие мембраны на Са2+, Ва2+, Zn2+, Pb2+, Cu2+, Sb3+, изготовленные на основе высокомолекулярных кислот и из волей. Анионные жидкие мембраны изготавливают на основе аминов и четвертичных аммониевых оснований. Нейтральные жидкие мембраны могут быть изготовлены на основе органических соединений, способных связывать катионы щелочных и щелочноземельных металлов. В качестве растворителей обычно используют эфиры, например, октиловый или дециловый эфир фосфорной кислоты, дибутилфосфат и др. в электродах этого типа возникновение потенциала на границе раздела фаз обусловлено ионным обменом, связанным с различием констант распределения между жидкой и органической фазами. Ионная селективность достигается за счёт различия в константах распределения, устойчивости комплексов и различной подвижности определяемого и мешающего ионов в фазе мембраны. Потенциал-образующими ионами являются катионы или анионы ионных ассоциатив, т.е. электрод с катионно-анионным ассоциатом чувствителен и к катионам и к анионам, входящим в состав ассоциата. При применении мембраны для определения анионов селективность анионочувствительных электродов распределяется таким образом: ClO4- > SCN - > J - > BF4- > NO3- > Br - > Cl - >J – На основании этого ряда можно установить возможность определения одного из ионов в присутствии других. Например, открытию нитрат ионов (NO3-) мешают все анионы, стоящие в этом ряду влево от него и не мешают те, которые расположены вправо от него. Устройство ион-селективного электрода с жидкостной мембраной довольно простое. Электрод с жидкостной мембраной. В резервуаре 2 находится ионочувствительная жидкость, органического ионита, пропитывающая мембрану. Органический ионит имеет основные, кислотные или хелатообразующие функциональные группы, растворяется в подходящем растворителе, которые не смешиваются с водой. Для определения кальция (Са2+) в качестве жидкого ионита берут кальциевую соль алкилфосфорной кислоты RСu(O)2PO, растворённую в диалкилфенилфосфонате (R2C6H5PO) или аналогичном компоненте. В качестве раствора сравнения внутреннего серебряного электрода применяют CaCl2, в котором [Ca2+] постоянно и потенциал электрода будет зависеть только от концентрации иона Са2+ в анализируемом растворе. При этом с каждой стороны ион-селективной мембраны устанавливается равновесие. СаR2(орг ↔) ↔ 2R(орг) + Са2+воды и Е = Е0мембр. 0 0,0291 ℓg[Ca2+] Такие электроды имеют чувствительность 10 –5 – 1 м/л в области рН 6,0 до 11,0. В практике применяют ион-селективные мембранные электроды на ионы К+, Na+, NH4+ и некоторые другие. Электроды с газовой мембраной позволяют определить содержание газов при анализе почвы, морской и речной воды, биологических жидкостей, промышленных газов, выхлопов и т.д. Действие электродов основано на взаимодействии газов с водой и образованием ионов: CO2 + H2O ↔ HCO3- + H+ SO2 + H2O ↔ HSO3- + H+ H2S + H2O ↔ HS - + H+ NH3 + H2O ↔ NH4+ + OH – Анализ сводится к определению образовавшихся в растворе ионов Н+ или ОН -, определению рН. Для работы собирают гальванический элемент, где в качестве индикаторного электрода стеклянный электрод, а в качестве электрода сравнения ― хлорсеребряный. Оба электрода помещают в жидкость с растворённым газом и определяют ЭДС элемента. Сосуд, в котором происходит растворение газа имеет газопроницаемую мембрану, проходя через неё, газ растворяется и с помощью электродов определяется концентрация обращающихся ионов в растворе. Ион-селективные электроды служат в качестве индикаторных и они отличаются большой чувствительностью. Предел обнаружения ионов с их помощью 10 –5 – 10 –7 м/л (иногда до 10 –19 м/л), минимальное количество пробы для одного определения 0,05 – 1 мл. Они отличаются высокой селективностью, особенно мембранные электроды. В). Коэффициент селективности Мембранные электроды проявляют селективность по отношению к ионам одного вида, концентрацию которых можно измерить в присутствии других ионов, не входящих в состав мембраны. Важной характеристикой ион-селективных электродов является его коэффициент селективности, который показывает, во сколько раз электрод более чувствителен к данным ионам, чем к посторонним (мешающим). Например, коэффициент селективности натриевого электрода по отношению к ионам калия составляет 1000, т.е КсNa+/K+ = 1000, это значит, что данный электрод в 1000 раз чувствительнее к ионам Na, и если он имеет потенциал Е при [Na+] = 10 –3моль/л, то для достижения такого же потенциала потребуется [K+] = 1 моль/л. мембранные электроды проявляют селективность по отношению к ионам одного вида, концентрацию которых можно измерять в присутствии посторонних ионов, не входящих в состав мембраны. Селективность мембраны в этом случае зависит от способности ионов мембраны обмениваться с посторонними ионами раствора. Например, если в мембране содержатся иона Са2+, а в растворе кроме них ещё и посторонние Sr2+, то селективность мембраны по отношению с Са2+ характеризуется степенью возможности обмена: Sr2+ + Ca2+ → Sr2+ + Ca2+ Раствор мембрана мембрана раствор Кр = 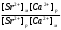 > > Найдём Кр, чем больше Кр, т.е. чем больше равновесие сдвинуто вправо, тем меньше селективность. Селективность зависит также от соотношения подвижностей Sr2+ и Са2+ в мембране и уменьшается с увеличением этого соотношения. ŪСа2 КСа2/Sr2+ =  ——— = Кр ——— = КрŪSr2+ ŪСа2 и ŪSr2+ — подвижность ионов Са2+ и Sr2+ в мембране Кр — константа равновесия реакции обмена в мембране. Это соотношение представляет коэффициент селективности иона Са2+ по отношению к иона Sr2+, который является количественной мерой чувствительности электрода к двум ионам. Потенциал ион-селективного электрода зависит от концентрации определяемого иона в растворе, и он всегда играет роль индикаторного электрода. 4.2.3 Прямая потенциометрия – ионометрия. В потенциометрических методах анализа применяют гальванический элемент, состоящих из двух электродов. Один электрод является индикаторным, потенциал его зависит от концентрации (активности) определяемого иона. В качестве индикаторных электродов можно применять ион-селективные электроды, чувствительные на определяемый ион, с мембраной разного вида. Для измерения потенциала индикаторного электрода в анализируемый раствор погружают второй электрод, потенциал которого не зависит от концентрации определяемого иона и называется электродом сравнения. В качестве электродов сравнения можно применить нормальный водородный электрод, потенциал которого равен нулю при н.у., а также электроды П рода — хлорсеребряный, каломельный и ряд других. Основным требованием к электродам сравнения является постоянство его потенциала, простота изготовления. Постоянство потенциала обеспечивается, если поддерживать постоянной концентрацию внутреннего раствора. Хлорсеребряный электрод (Ag, AgCl/KCl) чаще других применим в качестве электрода сравнения. Его можно применять в паре со стеклянным электродом при определении рН раствора, а также в паре с некоторыми ион-селективными электродами. Электрохимическая схема пары стеклянный электрод — хлор-серебряный Ag | AgCl | HCl(0,1) стекло||исслед. р-р || KCl | AgCl | Ag Стеклянный электрод насыщенный хлор-серебряный электрод Во всех проводимых определениях с использованием методов прямой потенциометрии-ионометрии используется зависимость потенциала индикаторного электрода (обычно ион-селективного) от активности или концентрации определяемого компонента, используя для расчётов метод градуировочного графика, метод добавок, молярного свойства и т.д. Применение ион-селективных электродов позволяет быстро решать многие аналитические задачи и даёт возможность проводить многочисленные задачи на основе составленных матриц. Например, используя ион-селективный электрод (нитрат-селективный) можно быстро и точно определить содержание нитрат-иона в технических, биологических, экологических и других объектах. (Определение нитрат-иона другими методами представляет сложную аналитическую задачу, трудоёмкую, состоящую из нескольких стадий). Используя ионометрию, составляют гальванический элемент из нитрат-селективного пластифицированного электрода (с плёночной мембраной) и хлорсеребряного электрода сравнения. По точной навеске методом разбавления готовят серию стандартных растворов KNO3 (или NaNO3), при этом стандартные растворы готовят на фоне 1 м K2SO4, чтобы иметь постоянную ионную силу раствора. Погружают электроды в стандартные растворы (от разбавленного к концентрированному) и регистрируют зависимость ЭДС гальванического элемента от концентрации нитрат-иона, строят калибровочный график Е = f(с) или Е = f(-ℓg c). Затем берут навеску анализируемого образца на аналитических весах (до 0,0001 г) переносят в мерную колбу на 100 мл, добавляют до метки и в том же аппаратном исполнении определяют ЭДС. По калибровочному графику находят С или -ℓg С 4.3.4 Потенциометрическое титрование Потенциометрическое титрование основано на определении точки эквивалентности по результатам потенциометрических измерений. Вблизи точки эквивалентности происходит резкое изменение (скачок) потенциала индикаторного электрода. Как и в прямой потенциометрии, для потенциометрического титрования собирают цепь из индикаторного электрода, чувствительного к определяемому иону и электрода сравнения, но метод имеет ряд преимуществ: Позволяет вести определение в присутствии посторонних веществ, влияющих на потенциал индикаторного электрода, путём подбора титранта, реагирующего с определяемым веществом. При использовании электродноактивных титрантов позволяет определить вещества, для которых отсутствуют селективные электроды. При окислительно-восстановительном титровании в качестве индикаторного используют электрод из Pt или другого благородного металла. При кислотно-основном титровании в качестве индикаторного может быть использован стеклянный электрод или другой рН-чувствительный, например хингидронный. При реакции осаждения выбирают электрод, чувствительный к определяемому веществу или к применяемому титранту. Например, серебряный электрод может быть применён как индикаторный при осаждении ионов серебра, а так же для определения ионов (Cl -, Br -, CN -, SCN -, AsO43-, CrO42-) образующих малорастворимые соли серебра при использовании в качестве титранта раствора AgNO3. Комплексонометрическое титрование обычно проводят с металлическими электродами, соли меди — с медным, соли никеля — с никелевым, или соответствующим ион-селективным. Задача потенциометрического титрования сводится к определению объёма титранта, затраченного на реакцию, к определению точки эквивалентности. Самый удобный и простой способ определения точки эквивалентности по кривой титрования, которая строится по результатам титрования. При этом на оси абсцисс откладывается объём прилитого раствора — (мл), а на оси ординат — соответствующее значение Е (ЭДС) ячейки. В точке эквивалентности наблюдается резкий скачок ЭДС. В зависимости от выбранной величины кривая титрования может быть интегральной, выражающей прямую зависимость ЭДС системы от объёма прилитого раствора и точка эквивалентности находится по её перегибу (похожа на кривую титрования в методе нейтрализации). Дифференциальная кривая выражает зависимость изменения величины ΔЕ : ΔV от объёма прилитого рабочего раствора, кривая имеет вид пика, max пика соответствует точке эквивалентности. Δ |
